תַקצִיר
מאמר זה מבוסס על ריאיון שנערך בין פרופסור מרטין צָ’לְפִי לבין נועה שגב.
מדענים משתמשים בתצפיות כדי לבצע מחקר. הם מתבוננים בתופעה שמעניינת אותם ומנסים להבין אותה, תוך שימוש בכלים המתקדמים ביותר שברשותם. לעיתים קרובות המדענים עומדים בפני אתגר כשהם רוצים לבחון ולמדוד את מושא המחקר שלהם כדי לראות דברים שאף אחד לא ראה בעבר. טכניקות ההדמיה המודרניות מאפשרות למדענים לראות דברים שאי אפשר היה לראות קודם לכן. במאמר זה אספר לכם על אחת מאותן פריצוֹת הדרך בתחום ההדמיה, המבוססת על חלבון זוהֵר נפלא בשם חלבון פְלוּאוֹרֶסְצֶנְטִי ירוק – ה-GFP .(Green Fluorescent Protein) ה-GFP לא שינה רק את חיי אלא את חייהם של מדענים רבים אחרים, וכתוצאה מכך גם את חייהם של רבים שאינם מדענים. ה-GFP מאפשר לנו, בין היתר, לזהוֹת פעילוּת של חלבונים ושל תאים שלמים בבעלי חיים ולצְפות בה, וכן לזהוֹת פעילוּת של גֵנים המקודדים לחלבונים ספציפיים. אני מקווה שבעקבות קריאת המאמר תבינו הרבה יותר טוב את ה-GFP ואת הדרך שבה הוא מאיר את המדע.
פרופ’ מרטין צָ’לְפִי זכה בפרס נובל לכימיה לשנת 2008 עם פרופ’ אוֹסָאמוּ שִימוֹמוּרָה ועם פרופ’ רוג’ר טְסְיֶין על גילוי ופיתוח החלבון הפלואורסצנטי הירוק – GFP.
מדוזות זרחניות וטעות פלאית
האם נפלה בחלקכם אֵי פעם הזכות לראות את יופייה של גחלילית זוהרת המאירה לילה חשוך? גחליליות נכללות בקבוצה מרתקת של אורגניזמים שיכולים לייצר אור – התופעה נקראת בִּיּוֹלוּמִינֵסֶנְצִיָה. אורגניזמים נוספים המייצרים אור כוללים תולעים זוהרות, סוגים מסוימים של חיידקים וסוגים מסוימים של דגים. הסיפור שלנו מתחיל עם מדוזה מפיצת-אור בשם אֶקְווֹרֵאָה וִיקְטוֹרְיָה (Aequorea Victoria), או בקיצור A-ויקטוריה (איור 1).

- איור 1 - אוֹסָאמוּ שִימוֹמוּרָה ומדוזת אֶקְווֹרֵאָה וִיקְטוֹרְיָה הזרחנית.
- אחרי יום מתסכל במעבדה, פרופ’ שימומורה כיבה את האורות והתכוון לצאת לכיוון ביתו ולאכול ארוחת ערב. לפתע הוא הבחין שהכיור שבו היו דגימות של תאֵי A - ויקטוריה ומֵי-ים, זוהֵר בצבע כחול. חקירת התופעה הזאת הובילה אותו לגלות את החלבון מפיץ-האור – אֶקְווֹרִין. איור: איריס גת.
- A, Victoria jellyfish = מדוזת A-ויקטוריה.
בשנות ה-60 של המאה שעברה מדען יפני בשם אוֹסָאמוּ שִימוֹמוּרָה רצה להבין כיצד אורגניזמים ביולומינסנטים מפיקים אור. הוא החליט לחקור את המדוזה אֶקְווֹרֵאָה ויקטוריה, שמייצרת אור ירוק. אוסאמו עבד במשך כל הקיץ, וניסה לגרום לתאים של A - ויקטוריה להפיץ אור (כמו שקורה באופן טבעי בים), אבל אף לא אחד מהניסויים שלו צלח. לילה אחד, כשכבר היה חשוך בחוץ ואוסאמו התכוון לחזור הביתה ולאכול ארוחת ערב, הוא השליך את הדגימות של חלבוני A - ויקטוריה מאחד הניסויים הכושלים לכיור המעבדה, וכיבה את האור לפני שנעל את הדלת. בדיוק כשהוא עמד לעזוב, הוא הבחין שהכיור זוהר בצבע כחול. כיוון שהכיור הכיל גם מֵי-ים, אוסאמו חשב שמשהו במֵי-הים גורם להפקת האור. עד מהרה הוא הבין שהסידן שנמצא במֵי-הים גורם לחלבוני המדוזה להאיר. הוא קרא לחלבון הזוהֵר בכחול אֶקְווֹרִין, על שם המדוזה [1, 2].
לאחר פריצת הדרך הגדולה הזו, עמדה בפני אוסאמו עוד שאלה חשובה: מדוע האֶקְווֹרִין מייצר אור כחול, בעוד שהמדוזות שמהן הוא מגיע, זוהרות בירוק? בתהליך זיקוק חלבון האֶקְווֹרִין, אוסאמו חיפש רכיב אחר שיכול ליצור את האור הירוק שפולטות המדוזות מסוג A-ויקטוריה. בסופו של דבר, הוא מצא חלבון נוסף שהוא מולקולה פְלוּאוֹרֵסְצֶנְטִית, כלומר חלבון שממיר אור כחול, שמקורו באקוורין או במנורה פשוטה, לאור ירוק. זאת הייתה עוד תגלית מדהימה, שכן באותה תקופה לא היה ידוע שחלבונים יכולים להיות פלואורסצנטיים. על אף שאוסמו כינה את החלבון בשם ”החלבון הירוק” במקור, כיום אנו קוראים לו חלבון פְלוּאוֹרֵסְצֶנְטִי ירוק, או GFP בקיצור [3]. הסיפור הזה הוא דוגמה נפלאה לכך שתגליות מדעיות עשויות להיות מקריות למדי. תפקידם של המדענים, כמו במקרה של אוסאמו, הוא לעיתים לשים לב, לתהות ולחקור את התגליות המקריות הללו.
כך ה-GFP שינה את חיי
בצוהרי יום שלישי, 25 באפריל, 1989, שמעתי הרצאה באוניברסיטה על עבודתו של אוסמו שימומורה על ה-GFP. ברגע ששמעתי על GFP הייתי מוקסם. במעבדה שלי התנהל בזמנו מחקר על תולעת שקופה זעירה (באורך של כ-1 מ”מ) בשם קָאֶנוֹרְהָבְּדִיטִיס אֶלֶגָנְס (Caenorhabditis elegans), או בקיצור C-אלגנס. חקרנו קבוצת תָּאי עָצָב של התולעת המגיבים לגירויים פיזיים, כמו מגע וקול, וממירים אותם לאותות חשמליים וכימיים. תהיתי אם נוכל למצוא דרך לגרום לתאֵי העָצָב של C-אלגנס לייצר GFP, כדי שנוכל לראות ולחקור אותם בצורה חדשה לגמרי, וכך נוכל להשתמש ב-GFP כסַמָּן ביולוגי – זוהי מולקולה ביולוגית בה מדענים יכולים לצפות כדי ללמוד מה קורה בתוך תאים או אורגניזמים. באותה התקופה השיטה שבה השתמשנו כדי לראות סוגֵי תאים ספציפיים ב-C-אלגנס הייתה מסורבלת ולא אִפשרה לנו לעבוד עם רקמה חיה. ראשית, היה עלינו ”לקבֵּע” את התולעת באמצעות כימיקלים כדי לשמר את מבנה התא, אבל התהליך הזה גם הרג את החיה. משמעות הדבר הייתה שהשיטה אִפשרה לנו רק תמונת מצב רגעית של מה שקורה בתוך התולעת – תמונה בודדת בכל פעם. בעקבות ההרצאה חשבתי על הפוטנציאל של ה-GFP למחקר שלי: ה-GFP עשוי לאפשר לנו לראות את תאֵי העָצָב של C-אלגנס כשהתולעת חיה ומקיימת אינטראקציה עם הסביבה שלה.
הייתי נרגש מאוד ולא הפסקתי לחשוב על ה-GFP. יצרתי קשר עם החוקר דאגלס פראשר (Douglas Prasher), שעבד על ייצור והעתקה של ההוראות הגנטיות (דנ”א) המקודדות לחלבון ה-GFP. שנינו התלהבנו מהאפשרות להשתמש ב-GFP ב–C-אלגנס ובאורגניזמים אחרים, אך מסיבות שונות איבדנו קשר ושיתוף הפעולה שלנו התחיל רק בספטמבר 1992, כאשר הסטודנטית Ghia Euskirchen הגיעה למעבדה שלי והתעניינה בפרויקט. היה לה רקע בעבודה עם פלואורסצנטיות, וזה הזכיר לי את הרעיון שלי להשתמש ב-GFP כדי לסמֵן תאים חיים. כאשר חקרנו מאמרים מדעיים שפורסמו על GFP, גילינו שדאגלס פרסם לאחרונה מאמר על החלבון [4] ויצרנו עימו שוב קשר. זמן קצר לאחר מכן, הוא שלח לנו את קידוד הדנ”א עבור GFP והסטודנטית התחילה להשתמש בו בעבודתה.
כיצד גורמים לאורגניזמים להפיץ אור באמצעות חלבון ה-GFP?
כאשר הסטודנטית Ghia התחילה את הניסויים שלה ב-GFP, היא רצתה לראות אם חיידקים המכילים את הדנ”א שמקודד ל-GFP יהפכו לפלואורסצנטיים. באותה התקופה לא ידענו אם די בהפקת חלבון ה-GFP מדנ”א של GFP כדי להפוך תא לפלואורסצנטי (למידע נוסף על ייצור חלבונים מדנ”א ראו מאמר זה). תהינו אם יהיה צורך ברכיב נוסף – משהו שהתא עצמו מייצר ומוסיף לחלבון ה-GFP כדי לגרום לו להאיר, או משהו חיצוני שצריך להוסיף כדי לגרום לתאים להפיץ אור.
ההחלטה הראשונה שהיינו צריכים להחליט בתחילת הניסוי הייתה מה לעשות עם הדנ”א של חלבון ה-GFP שקיבלנו מדאגלס. בנוסף למקטע שמקודד עבור GFP, הדנ”א הזה הכיל רצפים נוספים (איור 2A). ידענו שעלינו לייצר עותקי דנ”א רבים של חלבון ה-GFP עבור הניסויים שלנו, והתלבטנו האם להשתמש בדנ”א של ה-GFP כמו שהוא (עם החלקים הנוספים) או לעבוד רק עם החלק שקודד עבור GFP. האתגר היה שהשיטה ששימשה לקבלת הדנ”א המקודד ה”נקי”, הנקראת תגובת שרשרת פּוֹלִימֵרָאזִית (או PCR – שאתם אולי מכירים מבדיקות ה-PCR לגילוי וירוס הקורונה (COVID-19)) [5], יצרה לעיתים קרובות טעויות בדנ”א המועתק. למרות המגבלה הזו, החלטתי שנשתמש ב-PCR, כיוון שהיה בכוונתנו לבחון מיליוני חיידקים, ולחלקם יהיה דנ”א של חלבון ה-GFP ללא טעויות.
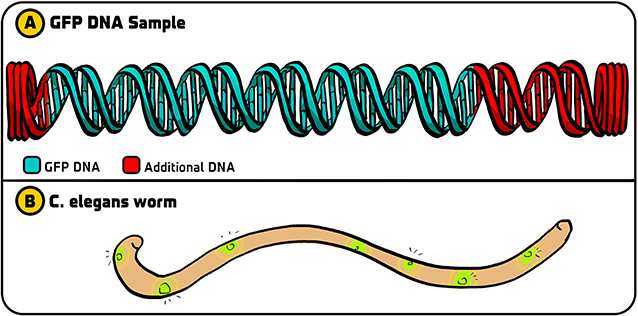
- איור 2 - הניסויים הראשוניים עם GFP.
- (A) הדנ”א המקורי של חלבון ה-GFP שקיבלנו מ-Douglas Prasher הכיל את הדנ”א שקודד ל-GFP (ירוק) עם פיסות דנ”א נוספות בכל צד (אדום). (B) לאחר שיצרנו עותקים של הדנ”א של חלבון ה-GFP ה”נקי” באמצעות PCR, יכולנו להשתמש בדנ”א הזה ב-C-אלגנס, כך שתאים מסוימים של התולעת הפיצו אור ירוק. איור: איריס גת.
- GFP DNA Sample = דגם של דנ”א ה-GFP;
- C. elegans worm = תולעת C-אלגנס.
כפי שהתברר בהמשך, בחרנו באסטרטגיה הנכונה. הסטודנטית השתמשה ב-PCR כדי להעתיק את הדנ”א של ה-GFP. לאחר מכן, היא שילבה את הדנ”א של חלבון ה-GFP לתוך מולקולת דנ”א הנקראת פְּלָסְמִיד, שחיידקים ”בולעים” ומכניסים אותו אל תוך הדנ”א שלהם. כשהארנו באור כחול על חיידקי ה-E-קוֹלִי המכילים דנ”א של ה-GFP, הם החלו להפיץ אור [6]. לעומת זאת, בקבוצות האחרות שהשתמשו ב-GFP המקורי עם רצפי הדנ”א הנוספים לא ראו פלואורסצנטיות. משהו בדנ”א הנוסף הפריע לייצור של GFP, כך שאם לא היינו משתמשים ב-PCR, הניסוי שלנו לא היה עובד. כיוון שהשיטה שלנו עבדה בחיידקים, השתמשנו בה לאחר מכן כדי לשלב דנ”א של GFP ב-C-אלגנס, כפי שחלמתי לעשות במקור, וגרמנו גם לתולעים האלו להפיץ אור (איור 2B). כך סללנו את הדרך לשילוב חלבון ה-GFP בכל מיני אורגניזמים, כמו גם ליישומים אחרים.
כך ה-GFP שינה את המדע
כל התפתחות מדעית חדשה יכולה לספק לנו הבנה טובה יותר של עקרונות ביולוגיים או פיזיקליים בסיסיים, וכן לסייע ביצירת טכנולוגיות חדשות. לעיתים קרובות, ככל שחולף הזמן, התגלית המקורית מתפתחת לכיוונים מפתיעים ובלתי צפויים. גילוי הלייזר הוא דוגמה טובה לכך; צ’ארלס טָאוּנְס (Charles Townes), שעבודתו הובילה ליצירת הלייזר, מעולם לא תיאר לעצמו שישתמשו בלייזר בחנויות מכולת לסריקת מחירי מוצרים, בתעשיית התקליטים לייצור תקליטורים, בעסקי הסרטים לייצור תקליטורי DVD, או בתחום הרפואה לביצוע ניתוחי לייזר. הדבר נכון גם לגבי גילוי ה-GFP – הוא התפתח וימשיך להתפתח בכיוונים רבים ושונים התורמים הן לידע המדעי הבסיסי והן ליישומים טכנולוגיים שונים.
במחקר המדעי ה-GFP יכול לשמש סמן ביולוגי כדי לספר לנו על פעולת הגֶּנִים והתוצרים שלהם. כדי להבין את מבנה הגֵנים נוכל לדמיין כאילו יש להם שני חלקים: החֶלֶק המקוֹדד שמציין איזה תוצר יש לייצר (ה-RNA והחלבון); והחֶלֶק הרגולטורי שאומר היכן, מתי וכמה מהתוצר יש לייצר. אם מוסיפים את רצף הדנ”א של ה-GFP רק לחלק הרגולטורי, ה-GFP ייווצר ויפיץ אור בכל פעם שהגֵן הרגיל ”מופעל”. לחלופין, אם מוסיפים לרצף הקידוד את רצף הדנ”א של ה-GFP, חלבון ה-GFP יהיה מחובר לחלבון הרגיל, והוא יזהַר כאשר נאיר עליו באור כחול [7]. שיטה זו מאפשרת לנו לראות היכן שוכנים החלבונים בתאים (למשל, בגרעין, בממברנת התא) וגם לצְפות בהם בעודם נעים בתאים חיים, מה שלא היה אפשרי בשיטות קודמות. יתרון חשוב נוסף בשיטה הזאת הוא שברגע שמחדירים דנ”א של GFP לדנ”א של אורגניזם, הוא מועבר לצאצאים של אותו אורגניזם.
ברצוני להזכיר בקצרה שתי תגליות שאני מעריץ באופן אישי שנעשו באמצעות GFP. הראשונה נעשתה על ידי Clifford Brangwynne ו- Anthony Hyman ב-2009 [8]. הם בחנו חלבונים הנמצאים בתוך הצִיטוֹפְּלַזְמָה – הנוזל הממלא את התאים. עד אז, מדענים חשבו שהציטופלזמה די אחידה, אבל כשהמדענים האלה התבוננו על חלבון מסוים בציטופלזמה שסומן ב-GFP, נראה היה שהוא ”כלוא” בחלקיקים נפרדים משאר הציטופלזמה. החלקיקים הללו התנהגו כמו טיפות זעירות של שמן במים – לעיתים הם התאחדו והתמזגו, ולעיתים הם התפצלו לשניים. המבנים הללו לא התערבבו עם שאר הציטופלזמה, אלא הם היו בפאזה (מצב) נפרדת (לעיתים קרובות הם נקראים חלקיקים מוּפְרְדֵי-פאזה (איור 3A)). זוהי תגלית שתרמה רבות להבנת מבנֶה הַתָאים ותפקודם, ויצרה תחום מחקר פעיל מאוד.
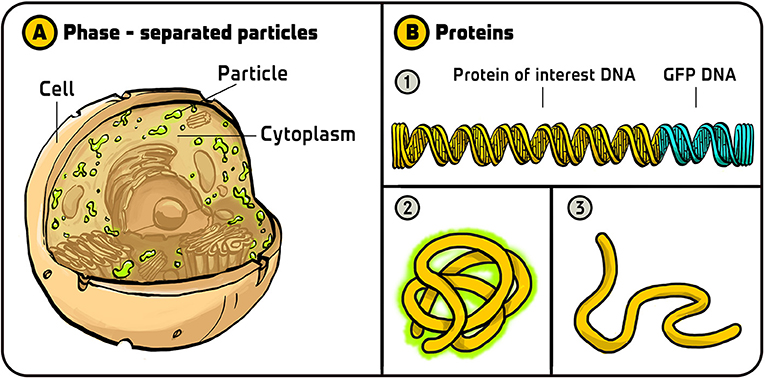
- איור 3 - שימושים של GFP.
- (A) כאשר Clifford Brangwynne ו-Anthony Hyman השתמשו ב-GFP, הם גילו שהציטופלזמה של תאים מכילה שתי פאזות (מצבים) נפרדות – פאזה נוזלית, שהייתה מוּכרת במדע, ופאזה נוספת שמתנהגת כמו חלקיקי שמן במים. (B)Geoff Waldo השתמש ב-GFP כדי לעקוב אחר קיפולי חלבונים. (1) הוא הוסיף דנ”א של GFP לסוף הדנ”א שמקודד לחלבון שעניין אותו. (2) כאשר החלבון (הכולל את חלק ה-GFP) התקפל בצורה נכונה, הוא הפיץ אור ירוק (3) כאשר החלבון התקפל בצורה לא-נכונה, הוא לא הפיץ אור. איור: איריס גת.
- Phase-separated particles = חלקיקים מופרדי-פאזה;
- Cell = תא;
- Particle = חלקיק;
- Cytoplasm = צִיטוֹפְּלַזְמָה;
- Protein = חלבון;
- Protein of interest DNA = דנ”א של החלבון הנחקר.
שימוש נוסף ב-GFP שאני אוהב במיוחד הוא בשיטת המעקב אחר קיפול חלבונים של Geoff Waldo [9], שהוא קרא לה ”מדווח קיפולים”. חלבונים מיוצרים כשרשראות ארוכות של אבני בניין, הנקראות חומצות אמינו. כדי לבצע את תפקידו, על החלבון להתקפל למבנה תלת־ממדי מסוים. אם חלבון מתקפל בצורה שאינה נכונה, הוא לא יעבוד כמו שצריך. כשאנו מייצרים חלבונים בחיידקים כדי לחקור אותם, אנו רוצים לוודא שהם מקופלים כראוי. Geoff בנה דנ”א שמקודד גם לחלבון שהוא חָקַר וגם ל-GFP. הוא סבר שאם החלבון שהוא חוקר לא יתקפל כמו שצריך, אז גם ה-GFP לא יתקפל כמו שצריך ולא יפיץ אור. לכן, אם הוא ראה תאים שמפיצים אור, אפשר היה להסיק שהחלבון הנחקר מתקפל בצורה נכונה; ואם לא היו תאים מפיצי אור, הוא יכול היה להסיק שהחלבון מתקפל בצורה לא-נכונה. זוהי שיטה טובה מאוד עבור מדענים על מנת לוודא שהם עובדים עם חלבונים שהתקפלו כהלכה (איור 3B).
ישנם עוד שימושים רבים עבור ה-GFP, אז אציג בפניכם רק כמה נוספים: יש אנשים שמשתמשים ב-GFP כדי ללמוד כיצד וירוסים מדביקים תאים. באחד המחקרים הבולטים השתמשו ב-GFP כדי לצבוע את נגיף ה-HIV הגורם לאיידס, כדי לחקור כיצד הנגיף מתפשט מתא אחד למשנהו [10]. במחקר זה נמצא שנגיפי HIV יכולים לעבור בין תאים בלי להרוס אותם (כפי שעושים וירוסים רבים אחרים). לגילוי זה יש השלכות על האופן שבו ניתן לשלוט במעבר הנגיף בין תאים. קבוצות אחרות של מדענים חוקרות כיצד להשתמש ב-GFP כדי לזהות מוקשים ושאריות של חומרי נפץ [11]. ביפן אנשים אפילו משתמשים ב-GFP כדי לייצר משי שזוהר בירוק [12]. ישנם עוד הרבה שימושים מעניינים של GFP ושל חלבונים מאירים אחרים עם צבעים אחרים שמדענים מצאו או ייצרו. הדוגמאות הללו נותנות לכם הצצה ראשונית לדרכים שבהן אפשר להשתמש בחלבונים הפלואורסצנטיים.
המלצות למוחות צעירים
לדעתי אין ”מתכון” לביצוע מחקר מדעי בעל חשיבות, אבל אוכל להמליץ על דרכים שלדעתי יש להם חשיבות רבה במדע. אחת היכולות החשובות ביותר של מדענים מצליחים היא היכולת לשאול שאלות. ישנן הרבה שאלות גדולות שנמצאות ממש מתחת לאף שלנו, מחכות שישאלו אותן, אבל אם אנחנו לא נוהגים לשאול שאלות, אנחנו עלולים להחמיץ אותן. שאילת שאלות היא דרך מצוינת להבין דברים. כאשר אתם לומדים משהו חדש, שאלו את עצמכם כיצד הדבר החדש שלמדתם עשוי להתקיים בתחומים אחרים שמעניינים אתכם. זוהי גישה חשובה שאני משתמש בה בעבודתי כל הזמן. היבט חשוב נוסף של שאילת שאלות הוא הטלת ספק בהנחות שלכם (איור 4) – מדוע אתם מאמין בדברים מסוימים? לעיתים קרובות למדי, כשאנו חוקרים את ההנחות שלנו בדרך זו, אנו מוצאים בהן טעויות. תיקון שגיאות אלו על ידי עדכון ההנחות שלנו יכול לעזור לנו לקדם את רמת הידע ואת ההבנה שלנו.

- איור 4 - שלוש המלצות למוחות צעירים.
- שאלו שאלות וחִקרו את ההנחות שלכם – עִבדו על שני דברים במקביל – התלהבות והתמדה חשובים יותר מאשר ציונים. איור: איריס גת.
לעיתים קרובות אני ממליץ לתלמידים לעבוד על שני דברים בו זמנית. כך, אם פרויקט אחד לא עובד, עדיין יש להם מקור נוסף להצלחה ולמוטיבציה. מדע הוא מסע של התמודדות עם הלא נודע. זה לא תמיד תחום קל. הוא עלול להיות מתסכל, ואנחנו עושים הרבה שגיאות לאורך הדרך. הרעיונות שלנו לא תמיד עובדים, אבל שחייה במעלה הזרם לעֵבֶר הלא נודע הוא אחד הדברים המלהיבים בעיסוק במדע. מדֵי פעם המסע המאתגר הזה מספֵּק תגמולים גדולים – כמו לגלות משהו שאף אחד אחר לא ידע קודם לכן, ואז לחלוק את התגלית הזאת עם אחרים.
לסיום, אל תדאגו יותר מדי לגבי הציונים שלכם. לציונים אין שום קשר להצלחה במדעים. אני חושב שהתלהבות והתמדה הרבה יותר חשובות מהציונים. קיבלתי ציונים ממוצעים (70–80) בכימיה כשהייתי באוניברסיטה, ואז, איכשהו, קיבלתי פרס נובל בכימיה כ-30 שנה מאוחר יותר (אני נהנה מהאירוניה שבכך). אם אתם מתעניינים במדע, אחת הדרכים הטובות ביותר להיות טובים בזה היא ”ללכלכך את הידיים”. נסו לערוך ניסויים ולראות איך זה – זו הדרך הטובה ביותר לדעת אם המדע הוא הבחירה הנכונה עבורכם.
מילון מונחים
בִּיּוֹלוּמִינֵסֶנְצִיָה (Bioluminescence): ↑ ייצור אור על ידי אורגניזם חי.
אֶקְווֹרִין (Aequorin): ↑ חלבון המפיץ אור כחול שהתגלה במדוזת אֶקְווֹרֵאָה וִיקְטוֹרְיָה על ידי פרופ’ אוֹסָאמוּ שִימוֹמוּרָה.
מולקולה פְלוּאוֹרֵסְצֶנְטִית (Fluorescent Molecule): ↑ מולקולות הממירות אור בצבע מסוים (כחול, למשל), לצבע אחר (כמו ירוק).
חלבון פְלוּאוֹרֵסְצֶנְטִי ירוק (GFP) (Green Fluorescent Protein): ↑ חלבון שזוהה לראשונה במדוזת אֶקְווֹרֵאָה וִיקְטוֹרְיָה. ה-GFP קולט אור כחול וממיר אותו לאור ירוק.
תָּאי-עָצָב (Nerve Cells): ↑ תאים של מערכת העצבים שמקבלים מידע מהסביבה, מעבדים אות באמצעות אותות חשמליים וכימיים, ומייצרים פֶּלֶט, כמו תנועה.
סַמָּן ביולוגי (Biological Marker): ↑ מולקולה ביולוגית המשמשת חוקרים כדי להצביע על תהליך או מצב ביולוגי.
תגובת שרשרת פּוֹלִימֵרָאזִית (PCR) (Polymerase Chain Reaction): ↑ שיטת מעבדה המשמשת ליצירת עותקים רבים של מִקטַע דנ”א ספציפי באמצעות אנזים המיועד להעתקת דנ”א, הנקרא דנ”א פּוֹלִימֶרָאז.
גֶּנִים (Gene): ↑ מִקטַע של דנ”א הנושא הוראות לייצור חלבון מסוים.
הצהרת ניגוד אינטרסים
המחברים מצהירים כל המחקר נערך בהעדר כי קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
חומרים נוספים
- חמישה מיתוסים על מדענים לפי זוכה פרס הנובל מרטין צָ’לְפִי.
- מרטין צָ’לְפִי, זוכה פרס נובל, ''כושל וחסר תועלת''.
תודות
ברצוני להודות לנועה שגב על עריכת הריאיון שהיווה את הבסיס למאמר זה, ועל כתיבה משותפת של המאמר. תודה לאיריס גת עבור האיורים, ול-Susan Debad על העריכה של כתב היד.
הצהרת כלי בינה מלאכותית
טקסט חלופי הנלווה לאיורים במאמר זה נוצר על ידי פרונטירז בסיוע כלי בינה מלאכותית, ונעשו מאמרצים על מנת להבטיח את דיוקו, כולל בדיקה על ידי כותבי המאמר כאשר הדבר התאפשר. אם ברצונכם לדווח על בעיה, אנו צרו איתנו קשר.
מקורות
[1] ↑ Shimomura, O., Johnson, F. H., and Saiga, Y. 1962. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell. Compar. Physiol. 59:223–39. doi: 10.1002/jcp.1030590302
[2] ↑ Shimomura, O. 2009. Discovery of green fluorescent protein (GFP) (Nobel Lecture). Angew. Chem. Int. Ed. 48:5590–602. doi: 10.1002/anie.200902240
[3] ↑ Morin, J. G., and Hastings, J. W. (1971). Energy transfer in a bioluminescent system. J. Cell. Physiol. 77:313–8. doi: 10.1002/jcp.1040770305
[4] ↑ Prasher, D. C., Eckenrode, V. K., Ward, W. W., Prendergast, F. G., and Cormier, M. J. 1992. Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111:229–33. doi: 10.1016/0378-1119(92)90691-H
[5] ↑ Mullis, K., Faloona, F., Scharf, S., Saiki, R., Horn, G., and Erlich, H. 1992. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Biotechnol. Ser. LI:17.
[6] ↑ Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., and Prasher, D. C. 1994. Green fluorescent protein as a marker for gene expression. Science 263:802–5. doi: 10.1126/science.8303295
[7] ↑ Wang, S., and Hazelrigg, T. 1994. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis. Nature 369:400–3. doi: 10.1038/369400a0
[8] ↑ Brangwynne, C. P., Eckmann, C. R., Courson, D. S., Rybarska, A., Hoege, C., Gharakhani, J., et al. 2009. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science 324:1729–32. doi: 10.1126/science.1172046
[9] ↑ Waldo, G. S., Standish, B. M., Berendzen, J., and Terwilliger, T. C. (1999). Rapid protein-folding assay using green fluorescent protein. Nat. Biotechnol. 17:691–5. doi: 10.1038/10904
[10] ↑ Hübner, W., McNerney, G. P., Chen, P., Dale, B. M., Gordon, R. E., Chuang, F. Y., et al. 2009. Quantitative 3D video microscopy of HIV transfer across T cell virological synapses. Science 323:1743–7. doi: 10.1126/science.1167525
[11] ↑ Shemer, B., Palevsky, N., Yagur-Kroll, S., and Belkin, S. 2015. Genetically engineered microorganisms for the detection of explosives’ residues. Front. Microbiol. 6:1175. doi: 10.3389/fmicb.2015.01175
[12] ↑ Shimizu, K. 2018. Genetic engineered color silk: fabrication of a photonics material through a bioassisted technology. Bioinspir. Biomimet. 13:041003. doi: 10.1088/1748-3190/aabbe9
