摘要
本文基于马丁 • 查尔菲教授与诺雅 • 塞格夫的采访撰写。 观察是科学家进行研究的重要手段。他们会运用手中最先进的工具来观察,并试图理解自己感兴趣的现象。对于科学家来说,他们总想超越前人的视界,因此,科学研究中的观察和测量往往充满了挑战性。现代成像技术的发展可使科学家们看到他们以前看不到的东西。在这篇文章中,我将为大家介绍成像领域的一项突破性技术。该技术基于一种叫做绿色荧光蛋白 (GFP) 的奇妙分子。正如其名,它会发光。绿色荧光蛋白不仅改变了我的生活,改变了众多其他科学家的生活,最终也改变了科学界之外普罗大众的生活。除此之外,绿色荧光蛋白使我们能够检测和观察活体动物体内蛋白质和整个细胞的活性,并检测编码特定蛋白质的基因的活性。我希望你在读完本文后能对绿色荧光蛋白以及它如何照亮科学有更多的了解。
查尔菲与下村修、钱永健教授因发现和改进绿色荧光蛋白 (GFP) 而获得 2008 年诺贝尔化学奖。
一个不可思议的错误
你是否也曾足够幸运,欣赏到夏夜里漫天飞舞的萤火虫,亮若繁星?我们将萤火虫产生光的现象称为生物发光 (bioluminescence)。除了萤火虫,具有这种神奇能力的生物还包括发光蠕虫以及某些种类的细菌和鱼。我们的故事就始于一种叫做水晶水母【又名水晶果冻水母,学名:维多利亚多管发光水母 (Aequorea victoria) 】的生物发光水母 (见图 1)。

- 图 1 - 下村修和水晶水母。
- 在实验室度过了令人沮丧的一天后,下村教授关掉了灯,准备回家吃晚饭。他突然看到装有水晶水母细胞样本和海水的水槽里发出蓝色的光。下村修通过进一步研究, 发现了一种叫做水母素 (aequorin) 的发光蛋白质。插图: Iris Gat。
20 世纪 60 年代,一位名叫下村修 (Osamu Shimomura) 的日本科学家想要了解具有生物发光功能的生物体的发光机制。他决定以产生绿光的水晶水母为研究对象。下村修工作了整整一个夏天,试图让水晶水母的细胞发光 (这在海洋中是自然发生的),但都无功而返。一天晚上,实验室外已经漆黑一片,下村修也准备下班回家吃晚饭。他把从又一次实验失败所得的水母蛋白样品丢进了实验室的水槽,关灯锁门。但就在准备离开的刹那间,他注意到水槽发出了蓝色的光。由于水槽中还有海水,下村修推断海水中一定有什么物质触发了光的产生。他很快意识到,触发水母蛋白质发光的是海水中的钙。他将这种在水晶水母中发现的蓝色发光蛋白命名为水母素 (aequorin) [1, 2]。
在这一重大突破之后,下村修又不得不面临另一个 “烧脑” 的问题:为什么水母产生的光是绿色的,而水母素产生的光是蓝色的?在纯化水母素蛋白的同时,下村修还在寻找其他能让水晶水母发出绿光的物质。最终,他发现了另一种蛋白质。它是一种荧光分子,能吸收蓝光并将其转换成绿光,不管蓝光是来自水母素还是手提灯。这又是一个惊人的发现,因为当时没有人知道世上还有可以发荧光的蛋白质。下村修最初称其为绿色蛋白,现在我们称其为绿色荧光蛋白 (green fluorescent protein),简称 GFP [3]。这个故事再一次表明,许多科学发现是相当偶然的。就像下村修一样,科学家要做的事情就是注意到这些偶然的现象,为之惊奇并进行深入研究。
绿色荧光蛋白如何改变我的生活
1989 年 4 月 25 日,星期二,我在哥伦比亚大学听了一个午餐讲座,主题正是下村修关于绿色荧光蛋白的研究。其中对绿色荧光蛋白的描述使我瞬间着迷。我实验室当时以秀丽隐杆线虫为研究模型。 它体型微小 (大约 1 毫米长),全身透亮。我们研究这种线虫的神经细胞。这类细胞会对物理刺激 (如触摸或声音) 做出反应,并将其转化为电信号和化学信号。那场讲座让我想到一个问题:可否找到一种方法,让秀丽隐杆线虫的神经细胞产生绿色荧光蛋白。这样我们就能以一种全新的方式观察和研究它们。绿色荧光蛋白可以用作生物标记物——研究人员用来观察有机体或细胞内部生物学过程的一种分子。
当时,我们用来观察秀丽隐杆线虫特定细胞亚群的方法很繁琐,而且不适用于活组织研究。这些都极大地限制了研究进展。首先,我们必须用化学物质来 “固定” 蠕虫以维持细胞结构,但这个过程也不可避免地杀死了动物。也就是说,我们彼时的方法只能提供蠕虫内部的一个 “快照” ——一次一 “帧” 。我当时想,绿色荧光蛋白或许可以让我们检视秀丽隐杆线虫活体在与环境相互作用时的神经细胞。
我太兴奋了,以至于根本没听进去讲座的其余部分。在接下来的几天里,我满脑子想的都是绿色荧光蛋白及其对我的研究的潜在价值。我联系了一位名叫道格拉斯 • 普拉修 (Douglas Prasher) 的科研人员,他正在研究如何制造和克隆编码绿色荧光蛋白的 DNA 序列。谈到将绿色荧光蛋白应用于秀丽隐杆线虫和其他生物的可能性,我俩都倍感兴奋,并决定联手合作。但由于一次不幸的误解,我们在几年的时间里没有再联系。1992 年 9 月,我的实验室招到一位名叫吉亚 • 奥伊斯基兴 (Ghia Euskirchen) 的学生。她对这个项目很感兴趣,并且在荧光方面有着很好的工作背景。这让我重新燃起用绿色荧光蛋白标记活细胞的想法。在学习关于绿色荧光蛋白的文献时, 我们发现普拉修刚发表了一篇相关的论文 [4],于是我们再次联系了他。不久之后,他把编码绿色荧光蛋白的 DNA 序列发给了我们,吉亚就此开启了研究。
用绿色荧光蛋白使生物体发光
在吉亚 GFP 实验的起始阶段,她想知道带有编码绿色荧光蛋白 DNA 的细菌能否发出荧光。当时我们还不清楚自绿色荧光蛋白 DNA 产生的绿色荧光蛋白是否足以使细胞产生荧光 (要了解更多关于 DNA 序列如何生产蛋白质的信息,请参阅此文。)。发光过程可能还需要其他要素,要么是细胞自身产生并加到 GFP 上的,要么来自外部添加。
在实验开始时,我们对如何处理普拉修惠赠的绿色荧光蛋白 DNA 犹豫不决。普拉修发给我们的 DNA 既有绿色荧光蛋白的编码序列,还包含一部分额外序列 ( 图 2A)。我们很清楚,后续实验需要大量拷贝的绿色荧光蛋白 DNA 序列。问题是,是使用普拉修的绿色荧光蛋白 DNA 原样 (连同额外的片段),还是只使用编码绿色荧光蛋白的部分片段。更棘手的是,我们要用聚合酶链式反应 (polymerase chain reaction,简称 PCR,疫情期间检测新冠病毒就用到这种技术) 来扩增那段编码 DNA 序列 [5]。这种技术经常会将错误引入到复制的 DNA 产物中。尽管有这些限制,我还是决定使用PCR技术,因为我们要观察数以百万计的细菌,总会有一些细菌会 “吞入” 准确无误的绿色荧光蛋白编码 DNA 。
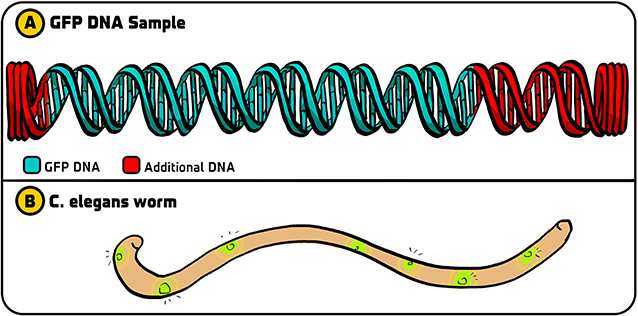
- 图 2 - 最开始做的 GFP 实验。
- (A) 我们从普拉修那里得到的原始绿色荧光蛋白 DNA 包含编码绿色荧光蛋白的 DNA (绿色) 以及两侧额外的 DNA 片段 (红色)。(B) 在我们用 PCR 扩增了绿色荧光蛋白 DNA 之后,我们将此 DNA 注入秀丽隐杆线虫,这样线虫的某些细胞就会发出绿光。
事实证明,我们选择了正确的策略。吉亚使用 PCR 复制扩增了编码绿色荧光蛋白的 DNA 序列。然后,她将这种绿色荧光蛋白 DNA 整合到一种称为质粒的 DNA 分子中,细菌将其 “吞下” 并整合为自己的 DNA。在用蓝光照射含有绿色荧光蛋白 DNA 的大肠杆菌后,它们发出了荧光 [6]。(相比之下,其他研究组使用原始的带有多余的 DNA 片段的绿色荧光蛋白 DNA,没有看到荧光。多余的 DNA 片段中的某些因素干扰了绿色荧光蛋白的产生。如果我们没有使用 PCR 扩增编码序列,我们的实验就不会成功)。由于该方法在细菌中奏效,接下来我们用它将绿色荧光蛋白 DNA 整合到秀丽隐杆线虫中。不出所料——我们也让这些蠕虫发光了(图 2B)。我们的实验为将绿色荧光蛋白整合到其他生物体并为开发各种应用铺平了道路。
绿色荧光蛋白如何改变科学
任何新的科学进展都可以使我们更好地理解基本的生物学或自然原理,也可以帮助创造新技术。很多时候,最初的发现会在时间推移中朝着令人惊讶和意想不到的方向发展。激光的发现就是一个很好的例子。发明激光的查尔斯 • 汤斯 (Charles Townes) 从来没有想到,激光会在杂货店里用于扫描产品价格,或在唱片业中用于制作光盘,或在影视业中用于制作 DVD,或在医学上用于进行激光手术。绿色荧光蛋白的发现也是如此——它已经并将继续在多维度推动基础科学和各种技术应用的发展。
在科学研究中,绿色荧光蛋白可以作为一种生物标记物,告诉我们基因的功能及其产物。基因可分为两部分:编码部分,它决定应该制造什么产物 (RNA 和蛋白质);调控部分,它决定应该在何时、何地以及制造多少产物。如果仅将编码绿色荧光蛋白的 DNA 序列添加到调控部分,每当基因正常 “打开” 时,就会产生 GFP 并发出荧光。或者,如果将绿色荧光蛋白 DNA 序列添加到目的蛋白编码序列中,这个蛋白正常表达时就会 “ 连带” 绿色荧光蛋白,当我们用蓝光照射它时,它就会发光 [7]。我们可以看到蛋白质在细胞中的位置 (例如,在细胞核中,或在细胞膜上),也可以观察到它们在活细胞中的移动:这是以前的方法无法做到的。重要的是,绿色荧光蛋白的编码 DNA一旦被插入到生物体的 DNA 中,它就可以遗传给该生物体的后代——这使得绿色荧光蛋白在实验应用上非常便捷。
我想简单提一下我个人很欣赏的两个基于绿色荧光蛋白所做出的发现。第一个发现是由普林斯顿大学的克利福德 • 布兰迪万 (Clifford Brangwynne) 和德国马普学会分子细胞生物学和遗传学研究所的安东尼 • 海曼 (Anthony Hyman) 在 2009 年做出的 [8]。他们观察的是细胞质内的蛋白质。细胞质是填充细胞内部空间的液体。在此之前,人们普遍认为细胞质组分是相当均匀的,各种物质应该均匀分布。布兰迪万和海曼将绿色荧光蛋白串联在某种细胞质蛋白上,发现这些细胞质蛋白只是分散在胞质 “悬浮” 的液滴中。它们有时会聚集在一起发生融合,有时会分裂成两半。这些结构不与细胞质的其余部分融合,它们是一个单独的相【通常被称为相分离液滴 (图 3A)】,就像油滴与水不能融为一体,分成两相。这一发现对我们理解细胞的结构和功能非常重要,开辟了一个非常活跃的研究领域。
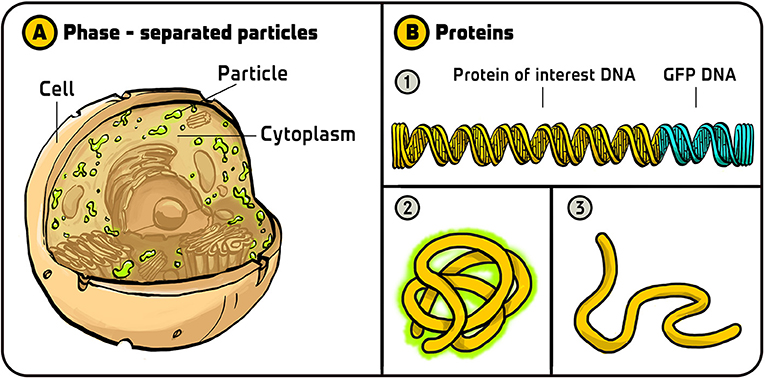
- 图 3 - 绿色荧光蛋白的应用。
- (A) 克利福德 • 布兰迪万和安东尼 • 海曼利用绿色荧光蛋白发现细胞的细胞质包含两个不同的相——众所周知的液相和另一个表现得像水中的油滴的相。(B) 杰夫 • 沃尔多使用绿色荧光蛋白来监视蛋白质的折叠。(1) 他将绿色荧光蛋白 DNA 添加到他感兴趣的蛋白质编码 DNA 的末端。(2) 如果蛋白质 (包括绿色荧光蛋白部分) 折叠正确,则发出绿色荧光。(3) 如果蛋白质折叠不正确,则不会发出荧光。插图:Iris Gat
另一个我特别喜欢的运用绿色荧光蛋白做出的发现是由美国洛斯阿拉莫斯国家实验室的杰夫 • 沃尔多 (Geoff Waldo) 完成的 [9]。沃尔多建立了一种使用绿色荧光蛋白来监视蛋白质折叠的聪明方法;他称之为 “折叠报告” 。蛋白质是氨基酸相连而成的长链分子,必须折叠成特定的三维结构才能发挥其功能。如果蛋白质折叠不正确,它就不能正常工作。例如,在细菌中制造出要研究的蛋白质,我们就要确保它们发生正确折叠。沃尔多构建了一种 DNA 序列,可以同时编码他感兴趣的蛋白质和绿色荧光蛋白。他推断,如果感兴趣的蛋白质不能正常折叠,那么绿色荧光蛋白也不能正常折叠,也就不会发光。所以,如果检测到了荧光细胞,他就能得出结论,所研究的蛋白质折叠正确;如果没有荧光细胞,他就知道,蛋白质折叠错误。对于科学家来说,这是一种非常好的方法,可以确保他们使用的是正确折叠的蛋白质 (图 3B)。
绿色荧光蛋白还有许多其他用途,我在这里再多谈几个。有人使用绿色荧光蛋白来研究病毒如何感染细胞。一项著名的研究通过使用绿色荧光蛋白给艾滋病病毒 (HIV) “着色” 来解析病毒如何从一个细胞传播到另一个细胞 [10]。在该研究中,科研人员发现 HIV 病毒 (引发艾滋病) 可以在细胞之间移动而不对细胞造成损伤 (就像许多其他病毒一样)。这一发现为我们如何控制HIV病毒在细胞之间的转移提供了线索。有课题组正在研究如何用绿色荧光蛋白来探测地雷和炸药残留物 [11]。 日本有团队甚至用绿色荧光蛋白生产出发绿光的丝绸 [12]。绿色荧光蛋白还有许多更有趣的用途,科学家还发现或研制出其他颜色的荧光蛋白。相信通过这些例子你应该初步了解了荧光蛋白的用途。
给年轻人的建议
我不认为做出重要的科学研究有什么 “秘诀” ,但我认为有几点要重点提一下。提出问题是一个成功的科学家所具备的最为重要的能力之一。许多伟大的问题就在我们的眼皮底下,等着我们去问,但如果我们没有问问题的习惯,我们可能会错过它们。提出问题是理解事物的好方法。当你学习新知识时,问问自己,你所学到的新东西如何能应用到你感兴趣的其他话题。这是我在工作中一直使用的一个重要方法。提问的另一个重要方面是质疑你的假设 (图 4)——你为什么相信你所相信的?通常,当我们以这种方式深究我们的假设时,我们会发现假设中的错误。更新我们的假设来纠正这些错误可以帮助我们增长知识和加深理解。

- 图 4 - -给少年的三条建议。
我经常建议我的学生同时做两个课题。这样,如果一个课题不成功,他们仍然可以从另一个课题中获得成功和动力。科学是一场与未知搏斗的旅程。这个过程的多数时间并非一帆风顺,可能会令人沮丧,一路走来会犯很多错误。我们的想法也并非个个行得通,但在未知领域取得进展是令科学家感到兴奋的事情之一。偶尔,我们会在坎坷旅程中收获巨大回报——比如发现了以前未知的东西,然后与他人分享这一发现。最后,不要太担心你的考试成绩。成绩与科学上的成功完全没有关系。我认为热情和坚持远比成绩重要。我在大学时化学平均成绩一般 (C等而已),然后,不知怎么的,在大约 30 年后获得了诺贝尔化学奖 (我喜欢其中的讽刺意味)。如果你对科学有兴趣,我觉得,成为善于科研之人的最好途径之一就是去做。试着做实验,看看科学到底是什么样的——这是知道科学是否适合你的最值得信赖的方法。
术语表
生物发光 (Bioluminescence): ↑ 生物体发光的现象。
水母素 (Aequorin): ↑ 一种蓝色发光蛋白,由下村修教授在水晶水母中发现。
荧光分子 (Fluorescent molecules): ↑ 将一种颜色的光 (如蓝色) 转换为另一种颜色 (如绿色) 的分子。
绿色荧光蛋白 (GFP) (Green fluorescent protein (GFP)): ↑ 一种在水晶水母中首次发现的蛋白质。绿色荧光蛋白吸收蓝光并将其转化为绿光。
神经细胞 (Nerve cells): ↑ 神经系统这类细胞接收来自环境的信息,以电信号和化学信号处理之,并产生输出 (如运动)。
生物标记物 (Biological marker): ↑ 研究人员用来标记生物过程或状态的生物分子。
聚合酶链式反应 (Polymerase Chain Reaction, PCR): ↑ 使用复制 DNA 的酶 (称为 DNA 聚合酶) 对特定 DNA 片段进行复制的实验方法。
基因 (Gene): ↑ 一个携带制作特定蛋白质指令的 DNA 片段。
利益冲突声明
作者声明, 该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。
致谢
我想感谢 Noa Segev 进行采访并共同撰写这篇文章,感谢 Iris Gat 提供插图 (https://www.irisgat-art.com/),以及 Susan Debad 对稿件进行文字编辑。
感谢 “赛先生” 公众号及其译者瞿立建、计永胜、陈晓雪对本文中文翻译的贡献。
扩展阅读
- The five myths about scientists according to Nobel Laureate Martin Chalfie
- Martin Chalfie, Nobel Laureate, on Failed and Useless
参考文献
[1] ↑ Shimomura, O., Johnson, F. H., and Saiga, Y. 1962. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell. Compar. Physiol. 59:223–39. doi: 10.1002/jcp.1030590302
[2] ↑ Shimomura, O. 2009. Discovery of green fluorescent protein (GFP) (Nobel Lecture). Angew. Chem. Int. Ed. 48:5590–602. doi: 10.1002/anie.200902240
[3] ↑ Morin, J. G., and Hastings, J. W. (1971). Energy transfer in a bioluminescent system. J. Cell. Physiol. 77:313–8. doi: 10.1002/jcp.1040770305
[4] ↑ Prasher, D. C., Eckenrode, V. K., Ward, W. W., Prendergast, F. G., and Cormier, M. J. 1992. Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111:229–33. doi: 10.1016/0378-1119(92)90691-H
[5] ↑ Mullis, K., Faloona, F., Scharf, S., Saiki, R., Horn, G., and Erlich, H. 1992. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Biotechnol. Ser. LI:17.
[6] ↑ Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., and Prasher, D. C. 1994. Green fluorescent protein as a marker for gene expression. Science 263:802–5. doi: 10.1126/science.8303295
[7] ↑ Wang, S., and Hazelrigg, T. 1994. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis. Nature 369:400–3. doi: 10.1038/369400a0
[8] ↑ Brangwynne, C. P., Eckmann, C. R., Courson, D. S., Rybarska, A., Hoege, C., Gharakhani, J., et al. 2009. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science 324:1729–32. doi: 10.1126/science.1172046
[9] ↑ Waldo, G. S., Standish, B. M., Berendzen, J., and Terwilliger, T. C. (1999). Rapid protein-folding assay using green fluorescent protein. Nat. Biotechnol. 17:691–5. doi: 10.1038/10904
[10] ↑ Hübner, W., McNerney, G. P., Chen, P., Dale, B. M., Gordon, R. E., Chuang, F. Y., et al. 2009. Quantitative 3D video microscopy of HIV transfer across T cell virological synapses. Science 323:1743–7. doi: 10.1126/science.1167525
[11] ↑ Shemer, B., Palevsky, N., Yagur-Kroll, S., and Belkin, S. 2015. Genetically engineered microorganisms for the detection of explosives’ residues. Front. Microbiol. 6:1175. doi: 10.3389/fmicb.2015.01175
[12] ↑ Shimizu, K. 2018. Genetic engineered color silk: fabrication of a photonics material through a bioassisted technology. Bioinspir. Biomimet. 13:041003. doi: 10.1088/1748-3190/aabbe9
