ملخص
يستند هذا المقال إلى اللقاء الذي دار بين البروفيسور Martin Chalfie ونوا سيغيف.
يدرس العلماء الأشياء بالملاحظة، فهم يفحصون ظاهرة تثير اهتمامهم ويحاولون فهمها باستخدام الأدوات المتاحة الأكثر تطورًا. ويصعب على العلماء في الغالب ملاحظة وقياس ما يودون دراسته، وهذا في الغالب لرغبتهم في رؤية أشياء لم يتسنّ لأحد في السابق رؤيتها. ومع تطوير أساليب التصوير الحديثة، يمكن للعلماء ملاحظة أشياء لم يتمكنوا من ملاحظتها في السابق. في هذه المقالة، سأخبرك بأحد الإنجازات في التصوير العلمي والذي استند إلى بروتين متوهج رائع اسمه البروتين الفلوري الأخضر .(GFP) لم يغيّر هذا البروتين حياتي فحسب، بل حياة العديد من العلماء الآخرين، وكذلك الكثير من الناس غير المتخصصين في العلوم. يتيح لنا البروتين الفلوري الأخضر، من بين أمور أخرى، اكتشاف وملاحظة نشاط البروتينات والخلايا الكاملة في الحيوانات الحية، وكذلك رصد نشاط الجينات التي تشفر بعض البروتينات. وفي نهاية هذه المقالة، آمل أن تكون فهمت الكثير حول هذا البروتين وكيف يضيء الطريق أمام العلماء.
فاز البروفيسور Martin Chalfie بجائزة نوبل في الكيمياء في عام 2008، مشاركةً مع البروفيسور أوسامو شيمومورا والبروفيسور روجر تسيان، بفضل اكتشاف وتطوير البروتين الفلوري الأخضر (GFP).
قنديل البحر المتوهج والخطأ العجيب
هل حالفك الحظ يومًا ورأيت يراعة متوهجة تضيء ليلة مظلمة؟ تُعد اليراع جزءًا من مجموعة مذهلة من الكائنات الحية التي يمكنها توليد الضوء، وهي ظاهرة تُسمّى التلألؤ البيولوجي. تشمل الكائنات الحية الأخرى المتلألئة بيولوجيًا الديدان المتوهجة (سراج الليل) وبعض أنواع البكتيريا وبعض أنواع السمك. تبدأ قصتنا بقنديل بحر متلألئ بيولوجيًَا واسمه قنديل البحر البلوري (Aequorea victoria)، أو A. victoria اختصارًا (الشكل 1).

- شكل 1 - أوسامو شيمومورا وقنديل البحر البلوري المتوهج Aequorea victoria: بعد يوم محبط في المعمل، أطفأ البروفيسور شيمومورا الأضواء وكان على وشك العودة للمنزل لتناول العشاء.
- وفجأةً رأى توهجًا باللون الأزرق في الحوض الذي كان يحتوي على عينات لخلايا قنديل البحر البلوري A. victoria ومياه البحر. وقاده ذلك إلى اكتشاف البروتين المتوهج Aequorin. تم تقديم الرسم التوضيحي من Iris Gat.
في الستينيات، أراد عالم ياباني اسمه أوسامو شيمومورا فهم كيفية تولّد الضوء من الكائنات المتلألئة بيولوجيًا. وقرر دراسة قنديل البحر البلوري A. victoria، الذي ينتج الضوء الأخضر. عمل البروفيسور طوال صيف كامل، محاولاً جعل الخلايا المستخلصة من A. victoria تتوهج (كما يحدث بشكل طبيعي في البحر) ولكن لم تنجح أيٌّ من تجاربه. وفي ليلة ما، عندما حلّ الظلام بالخارج وأراد البروفيسور العودة للمنزل لتناول العشاء، ألقى عينات تجربة فاشلة اشتملت على بروتينات قنديل البحر البلوري A. victoria في حوض المعمل، وأطفأ الضوء لإغلاق المعمل. ولكن عندما أوشك على المغادرة، لاحظ أن الحوض يتلألأ بالضوء الأزرق. ونظرًا لأن الحوض كان يحتوي أيضًا على مياه البحر، استنتج البروفيسور أوسامو أنها اشتملت بالتأكيد على شيء تسبب في توليد الضوء. وسرعان ما أدرك أن الكالسيوم بمياه البحر جعل بروتينات قنديل البحر تتوهج. وسمّى البروتين المتوهّج بالضوء الأزرق Aequorin، تيمنًا باسم قنديل البحر [1, 2].
وبعد هذا الإنجاز الرائع، تعيّن على أوسامو الإجابة عن سؤال ملح آخر: لماذا ولّد بروتين ِAequorin الضوء الأزرق في حين أن قنديل البحر المستخرج منه البروتين يتوهّج بالضوء الأخضر؟
في أثناء تنقية بروتين Aequorin، كان أوسامو يبحث عن شيء آخر تسبّب في تولّد الضوء الأخضر المنبعث من قنديل البحر البلوري A. victoria. وفي النهاية، وجد بروتينًا آخر كان عبارة عن جزيء فلوري لأنه امتص الضوء الأزرق سواء تم إنتاجه من بروتين Aequorin أو من مصباح يدوي وحوّله إلى الضوء الأخضر. وكان هذا اكتشافًا مذهلاً آخر، لأنه لم يكن يدرك أي أحد في ذلك الوقت أن البروتينات يمكن أن تكون فلورية. على الرغم من أن أوسامو سمّاه في الأساس البروتين الأخضر، نطلق عليه الآن البروتين الفلوري الأخضر، أو GFP [3]. وهذه القصة مثال رائع أيضًا على عدد الاكتشافات العلمية التي تكون وليدة اللحظة. وكان دور العالِم، كما في حالة أوسامو، ملاحظة هذه الاكتشافات والتساؤل عنها والتحقيق فيها.
كيف غيّر البروتين الفلوري الأخضر حياتي
في يوم الثلاثاء الموافق 25 أبريل 1989، حضرت محاضرة في وقت الغداء في جامعتي حول إنجاز أوسامو شيمومورا المتعلق بالبروتين الفلوري الأخضر. وانبهرت بما سمعته حول هذا البروتين. كان معملي يفحص دودة صغيرة (طولها 1 ملم) شفافة اسمها الربداء الرشيقة أو C. elegans. كنا ندرس مجموعة من الخلايا العصبية للدودة والتي تستجيب للمثيرات الملموسة، مثل اللمس والصوت، وتحولها إلى إشارات كهربائية وكيميائية. تساءلت عما إذا كان بإمكاننا جعل تلك الخلايا العصبية في الربداء الرشيقة تنتج البروتين الفلوري الأخضر، حتى نستطيع رؤيتها ودراستها فعليًا بطريقة جديدة كليًا. ومن ثم يمكن استخدام هذا البروتين كواسم بيولوجي، وهو جزيء بيولوجي يمكن للعلماء ملاحظته لمعرفة ما يجري داخل الخلايا أو الكائنات الحية. في ذلك الوقت، كانت الطريقة المستخدمة لملاحظة أنواع خلايا محددة في الربداء الرشيقة مرهقة ولم تسمح لنا بفحص النسيج الحي، وكانت هذه قيود كبيرة. كان علينا أولاً “معالجة” الدودة بمواد كيميائية للحفاظ على بنية الخلية، ولكن تلك العملية قضت على الدودة أيضًا. معنى ذلك أن طريقتنا آنذاك أعطتنا صورة “سريعة” فقط لما كان يجري داخل الدودة، أي “إطار” واحد في المرة الواحدة. كنت أظن أن البروتين الفلوري الأخضر قد يسمح لنا برؤية الخلايا العصبية للربداء الرشيقة وهي حيّة وتتفاعل مع بيئتها.
كنت متحمسًا جدًا لدرجة أنني لم أستطع الاستماع إلى بقية المحاضرة. وفي الأيام التي تلت المحاضرة، انحصر كل تفكيري في البروتين الفلوري الأخضر وإمكاناته في أبحاثي. تواصلت مع باحث اسمه دوغلاس براشر والذي كان يدرس إنتاج ونسخ المعلومات الجينية (الحمض النَّووي الرِّيبي منقوص الأكسجين) التي تشفّر البروتين الفلوري الأخضر. كان كلانا متحمسين بشأن إمكانية استخدام البروتين الفلوري الأخضر في الربداء الرشيقة وغيرها من الكائنات الحية ولذلك قررنا التعاون معًا. وبعد مقاطعة بعضنا لبضع سنوات بسبب سوء فهم مؤسف، تواصلنا من جديد في سبتمبر 1992 عندما أتت طالبة اسمها جيا أوسكيرشين إلى معملي وأبدت اهتمامها بالمشروع. كانت لديها خلفية جيدة حول دراسة الفلورية، وذكّرني هذا بفكرتي حول استخدام البروتين الفلوري الأخضر لوضع علامة على الخلايا الحية. وبينما ندرس مقالات علمية تم نشرها حول هذا البروتين، اكتشفنا أن دوغلاس كان قد نشر للتوّ مقالاً حول البروتين [4] وتواصلنا من جديد. وبعد ذلك بفترة قصيرة، أرسل إلينا شفرة الحمض النووي الريبي منقوص الأكسجين (سأشير إليه فيما بعد باسم الحمض النووي) الخاصة بالبروتين الفلوري الأخضر وبدأت جيا دراسة الأمر.
جعل الكائنات الحية تتوهّج باستخدام البروتين الفلوري الأخضر
عندما بدأت جيا تجاربها الخاصة بالبروتين الفلوري الأخضر، أرادت ملاحظة ما إذا كانت البكتيريا التي تحمل الحمض النووي الذي يشفر ذلك البروتين ستصبح فلورية. لم نكن نعلم في ذلك الوقت ما إذا كان إنتاج البروتين الفلوري الأخضر من حمضه النووي يكفي لجعل خلية ما تتوهج بضوء فلوري (لمعرفة المزيد حول كيفية إنتاج البروتينات من الحمض النووي، يمكنك قراءة هذه المقالة). ربما كانت هناك حاجة إلى شيء آخر، إما شيء تنتجه الخلية نفسها وتضيفه إلى البروتين الفلوري الأخضر لتوليد الضوء الفلوري أو شيء ما يجب إضافته خارجيًا لجعل الخلايا فلورية.
كان علينا اتخاذ قرار في بداية التجربة حول ما يجب فعله باستخدام الحمض النووي للبروتين الفلوري الأخضر الذي حصلنا عليه من دوغلاس. احتوى الحمض النووي الذي أرسله إلينا دوغلاس على تسلسلات إضافية إلى جانب الجزء الذي كان يشفر البروتين الفلوري الأخضر (الشكل 2A). علمنا أنه كان علينا صنع الكثير من نسخ الحمض النووي للبروتين الفلوري الأخضر من أجل تجاربنا، وتساءلنا عما إذا كان علينا استخدام الحمض النووي للبروتين المرسل من دوغلاس كما هو (مع الأجزاء الإضافية) أو الاقتصار على استخدام الجزء الذي كان يشفر البروتين. تمثّل التحدي في أن الطريقة المُستخدمة للحصول فقط على الحمض النووي المشفر، وهي تفاعل البوليمراز المتسلسل (أو PCR، الذي قد تكون تعرفه من اختبارات PCR الخاصة بفيروس كورونا) [5]، تسببت في الغالب في أخطاء في الحمض النووي المنسوخ. وبالرغم من هذا القيد، قررت استخدام تفاعل PCR، لأننا كنا سنفحص ملايين البكتيريا وسيحمل بعضها الحمض النووي للبروتين الفلوري الأخضر بدون وجود أي أخطاء.
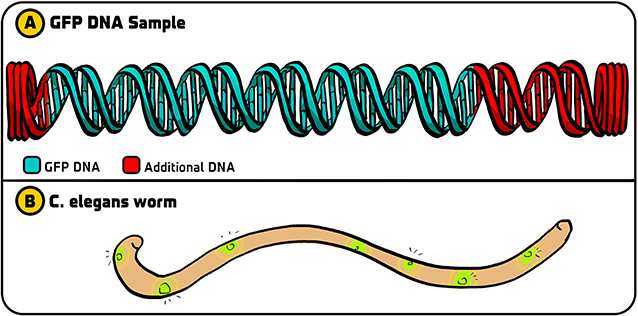
- شكل 2 - التجارب الأولية مع البروتين الفلوري الأخضر: (A) كان الحمض النووي الأصلي للبروتين الفلوري الأخضر الذي حصلنا عليه من دوغلاس يحتوي على الحمض النووي الذي كان يشفر البروتين (باللون الأخضر) إلى جانب أجزاء حمض نووي أخرى على كل جانب (باللون الأحمر).
- (B) بعد صنع نسخ من الحمض النووي للبروتين الفلوري الأخضر فقط باستخدام تفاعل البوليمراز المتسلسل، تمكّنا من استخدام ذلك الحمض النووي في الربداء الرشيقة حتى تتوهج خلايا محددة من الدودة بالضوء الأخضر الفلوري. تم تقديم الرسم التوضيحي من Iris Gat.
اتضح أننا اخترنا الاستراتيجية الصحيحة. استخدمت جيا تفاعل البوليمراز المتسلسل لنسخ الحمض النووي للبروتين الفلوري الأخضر. وبعد ذلك أدخلت هذا الحمض النووي للبروتين الفلوري الأخضر في جزيء حمض نووي اسمه بلازميد، والذي “تبتلعه” البكتيريا وتدمجه كحمض نووي خاص بها. بعد تسليط ضوء أزرق على الإشريكية القولونية تحتوي على الحمض النووي للبروتين الفلوري الأخضر، توهجت بضوء فلوري [6]. (في المقابل، لم يصدر ضوء فلوري من المجموعات الأخرى التي استخدمت الحمض النووي الأصلي للبروتين الفلوري الأخضر مع أجزاء الحمض النووي الإضافية، فقد منع شيء فيها إنتاج البروتين الفلوري الأخضر. ولو لم نستخدم تفاعل البوليمراز المتسلسل، لما نجحت تجربتنا).
نظرًا لأن طريقتنا نجحت في البكتيريا، استخدمناها بعد ذلك لدمج الحمض النووي للبروتين الفلوري الأخضر في الربداء الرشيقة، وكانت هذه هي رغبتي في البداية، وجعلنا هذه الديدان تتوهج كذلك (الشكل 2B). وقد مهّد ذلك الطريق لدمج البروتين الفلوري الأخضر في كل أنواع الكائنات الحية واستخدامه لعدة تطبيقات.
كيف غيّر البروتين الفلوري الأخضر العلوم
يمكن لأي تطور علمي جديد أن يعزز فهمنا للمبادئ البيولوجية أو الفيزيائية الأساسية ويمكن أيضًا أن يساعدنا في ابتكار تكنولوجيات جديدة. وفي كثير من الأحيان، يتطور الاكتشاف الأصلي في اتجاهات مفاجئة وغير متوقعة بمرور الوقت، وخير مثال على ذلك اكتشاف الليزر. فالعالِم تشارلز تَاوْنِز، الذي قادت جهوده إلى اختراع الليزر، لم يتخيل مطلقًا أنه سيكون مفيدًا في البقالات حيث يتم مسح المنتجات ضوئيًا أو قطاع التسجيلات الصوتية والمرئية لصنع الأقراص المضغوطة أو قطاع السينما لإنتاج أقراص DVD أو في مجال الطب لإجراء جراحات الليزر. وينطبق الشيء نفسه على اكتشاف البروتين الفلوري الأخضر، فقد تطور وسيستمر تطوره في عدة اتجاهات مختلفة ترتقي بالمعرفة العلمية الأساسية والتطبيقات التكنولوجية المتنوعة.
في البحث العلمي، يمكن استخدام البروتين الفلوري الأخضر كواسم بيولوجي لإخبارنا عن نشاط الجينات ونواتجها. يمكن تخيّل الجينات على أنها مكوّنة من جزأين: جزء التشفير والذي يوضّح الناتج المطلوب توليده (الحمض النووي الريبوزي والبروتين) والجزء التنظيمي الذي يبين أين ومتى يجب صنع الناتج والمقدار المطلوب منه. إذا تمت إضافة تسلسل الحمض النووي للبروتين الفلوري الأخضر إلى الجزء التنظيمي فقط، فسيتم صنع البروتين الفلوري الأخضر وسيصبح فلوريًا كلما تم “تنشيط” الجين الطبيعي. على الجانب الآخر، إذا تمت إضافة تسلسل الحمض النووي للبروتين الفلوري الأخضر إلى تسلسلات التشفير، فسيرتبط البروتين الفلوري الأخضر بالبروتين الطبيعي وسيتوهج عند تسليط الضوء الأزرق عليه [7]. يمكننا رؤية أين توجد البروتينات في الخلايا (على سبيل المثال، في النواة أم في الغشاء الخلوي) ويمكننا أيضًا رؤيتها وهي تتحرك في الخلايا الحية، وهذه عملية لم تكن ممكنة باستخدام الطرق السابقة. النقطة المهمة هي أنه بمجرد إدخال الحمض النووي للبروتين الفلوري الأخضر في الحمض النووي لكائن حيّ، يمكن أن ينتقل إلى ذرية ذلك الكائن، وهذا يجعل الاستخدام التجريبي للبروتين الفلوري الأخضر ملائمًا جدًا.
أود التحدث بإيجاز عن اكتشافين يبهراني شخصيًا وتم التوصل إليهما بفضل البروتين الفلوري الأخضر. تم الاكتشاف الأول بواسطة كليفورد برانغوين وأنتوني هايمان في عام 2009 [8]. فقد كانا يدرسان بروتينات في السيتوبلازم، وهو السائل الذي يملأ الفراغ داخل الخلايا. حتى ذلك الحين، كان الناس يظنون أن السيتوبلازم متجانس ومتحد تمامًا، ولكن عندما فحص هذان العالمان بروتينًا معينًا في السيتوبلازم تم وسمه باستخدام البروتين الفلوري الأخضر، بدا أنه يوجد في جسيمات منفصلة عن بقية السيتوبلازم. كانت هذه الجسيمات تتصرف مثل قطرات صغيرة من الزيت في الماء، وفي بعض الأحيان تتجمع وتندمج معًا وفي أحيان أخرى تنفصل إلى نصفين. ولم تختلط هذه البنى مع بقية السيتوبلازم، بل كانت تشكّل طورًا منفصلاً (وغالبًا ما تُسمى بالجسيمات المنفصلة طوريًا (الشكل 3A). تبيّن أن هذا الاكتشاف مهم للغاية لفهمنا لبنية ووظيفة الخلايا، كما فتح مجالاً بحثيًا في غاية النشاط.
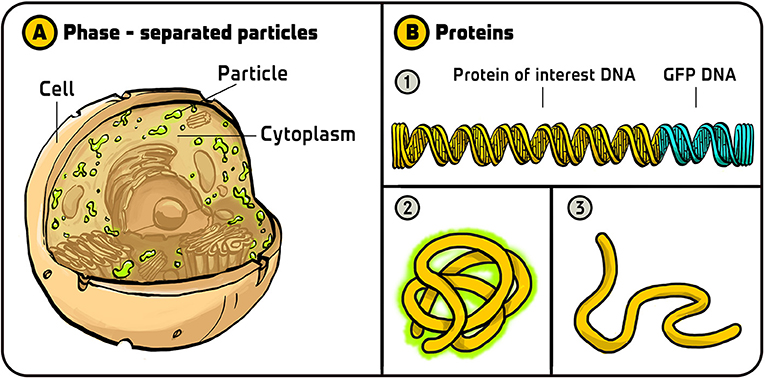
- شكل 3 - استخدامات البروتين الفلوري الأخضر: (A) باستخدام البروتين الفلوري الأخضر، اكتشف كليفورد برانغوين وأنتوني هايمان أن سيتوبلازم الخلايا يحتوي على طورين منفصلين، الطور السائل المعروف وطور آخر يتصرف مثل جسيمات الزيت في الماء.
- (B) استخدم جيف والدو البروتين الفلوري الأخضر لمراقبة طيّ البروتينات. (1) أضاف جيف الحمض النووي للبروتين الفلوري الأخضر إلى نهاية شفرة الحمض النووي لبروتين كان يهمّه. (2) إذا حدث طيّ البروتين (بما في ذلك جزء البروتين الفلوري الأخضر) بشكل صحيح، فسيتوهج بضوء فلوري أخضر. (3) وإذا حدث طيّ البروتين بشكل خاطئ، فلن يصبح فلوريًا. تم تقديم الرسم التوضيحي من Iris Gat.
قام جيف والدو باستخدام آخر للبروتين الفلوري الأخضر، وقد أبهرني شخصيًا بشكل كبير [9]. وجد جيف طريقة ذكية لاستخدام البروتين الفلوري الأخضر لمراقبة طيّ البروتينات، وقد أطلق عليها اسم “مخبر الطيّ”. بعد إنتاج البروتين كسلسلة طويلة من اللبنات الأساسية المسماة بالأحماض الأمينية، يجب طيّه في بنية ثلاثية الأبعاد محددة للقيام بوظائفه. وإذا حدث طيّ البروتين بشكل خاطئ، فلن يعمل بشكل صحيح. عند دراسة البروتينات عن طريق إنتاجها في البكتيريا، على سبيل المثال، نريد التأكّد من طيها بشكل صحيح. بنى جيف حمضًا نوويًا شفّر البروتين المهم له وكذلك البروتين الفلوري الأخضر. واستنتج أنه إذا حدث خطأ في طيّ البروتين محلّ اهتمامه، فلن يحدث أيضًا طيّ البروتين الفلوري الأخضر بشكل صحيح ولن يتوهج. وبالتالي إذا رأى خلايا فلورية، يمكنه استنتاج أن طيّ البروتين محلّ اهتمامه تمّ بشكل صحيح، وفي حالة عدم وجود خلايا فلورية، يمكنه استنتاج أن طيّ البروتين تمّ بشكل خاطئ. وهذه طريقة رائعة جدًا يمكن للعلماء استخدامها لضمان أنهم يعملون مع بروتينات تم طيّها بشكل صحيح (الشكل 3B).
تتعدد الاستخدامات الأخرى للبروتين الفلوري الأخضر ولذلك سأتطرق إلى القليل منها. يستخدم بعض الناس البروتين الفلوري الأخضر لدراسة كيفية إصابة الفيروسات للخلايا. وقد استخدمت دراسة بارزة البروتين الفلوري الأخضر لتلوين فيروس نقص المناعة البشرية، وهو المسبب لمرض الإيدز، لفحص كيف ينتشر الفيروس من خلية إلى أخرى [10]. وتبيّن في هذه الدراسة أن فيروسات نقص المناعة البشرية يمكن أن تتحرك بين الخلايا بدون تدميرها (تمامًا كحال العديد من الفيروسات الأخرى). ويوضح هذا الاكتشاف ضمنيًا كيف يمكن التحكم في انتقال الفيروس من خلية إلى أخرى. تدرس مجموعات أخرى كيف يمكن استخدام البروتين الفلوري الأخضر لاكتشاف الألغام الأرضية وبقايا المتفجرات [11]. وفي اليابان، يستخدم الناس البروتين الفلوري الأخضر لإنتاج حرير يتوهج بضوء أخضر [12]. هناك العديد من الاستخدامات المهمة الأخرى لهذا البروتين ولبروتينات فلورية أخرى لها ألوان مختلفة اكتشفها العلماء أو صنعوها. وتعطيك هذه الأمثلة لمحة أولية حول مدى الفائدة المحتملة للبروتينات الفلورية.
نصائح للعلماء الصغار
لا أظن أن هناك “وصفة” لإجراء الأبحاث العلمية المهمة، ولكن هناك أشياء أراها مهمة. ومن أهم القدرات التي يتمتع بها أي عالِم ناجح هي القدرة على طرح الأسئلة. وهناك العديد من الأسئلة الرائعة المطروحة التي تنتظر الإجابة عنها، ولكن إذا لم نكن معتادين على طرح الأسئلة، فقد نغفلها. يُعدّ طرح الأسئلة من الطرق الرائعة لفهم الأشياء. فعند تعلم شيء جديد، اسأل نفسك عن كيفية تطبيق معارفك الجديدة على مواضيع أخرى تهمك. وهذا نهج مهم أستخدمه في عملي طوال الوقت. من الجوانب الأخرى المهمة لطرح الأسئلة التشكيك في افتراضاتك (الشكل 4)، أي لماذا تؤمن بما تؤمن به؟ في الكثير من الأحيان، عندما نفحص افتراضاتنا بهذه الطريقة، نجد أخطاءً فيها. وعند تصحيح هذه الأخطاء وتعديل افتراضاتنا، يمكننا الارتقاء بمعارفنا وتعزيز فهمنا.

- شكل 4 - ثلاث نصائح للعلماء الصغار: تم تقديم الرسم التوضيحي من Iris Gat.
غالبًا ما أنصح الطلاب بالعمل على مشروعين في الوقت نفسه. وبهذه الطريقة، إذا لم ينجح مشروع منهما، يظل بإمكانهم استمداد النجاح والتحفيز من الآخر. العلم كرحلة تواجه فيها المجهول. وهي رحلة ليست سهلة دائمًا وقد تكون محبطة، ونرتكب الكثير من الأخطاء في أثنائها. لا تنجح أفكارنا في بعض الأحيان ولكن إحراز أي تقدّم في مواجهة المجهول هو جزء شديد الحماس من تكوينك كعالِم. في بعض هذه الأحيان، تمنحك هذه الرحلة الصعبة مكافآت رائعة، مثل اكتشاف شيء لم يعرفه أحد من قبل، ثم مشاركة ذلك الاكتشاف مع الآخرين.
آخر نصيحة أوجهها لك ألا تفرط في القلق بشأن درجاتك، إذ يمكن ألا يكون لها أي دور في النجاح في مجال العلوم. وأعتقد أن الحماس والمثابرة أهم كثيرًا من الدرجات. فأنا حصلت على درجات متوسطة (C) في الكيمياء عندما كنت في المرحلة الجامعية، ثم حصلت على جائزة نوبل في الكيمياء بعد حوالي 30 عامًا من ذلك الوقت (أحب كثيرًا هذه المفارقة الساخرة). إذا كنت مهتمًا بالعلوم، فممارستها من أفضل الطرق لإجادتها.
حاول القيام بتجارب وملاحظة شعورك حيالها، فهذه هي الطريقة الأكثر موثوقية لمعرفة إذا كانت العلوم هي الخيار المناسب لك.
مسرد للمصطلحات
التلألؤ البيولوجي (Bioluminescence): ↑ توليد الضوء من الكائنات الحية.
Aequorin (Aequorin): ↑ بروتين يتوهج باللون الأزرق تم اكتشافه في قنديل البحر البلوري ###Aequorea victoria$$$ بواسطة البروفيسور أوسامو شيمومورا.
الجزيئات الفلورية (Fluorescent Molecules): ↑ جزيئات تحوّل لونًا ضوئيًا واحدًا (أزرق على سبيل المثال) إلى لون آخر (أخضر على سبيل المثال).
البروتين الفلوري الأخضر (GFP) (Green Fluorescent Protein (GFP)): ↑ بروتين تم اكتشافه لأول مرة في قنديل البحر البلوري ###A. victoria$$$. يمتص بروتين GFP الضوء الأزرق ويحوّله إلى الضوء الأخضر.
الخلايا العصبية (Nerve Cells): ↑ خلايا بالجهاز العصبي تستقبل المعلومات من البيئة وتعالجها باستخدام الإشارات الكهربائية والكيميائية وتولّد مخرجات مثل الحركة.
الواسم البيولوجي (Biological Marker): ↑ جزيء بيولوجي يستخدمه الباحثون للإشارة إلى عملية أو حالة بيولوجية.
تفاعل البوليمراز المتسلسل (PCR) (Polymerase Chain Reaction (PCR)): ↑ طريقة معملية لإنتاج عدة نسخ من جزء محدد من الحمض النووي باستخدام إنزيم نسخ الحمض النووي والذي يُسمى بوليمراز الحمض النووي.
الجين (Gene): ↑ جزء من الحمض النووي يحمل المعلومات اللازمة لإنتاج بروتين معين.
شكر وتقدير
أود أن شكر نوا سيغيف على إجراء المقابلة التي استند إليها هذا المقال وعلى مشاركتي في تأليفه، وإيريس غات على توفير الأشكال (https://www.irisgat-art.com/)، وسوزان ديباد على التحرير اللغوي للمقال.
مواد إضافية
- The five myths about scientists according to Nobel Laureate Martin Chalfie
- Martin Chalfie, Nobel Laureate, on Failed and Useless
إفصاح أدوات الذكاء الاصطناعي
تم إنشاء النص البديل (alt text) المرفق بالأشكال في هذه المقالة بواسطة ''فرونتيرز'' (Frontiers) وبدعم من الذكاء الاصطناعي، مع بذل جهود معقولة لضمان دقته، بما يشمل مراجعته من قبل المؤلفين حيثما كان ذلك ممكناً. في حال تحديدكم لأي خطأ، نرجو منكم التواصل معنا.
إقرار تضارب المصالح
يعلن المؤلف أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
المراجع
[1] ↑ Shimomura, O., Johnson, F. H., and Saiga, Y. 1962. Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell. Compar. Physiol. 59:223–39. doi: 10.1002/jcp.1030590302
[2] ↑ Shimomura, O. 2009. Discovery of green fluorescent protein (GFP) (Nobel Lecture). Angew. Chem. Int. Ed. 48:5590–602. doi: 10.1002/anie.200902240
[3] ↑ Morin, J. G., and Hastings, J. W. (1971). Energy transfer in a bioluminescent system. J. Cell. Physiol. 77:313–8. doi: 10.1002/jcp.1040770305
[4] ↑ Prasher, D. C., Eckenrode, V. K., Ward, W. W., Prendergast, F. G., and Cormier, M. J. 1992. Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111:229–33. doi: 10.1016/0378-1119(92)90691-H
[5] ↑ Mullis, K., Faloona, F., Scharf, S., Saiki, R., Horn, G., and Erlich, H. 1992. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Biotechnol. Ser. LI:17.
[6] ↑ Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., and Prasher, D. C. 1994. Green fluorescent protein as a marker for gene expression. Science 263:802–5. doi: 10.1126/science.8303295
[7] ↑ Wang, S., and Hazelrigg, T. 1994. Implications for bcd mRNA localization from spatial distribution of exu protein in Drosophila oogenesis. Nature 369:400–3. doi: 10.1038/369400a0
[8] ↑ Brangwynne, C. P., Eckmann, C. R., Courson, D. S., Rybarska, A., Hoege, C., Gharakhani, J., et al. 2009. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science 324:1729–32. doi: 10.1126/science.1172046
[9] ↑ Waldo, G. S., Standish, B. M., Berendzen, J., and Terwilliger, T. C. (1999). Rapid protein-folding assay using green fluorescent protein. Nat. Biotechnol. 17:691–5. doi: 10.1038/10904
[10] ↑ Hübner, W., McNerney, G. P., Chen, P., Dale, B. M., Gordon, R. E., Chuang, F. Y., et al. 2009. Quantitative 3D video microscopy of HIV transfer across T cell virological synapses. Science 323:1743–7. doi: 10.1126/science.1167525
[11] ↑ Shemer, B., Palevsky, N., Yagur-Kroll, S., and Belkin, S. 2015. Genetically engineered microorganisms for the detection of explosives’ residues. Front. Microbiol. 6:1175. doi: 10.3389/fmicb.2015.01175
[12] ↑ Shimizu, K. 2018. Genetic engineered color silk: fabrication of a photonics material through a bioassisted technology. Bioinspir. Biomimet. 13:041003. doi: 10.1088/1748-3190/aabbe9
