ملخص
كان حلم طفولتي أن أصبح رائد فضاء وكنت من أشد المعجبين بالخيال العلمي. وكانت تستهويني دومًا الشخصيات البطولية التي اخترعت شيئًا جديدًا أدى إلى إنجاز هائل. عندما بدأت مسيرتي العلمية، لم أرغب في القيام بشيء صغير، بل بإنجاز مختلف ومؤثر جدًا. ولهذا اخترت العمل على واحدة من أصعب المسائل في مجال المجهرية الضوئية (أي التي تستخدم الضوء)، وهي كيفية رؤية الأشياء الأصغر حجمًا من الطول الموجي للضوء المرئي. وكان هذا يعني تجاوز أحد القيود الذي اعتقدنا لفترة طويلة أنه لا يمكن تجاوزه. في أبحاثي، طورت طريقةً اسمها مجهرية التموقع المنشط ضوئيًا ،(PALM) والتي أتاحت لنا تجاوز هذا القيد باستخدام الجزيئات المتوهجة (الفلورية). وباستخدام طريقة PALM وغيرها من الطرق المعتمدة على الجزيئات المتوهجة، يمكن للعلماء تعلم أشياء جديدة حول الخلايا الحية والجزيئات الفردية والارتقاء بفهمنا للحياة إلى حد كبير.
فاز البروفيسور Eric Betzig بجائزة نوبل في الكيمياء في عام 2014، مشاركةً مع البروفيسور شتيفان هيل والبروفيسور وليام مورنر بفضل تطوير المجهرية الفلورية فائقة الدقة.
كيف يمكننا رؤية الأشياء الصغيرة؟
عندما ننظر إلى جسم ما، نكشف في الواقع الضوء الذي يرتد من الجسم ويصل إلى العينين. تخيّل مثلاً غواصة تستخدم السونار. عندما تبحر غواصة في البحر، ترسل موجات صوتية وتكشف الموجات التي ترتد إليها من الأجسام تحت البحر، مثل الصخور والحيوانات البحرية (الشكل 1A). بهذه الطريقة، يعرف طاقم الغواصة كيفية الإبحار تحت الماء. ينطبق المبدأ نفسه عندما نريد فحص أشياء في المختبر، مثل الخلايا أو الكائنات الحية الصغيرة. نسلّط الضوء (أو شكلاً آخر من الإشعاع، مثل الإلكترونات) على الجسم الصغير ونتفقّد الشيء الذي يرتد من الجسم. يُحدد نوع الإشعاع بمقياس يُسمى الطول الموجي. كما تعلم، تتميز الموجات بنمط تتكرر فيه القمم المرتفعة والقيعان المنخفضة. والطول الموجي هو المسافة بين قمتين (الشكل 1B).
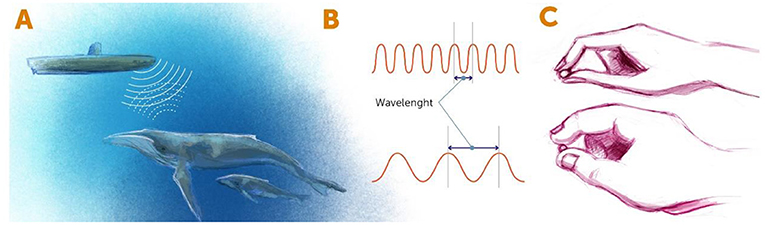
- شكل 1 - كشف الأجسام باستخدام الإشعاع: (A) في أنظمة السونار بالغواصات، تُستخدم إشعاع الموجات الصوتية لكشف الأجسام القريبة.
- تنبعث الموجات الصوتية من الغواصة، وترتد عن الأجسام القريبة، ثم تعود إلى جهاز الكشف في نظام السونار. وبالمثل، عندما نرى شيئًا بالعينين، تصطدم الموجات الضوئية بالجسم وترتد إلى أجهزة الكشف لدينا (العينين). (B) يمكن وصف أشكال الإشعاع حسب أطوالها الموجية. يُعرّف الطول الموجي بأنه المسافة بين قمتين متعاقبتين للموجة الإشعاعية. (C) يشبه الطول الموجي القصير (بالأعلى) الأصابع الصغيرة التي تساعدنا على "تفحّص" التفاصيل الصغيرة لجسم ما، في حين يشبه الطول الموجي الطويل (بالأسفل) الأصابع الممتلئة التي يمكننا بها "تفحّص" التفاصيل الواضحة فقط.
عند فحص الأجسام الصغيرة، يحدد الطول الموجي للطاقة المرتدة من هذا الجسم الدقة التي يمكننا بها رؤية ذلك الجسم. كلما كان الطول الموجي أقصر، كانت الأجسام التي يمكننا رؤيتها أصغر. يمكنك تخيّل ذلك مثل الأصابع التي تحاول "لمس" جسم (الشكل 1C). إذا كانت الأصابع غليظة (أي الأطوال الموجية طويلة)، فلا يمكننا تفحص التفاصيل الدقيقة للجسم، تمامًا كما عندما تحاول لمس ملامح عرضها مليمتر واحد بأصابع غليظة. وبالتالي، إذا أردنا تفحص التفاصيل الصغيرة لجسم ما، فهناك خياران. أولاً، يمكننا استخدام شكل من الإشعاع له طول موجي صغير للغاية، مثل الأشعة السينية. ولكن المشكلة أن التعرّض المطوّل للطاقة العالية للأطوال الموجية القصيرة يمكن أن يقتل الكائنات الحية وبالتالي لا يمكننا دراسة الخلايا أو الكائنات الحية باستخدام هذه الأطوال الموجية القصيرة. والخيار الآخر هو العثور على حيلة معينة تتيح لنا استخدام الأطوال الموجية الطويلة التي تكون طاقتها أقل، مع التمكن بطريقة ما من تجاوز قدرات تلك الأطوال الموجية. وهذه هي الفكرة الكامنة وراء المجهرية فائقة الدقة، وهو المصطلح الذي نطلقه على أي طريقة للمجهرية تتيح لنا تجاوز حدود الأطوال الموجية التي تستخدمها.
قبل تطوير المجهرية فائقة الدقة، كان بإمكاننا رؤية الكائنات الحية الصغيرة التي يبلغ حجمها حوالي 200 نانومتر (أو 0.0002 مليمتر) مثل الحجيرات الكبيرة داخل خلايا الحيوانات، بل وحتى الكائنات الحية المكوّنة من خلية واحدة مثل البكتيريا. لم يكن بإمكاننا رؤية الكائنات الحية الأصغر حجمًا، مثل الفيروسات أو أجزاء الخلايا الصغيرة مثل البروتينات الفردية أو الجزيئات الصغيرة الأخرى (الشكلان 2A, B). حدثت طفرة هائلة بعد أن أصبح بإمكاننا رؤية الكائنات الحية بهذه الدقة العالية، حيث بدأ مجال بحثي جديد كليًا وتمكّن الباحثون من تعزيز فهمهم لأهم العمليات الحياتية. وتمكننا من رؤية تفاصيل كان يستحيل كشفها في السابق باستخدام أساليب المجهرية التقليدية، كما تولّد حماس كبير لدراسة ألغاز الحياة (الشكلان 3A, B).
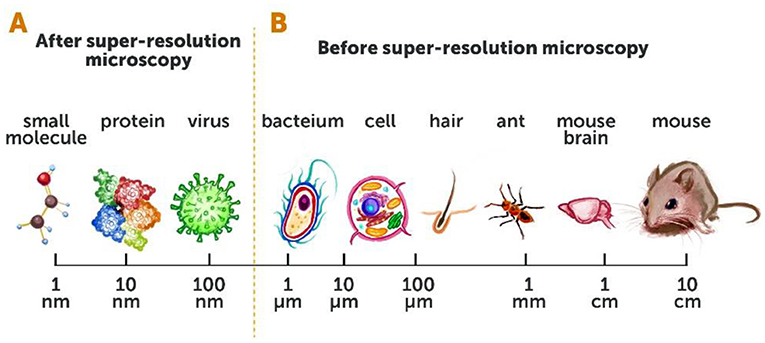
- شكل 2 - المجهرية التقليدية مقابل المجهرية فائقة الدقة: (A) وسعت المجهرية فائقة الدقة من قدرتنا على رؤية نطاق كامل من الأجسام، يصل حجمها إلى تقريبًا 10 نانومتر [1 نانومتر = واحد على المليار (0.000000001) من المتر].
- (B) قبل المجهرية فائقة الدقة، كان بإمكاننا فقط رؤية الأجسام التي يبلغ حجمها 200 نانومتر (حجم بكتيريا واحدة تقريبًا) أو أكبر.
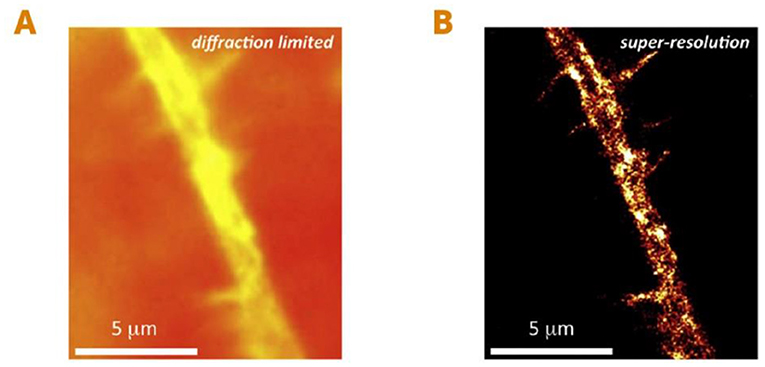
- شكل 3 - رؤية بروتينات فردية في الخلايا الحية باستخدام المجهرية فائقة الدقة: (A) صورة لفرع صغير لخلية عصبية حيّة تم التقاطها باستخدام مجهر تقليدي.
- (B) فرع الخلية العصبية نفسه باستخدام مجهر فائق الدقة. تسمح لنا هذه الطريقة برؤية تفاصيل صغيرة لم يكن من الممكن ملاحظتها سابقًا. في هذه الحالة، يمكننا رؤية قنوات أيونية صغيرة وهي بروتينات في غشاء الخلية العصبية (بقع صفراء لامعة) مسؤولة عن توصيل الكهرباء في الخلايا العصبية [منقول بتصرّف من [1]]. المقياس: واحد ميكرومتر (μm) يساوي 1,000 نانومتر.
البداية: مجهرية المجال القريب
عندما بدأت دراساتي المتقدمة في الجامعة في عام 1983، فكّر اثنان من أساتذتي الجامعيين، وهما مايك إيزاكسون وأرون لويس، في فكرة غير عادية، وهي محاولة تجاوز ما كان يُسمى حد حيود آبي.
وهو المفهوم الذي يشير إلى أن أصغر شيء يمكننا رؤيته باستخدام الموجات الضوئية يجب ألا يقل عن نصف الطول الموجي لذلك الضوء. على سبيل المثال، إذا كان الطول الموجي يساوي 1 ملم، يمكننا رؤية أجسام لا يقل طولها عن 0.5 ملم. اعتقد الأستاذان أنهما يستطيعان تجاوز هذا الحد بالتلاعب بالضوء بطريقة معينة. واستندت فكرتهما إلى أول عرض توضيحي لتجاوز حد حيود آبي، والذي تم إجراؤه عام 1972 [2]. كانت الفكرة الأساسية عبارة عن حفر ثقب صغير يقل حجمه كثيرًا عن الطول الموجي للضوء في لوحة سوداء صغيرة. عندما توضع اللوحة في مكان قريب جدًا من الجسم المراد فحصه ويشع الضوء من خلال الثقب، يضيء بقعة صغيرة جدًا من الجسم يقل حجمها بكثير عن الطول الموجي للضوء. وبعد ذلك، يمكن "مسح" الجسم من خلال تدوير اللوحة المضيئة حول الجسم في كل الاتجاهات. وباستخدام هذه الحيلة، يمكننا رؤية الجسم بدقة أعلى من الدقة "العادية" للضوء القادم. تُسمّى هذه الطريقة اليوم المجهرية الضوئية ذات المجال القريب [3, 4].
كانت هذه أول طريقة مجهرية فائقة الدقة عملت عليها، ولكن مشكلتها الأساسية أن الضوء الذي يمرّ من خلال الثقب الصغير ينتشر بسرعة كبيرة جدًا على الجانب الآخر. وللحصول على دقة عالية، يجب أن نعمل على مقربة كبيرة جدًا من الجسم الذي نصوره. غير أن هذه العملية صعبة في حالة الخلايا مثلاً، لأن الخلايا ليست مسطحة ولذا يصعب التحكم في اللوحة أعلاها. بعد العمل على هذه الطريقة لعدة سنوات وتطويرها قدر الإمكان، قررت إيقاف جهودي بشأنها والتوقف عن مجال العلم كليًا. ولم أكن أعلم أنه بعد سنوات قليلة، سيدفعني إنجاز هائل في مجال الكيمياء الحيوية إلى العودة إلى العلم والمجهرية.
المجهرية الفلورية فائقة الدقة
في عام 1994، نُشرت دراسة رائدة [5] تثبت أنه باستخدام الهندسة الوراثية، يمكننا ربط "واسم" متوهج، يُطلق عليه البروتين الفلوري، بأي بروتين في الخلايا الحية. وهذا بروتين خاص لأنه يتوهج عند تسليط طول موجي محدد للضوء عليه. أدركت فورًا أن هذا الإنجاز سيحدث طفرة هائلة في مجال المجهرية لأنه يمكن أن يساعدنا في رؤية البنى الصغيرة للأجسام داخل الخلايا. وبعد عام، أي في 1995، نشرتُ مقالة وضعت الأساس لطريقة مجهرية جديدة [6]. ولكن الإنجازات الأخرى في مجال الجزيئات الفلورية في أوائل الألفينيات هي التي سمحت لي بإكمال فكرتي. شملت هذه الإنجازات ابتكار جزيئات لم تكن دومًا فلورية، ولكن يمكن "تنشيطها" لتتوهج عند تسليط طول موجي محدد للضوء عليها [7]. معنى ذلك أنه كان بإمكاننا ربط واسمات متوهجة ببروتينات معينة داخل الخلايا الحية وتنشيطها عمدًا لدراسة البنى والعمليات الخلوية. وكانت هذه بداية طريقة المجهرية الفلورية فائقة الدقة التي ساهمت في تطويرها، والتي كانت تُسمى في البداية مجهرية التموقع المنشط ضوئيًا(PALM) [8, 9]. وفي عام 2014، حصلت على جائزة نوبل في الكيمياء بفضل هذه الطريقة.
كانت الفكرة الأساسية وراء طريقة PALM كما يلي: تحتوي كل خلية على 20,000 نوع مختلف من البروتينات، وفي الغالب عدة آلاف من كل نوع، ونريد فهم آلية عملها كلها معًا. باستخدام مجهر تقليدي كالذي لديك في صف الأحياء في المدرسة، كل ما يمكنك رؤيته عند النظر إلى هذه البروتينات في خلية معينة هو كتلة متوهجة كبيرة. والبروتينات قريبة جدًا من بعضها لدرجة أنه لا يمكن التمييز بينها. في طريقة PALM، نربط واسمات فلورية خاصة بالبروتينات، وهي واسمات يمكن تنشيطها بواسطة ليزر منخفض الطاقة (بالضوء البنفسجي) (الشكل 4، الخطوة 1) فتتوهج ويكون بالإمكان كشفها عندما يسطع عليها ليزر آخر عالي الطاقة (بالضوء الأزرق) (الشكل 4، الخطوة 2).
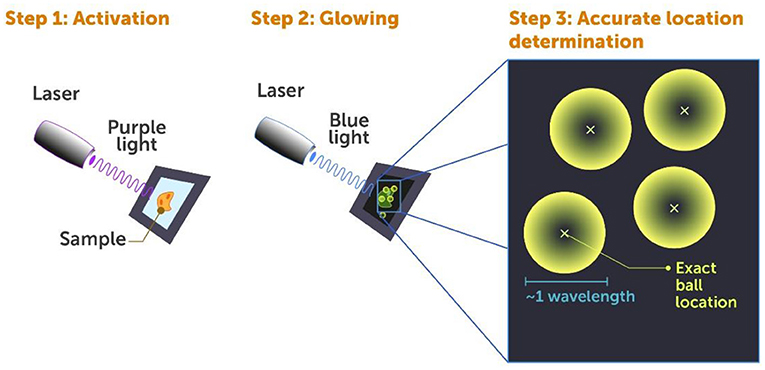
- شكل 4 - مجهرية التموقع المنشط ضوئيًا (PALM): هناك ثلاث خطوات عند استخدام طريقة المجهرية فائقة الدقة PALM مع الخلايا الموسومة فلوريًا: الخطوة 1: يتم تسليط شعاع ليزر من الضوء البنفسجي الضعيف على الخلية في نبضات قصيرة لتنشيط الواسمات الفلورية على بعض البروتينات فقط، ما يجعلها جاهزة للتوهج.
- الخطوة 2: يتم تسليط شعاع ليزر أزرق على الخلية، ما يجعل البروتينات المنشّطة تتوهج حتى يصبح بالإمكان كشفها. الخطوة 3: يتم تحديد موقع البروتينات الفردية بالكمبيوتر من خلال البحث عن المركز (علامة X صغيرة) في كل "كرة ضوء" ناشئة عن كل بروتين فلوري.
إذا نشّطنا كل الواسمات في الوقت نفسه، فستتوهج جميعها معًا، مما سيؤدي إلى فوضى كبيرة، ومن هنا تنشأ الكتلة المتوهجة الكبيرة. ولهذا السبب نستخدم نبضات من ضوء بنفسجي منخفض الطاقة بدرجة كبيرة لتنشيط الواسمات، بعضها فقط في المرة الواحدة مع كل نبضة. ويُنشط هذا العدد القليل من الواسمات بشكل عشوائي، وتنفصل على الأرجح عن بعضها جيدًا داخل الخلية. وعندما نستخدم الضوء الأزرق لكشف هذه الواسمات المنشطة، تبدو مثل كرات متوهجة صغيرة (الشكل 4، الخطوة 2) يصل حجمها إلى ~1 طول موجي للضوء، نظرًا لأن هذا أصغر شيء يمكن أن يظهر في المجهر التقليدي محدود الحيود الذي نستخدمه للنظر إليها (الشكل 4، الخطوة 3).
وهنا يأتي دور الحيلة، إذ يمكننا استخدام كمبيوتر لمعالجة الصورة التي نحصل عليها من المجهر والعثور بدقة على مركز كل كرة من هذه "الكرات". يمكنك تخيّل ذلك مثل كرة سلة لها شكل كروي وقطر محدد. يمكنك الإشارة إلى مركز كرة السلة بدقة أفضل بكثير من تقدير القطر، حتى لو لم تكن ترى المركز مباشرةً. ينطبق الأمر نفسه على هذه الكرات الجزيئية، حيث يمكننا العثور على مراكزها بدقة كبيرة للغاية، تقترب كثيرًا من حجمها الحقيقي مقارنةً بحجم الكرات المتوهجة. معنى هذا أنه في كل مرة نسلط فيها نبضًا ضوئيًا على الخلايا، يمكننا تحديد مواضع مجموعة صغيرة من البروتينات داخل الخلية (الشكل 4، الخطوة 3). ينطفئ الضوء الفلوري لهذه البروتينات بشكل طبيعي، وعندها يمكننا تسليط الضوء على مجموعة أخرى من البروتينات والعثور على موقعها.
ويستغرق الأمر عادةً عشرات آلاف الجولات من التنشيط لتحديد المواقع في خلية كاملة. ولكن الأمر مُجدِيٌ ، حيث نحصل على صورة فائقة الدقة للخلية أو أي جسم آخر ندرسه (انظر الشكل 3B والصور في Betzig وآخرين. [9]).
تحديات وإمكانات المجهرية فائقة الدقة
كما رأيت، تتميز طريقة PALM ببساطة كبيرة، فكل ما تحتاجه هو ليزر يسلط شعاع ضوء على الجسم وكاميرا وبرنامج كمبيوتر بسيط نسبيًا للعثور على مراكز البروتينات المتوهجة، وهذه الأدوات رخيصة وبسيطة. في الحقيقة، أنشأنا أنا وصديقي البروفيسور هارالد هيس أول نموذج لطريقة PALM في غرفة المعيشة الخاصة به بأدوات اشتريناها بمالنا الخاص في حين كنا عاطلين عن العمل. واستخدام العينة البيولوجية في التجارب هو أصعب جزء، فهناك تحديات كثيرة، من بينها صعوبات تحضير الخلايا الحية للتجارب، وإتلاف الخلايا نتيجة التعرض للضوء، وتحديد أفضل طرق لكشف وتحليل الضوء المنبعث من الجزيئات التي تهمنا.
بالنسبة لتحضير الخلايا، تبيّن أن الكثير من الواسمات التي يمكننا تنشيطها باستخدام الضوء لا ترتبط في الواقع بالبروتينات التي نرغب في رؤيتها، بل بأجسام أخرى صودف أنها قريبة. معنى ذلك أنه في أغلب الأوقات لا ترشدنا الواسمات التي نستخدمها إلى مواقع البروتينات المهمة لنا. بالإضافة إلى ذلك، حتى لو تمكنا من وسم البروتينات الصحيحة، ينجح هذا مع نسبة ضئيلة منها، وهذا لا يكفي غالبًا لإعطائنا صورة كاملة حول الخلية بأعلى دقة ممكنة. وحتى إذا تمكنا من وسم ما يكفي من البروتينات الصحيحة، فالخلايا تنفر من تعرضها للضوء الشديد. ولكن كلما زادت شدة الضوء المسلّط على الخلايا، تمكّنا من العثور على المزيد من المعلومات. وبالتالي، نحاول دومًا التوصل إلى توازن بين استخلاص أكبر قدر ممكن من المعلومات مع تجنّب إتلاف الخلايا.
آخر تحدي سأشير إليه هنا هو ظاهرة اسمها التبييض الضوئي. وهي تصف حقيقة أن الواسمات لا يمكنها التوهج إلا لعدد محدد من المرات. بمعنى آخر، لا يمكن سوى لكمية محدودة من الضوء أن تشع من واسم معين قبل أن يتلف أو يصبح مظلمًا بشكل نهائي. وفي بعض الأحيان، لا تكفينا كمية الضوء هذه لاستخراج المعلومات التي نحتاجها للعثور على الموقع الدقيق للواسم.
كما ذكرت سابقًا، تُعد المجهرية الفلورية فائقة الدقة فريدة لأنها تتيح لنا تصوير الكائنات والخلايا الحية. وباستخدام هذه الطريقة، لا نستطيع فحسب تحديد بنية الكائنات الحية، بل يمكننا أيضًا تتبع العمليات التي تحدث داخل الخلية، مثل حركة البروتينات بمرور الوقت (انظر هذا الفيديو) [10, 11].
وباستخدام ما يُسمى بتتبع الجزيء الواحد، يمكننا استكشاف أعمق أسرار الخلايا الحية والاطلاع على أهم العمليات الحياتية. على سبيل المثال، ساعدنا تتبع الجزيء الواحد في فهم كيف يتم إنتاج نسخ الحمض النووي الريبوزي من الحمض النَّووي الرِّيبي منقوص الأكسجين داخل نواة الخلية، وهي عملية تُسمى النسخ.
يمكننا الاستفادة كثيرًا من تتبع الجزيئات الفردية واكتشاف كيف تتحرك داخل الخلايا، على سبيل المثال في تطوير العقاقير الجديدة. وفي رأيي، فإن المعلومات التي يمكننا تعلمها بشأن الآليات الخلوية التي لم يكن بمقدورنا في السابق رؤيتها قد تقود إلى نموذج جديد كليًا لاكتشاف العقاقير وعلاجات جديدة مهمة للعديد من الأمراض، مثل الزهايمر وباركنسون. وأنا أرى أن هذا قد يكون أكبر إنجاز للمجهرية فائقة الدقة، ولذلك أسسنا أنا وزملائي شركة لاكتشاف العقاقير اسمها ©Eikon Therapeutics.
نصائح للعلماء الصغار
كما ذكرت سابقًا، عندما كنت طفلاً، كانت تلهمني شخصيات أبطال الخيال العلمي ورواد الفضاء، فهم يمثلون القدرة على إحداث تأثير في العالم من خلال تحسين حياة الناس إلى حد كبير. وبالنسبة لي، هذا هو أسمى هدف يمكن أن يختاره الإنسان في الحياة. وبالتالي، أنصح باختيار القيام بشيء مؤثر ومجدٍ بصرف النظر عن المسيرة المهنية التي تتبعها. ولا يجب أن يكون الشيء كبيرًا، فتربية الأطفال مؤثرة وتعبئة البقالة في المتاجر لها تأثير كبير أيضًا. حاول العثور على شيء يجمع بين اهتماماتك الشخصية وذي تأثير إيجابي على الناس من حولك أو المجتمع ككل (الشكل 5). وإذا اخترت طريق العلماء، فلا تحصر اختياراتك على العمل كأستاذ جامعي، فهذا يجب ألا يكون هدفًا في حد ذاته، لأنه هناك العديد من الطرق لتقديم مساهمات مجدية واكتشافات رائعة خارج السلك الأكاديمي.

- شكل 5 - نصائح للعلماء الصغار: وأنت تصنع مستقبلك، حاول القيام بشيء تحبه ويقدم إسهامات مجدية للمجتمع.
بشكل شخصي، أجد العديد من الميزات في إجراء الأبحاث التي أقوم بها. فأنا مستقل، وأستمتع بذلك لأنني أحب اتخاذ القرارات بنفسي بدلاً من أن يملي عليّ الآخرون ما أقوم به. ثانيًا، في مجالي العلمي، أحاول اختراع أدوات جديدة للأشخاص الذين يحاولون الإجابة عن أسئلة علمية خارج خبرتي. معنى هذا أنه يجب عليّ تعلّم الكثير من الأشياء الجديدة وأن ألمّ ببعض الشيء عن كل شيء. فأنا أعرف القليل جدًا عن الكثير من الأشياء في مجالات عديدة، بدءًا من المواد التي تعمل بشكل أفضل في الآلات المختلفة، مرورًا بالأحياء والفيزياء، ووصولاً إلى تصميم أدوات بحثية جديدة. ويستمر تدفق هذه المعرفة الواسعة في حياتي اليومية وأفهم الآن أشياءً أراها حولي وأستمتع بالجمال والتعقيد في عالمي كل يوم.
وآخر شيء أود مناقشته هو الموقف الذي تختاره في أي شيء تقوم به. أولاً، يجب ألا تغفل أبدًا التفكير الناقد في أي مسألة تواجهها. ينبغي ألا تكتفي بالتفكير الآلي السطحي، بل حاول أن تستكشف أعماق الأشياء التي تواجهها. ثانيًا، إياك أن تخاف المخاطرة، وفي رأيي، لقد أصبح المجتمع أكثر معارضةً للمخاطر، ما قيّد قدرتنا على الابتكار والتقدم، كأفراد وكمجتمع على حدٍّ سواء. أخيرًا، من المهم العمل بكد، فبصرف النظر عما تفعله أو عمرك، حاول تحفيز نفسك على الاجتهاد مع الاستمتاع في الوقت نفسه. لا تلوم نفسك إذا صعبت عليك الأمور، بل قم بجهود جادة للحصول على ما تريده. إذا لم تتفوق، فلا بأس، لأن كل إنسان يجيد أشياءً مختلفة، ولا يوجد أحد يجيد كل شيء. ولكن اجتهد في كل ما تفعله، فالعمل الجاد سيوصلك إلى شيء ما. ابحث عن شغفك واجتهد فيه وجِده، ثم واصل الأمر واستفد منه واستمتع بالعملية أيضًا.
مسرد للمصطلحات
الإشعاع (Radiation): ↑ طاقة تُطلق في شكل موجات أو جسيمات من مصدر.
الطول الموجي (Wavelength): ↑ مقياس للمسافة بين قمتين متعاقبتين لموجة.
المجهرية فائقة الدقة (Super-resolution Microscopy): ↑ أي طريقة للمجهرية تتيح لنا تجاوز حدود الأطوال الموجية التي تستخدمها وتمكننا من رؤية الأجسام بدقة أكبر.
حد حيود آبي (Abbe’s Diffraction Limit): ↑ الحد الفيزيائي للمجاهر الضوئية الذي يمكننا من خلاله التمييز بين نقطتين في جسم ما فقط إذا كانت المسافة بينهما ليست أصغر من نصف الطول الموجي للضوء المستخدم في التصوير العلمي.
المجهرية الضوئية ذات المجال القريب (Near-field Scanning Optical Microscopy): ↑ أول طريقة مجهرية فائقة الدقة تم تطويرها أثناء الثمانينيات.
مجهرية التموقع المنشط ضوئيًا (PALM) (Photoactivated Localization Microscopy (PALM)): ↑ طريقة مجهرية فائقة الدقة قمت بتطويرها وتستخدم الجزيئات الفلورية لتجاوز حد حيود آبي،
التبييض الضوئي (Photobleaching): ↑ ظاهرة في المواد الفلورية، حيث تصبح عاجزة بشكل نهائي عن التوهج بعد القيام بذلك لعدد محدد من المرات.
شكر وتقدير
أود شكر نوا سيغيف على إجراء المقابلة التي استند إليها هذا المقال وعلى مشاركتي في تأليفه، كما أتوجه بالشكر إلى أليكس بيرنشتاين على توفير الأشكال.
مواد إضافية
- Eric Betzig and Harald Hess (Janelia Farm/HHMI): Developing PALM Microscopy.
- Prof. Betzig Nobel Lecture.
إفصاح أدوات الذكاء الاصطناعي
تم إنشاء النص البديل (alt text) المرفق بالأشكال في هذه المقالة بواسطة ''فرونتيرز'' (Frontiers) وبدعم من الذكاء الاصطناعي، مع بذل جهود معقولة لضمان دقته، بما يشمل مراجعته من قبل المؤلفين حيثما كان ذلك ممكناً. في حال تحديدكم لأي خطأ، نرجو منكم التواصل معنا.
إقرار تضارب المصالح
يعلن المؤلف أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
المراجع
[1] ↑ Ondrus, A. E., Hsiao-lu, D. L., Iwanaga, S., Parsons, W. H., Andresen, B. M., Moerner, W. E., et al. 2012. Fluorescent saxitoxins for live cell imaging of single voltage-gated sodium ion channels beyond the optical diffraction limit. Chem. Biol. 19:902–12. doi: 10.1016/j.chembiol.2012.05.021
[2] ↑ Ash, E. A., and Nicholls, G. 1972. Super-resolution aperture scanning microscope. Nature 237:510–2. doi: 10.1038/237510a0
[3] ↑ Betzig, E., Harootunian, A., Lewis, A., and Isaacson, M. 1986. Near-field diffraction by a slit: implications for superresolution microscopy. Appl. Opt. 25:1890–900. doi: 10.1364/AO.25.001890
[4] ↑ Betzig, E., and Chichester, R. J. 1993. Single molecules observed by near-field scanning optical microscopy. Science 262:1422–5. doi: 10.1126/science.262.5138.1422
[5] ↑ Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., and Prasher, D. C. 1994. Green fluorescent protein as a marker for gene expression. Science 263:802–5. doi: 10.1126/science.8303295
[6] ↑ Betzig, E. 1995. Proposed method for molecular optical imaging. Opt. Lett. 20:237–9. doi: 10.1364/OL.20.000237
[7] ↑ Patterson, G., and Lippincott-Schwartz, J. 2002. A photoactivatable GFP for selective photolabeling of proteins and cells. Science 297:1873–1877. doi: 10.1126/science.1074952
[8] ↑ Shroff, H., White, H., and Betzig, E. 2013. Photoactivated localization microscopy (PALM) of adhesion complexes. Curr. Protocol. Cell Biol. 58:4–21. doi: 10.1002/0471143030.cb0421s58
[9] ↑ Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., et al. 2006. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313:1642–5. doi: 10.1126/science.1127344
[10] ↑ Liu, Z., Lavis, L. D., and Betzig, E. 2015. Imaging live-cell dynamics and structure at the single-molecule level. Mol. Cell. 58:644–59. doi: 10.1016/j.molcel.2015.02.033
[11] ↑ Li, D., Shao, L., Chen, B. C., Zhang, X., Zhang, M., Moses, B., et al. 2015. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349:aab3500. doi: 10.1126/science.aab3500
