תַקצִיר
בצעירותי רציתי להיות אסטרונאוט והייתי חובב מושבע של מדע בדיוני. תמיד נמשכתי לדמויות של גיבורים שהמציאו משהו חדש שהביא לפריצת דרך מדהימה. כשהתחלתי את הקריירה המדעית שלי, לא רציתי לעשות משהו קטן – רציתי לעשות משהו שיהיה בלתי רגיל ובעל השפעה. לכן בחרתי להתמודד עם אחת הבעיות הקשות ביותר בתחום המִיקְרוֹסְקוֹפּיָה האופטית (כלומר, מיקרוסקופים שבהם עושים שימוש באור) – רציתי למצוא דרך שתאפשר לראות עצמים קטנים מאורך הגל של האור הנראה. כך קראתי תיגר על מגבלה שבתקופה ההיא האמינו שאי אפשר להתגבר עליה. במחקר שלי פיתחתי שיטה שנקראת מיקרוסקופיית לוֹקָלִיזַצְיָה המופעלת על ידי אור (PALM). השיטה הזאת אפשרה לנו להתגבר על המגבלה שעמדה בפנינו בעזרת מולקולות מפיצות אור (פְלוּאוֹרֶסְצֶנְטִיוֹת). בעזרת שיטת PALM ושיטות אחרות המבוססות על מולקולות מפיצות אור, מדענים יכולים ללמוד יֶדע חדש על תאים חיים ועל מולקולות בודדות, ולתרום רבות לדרך שבה אנו מבינים את החיים.
פרופסור אֶרִיק בֶּצִיג זכה בפרס נובל לכימיה לשנת 2014 עם פרופסור שְטֶפָן הֶל ועם פרופסור ויליאם מוֹרְנֶר על פיתוח מִיקְרוֹסְקוֹפּיָה פְלוּאוֹרֶסְצֶנְטִית ברֶזוֹלוּצְיַת-על.
כיצד אנו יכולים לראות דברים קטנים?
כשאנו מסתכלים על עצם כלשהו, למעשה אנו מזהים את האור החוזר מהאובייקט ומגיע לעינינו. חִשבו למשל על צוללת המשתמשת בסוֹנָר. כאשר הצוללת מנווטת בים, היא שולחת גלי קול ומזהה את גלי הקול החוזרים אליה מעצמים תת-ימיים, כגון סלעים וחיות-ים (איור 1A). כך צוות הצוללת יודע לנווט מתחת למים. העיקרון זהה כשאנו רוצים לראות דברים במעבדה, כמו תאים או אורגניזמים זעירים. אנו מאירים (או מפעילים צורה אחרת של קרינה, למשל באמצעות אלקטרונים) על העצם הזעיר, ואז בוחנים את מה שחוזר מהעצם. סוג הקרינה נקבע על ידי מדד הנקרא אורך הגל. אולי אתם כבר יודעים שלגלים יש דפוס חוזר של פסגות גבוהות (שיאים) ועמקים נמוכים. אורך הגל הוא המרחק בין שתי פסגות (איור 1B).
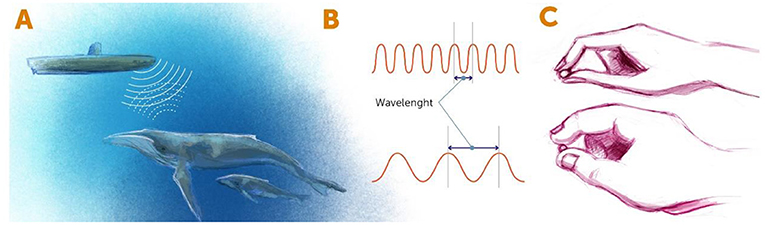
- איור 1 - זיהוי עצם באמצעות קרינה.
- (A) במערכות הסוֹנר של צוללות משתמשים בקרינה של גלי קול לזיהוי עצמים סמוכים. גלי הקול נפלטים מהצוללת, חוזרים מהעצמים ונקלטים בגלאי שבמערכת הסונר. גם כשאנו מסתכלים על חפץ, גלי אור פוגעים בו וחוזרים אל הגלאים שלנו – העיניים שלנו. (B) צורות של קרינה מתוארות לפי אורכי הגל שלהן. אורך הגל מוגדר כמרחק בין שתי פסגות סמוכות של גל הקרינה. (C) אורך גל קצר (באיור העליון) הוא כמו אצבעות דקות שעוזרות לנו ”לראות” את פרטיו הקטנים של עצם מסוים, בעוד שאורך גל ארוך (באיור התחתון) הוא כמו אצבעות עבות, שבאמצעותן אנו יכולים ”לראות” רק פרטים כלליים.
- Wavelength= אורך גל.
כשמסתכלים על עצמים זעירים, אורך הגל של האנרגיה החוזרת מהעצם קובע את הרזולוציה שבה נוכל לראות את העצם הזה. ככל שאורך הגל קצר יותר, כך העצמים שאנו יכולים לראות קטנים יותר. דמיינו אצבעות שממששות חפץ (איור 1C). אם האצבעות עבות (באנלוגיה לאורכי הגל הארוכים), איננו יכולים לחוש את הפרטים העדינים של העצם. זה כמו לנסות להשתמש באצבעות העבות הללו כדי לנסות לחוש בליטות ברוחב מילימטר. לכן, אם אנחנו רוצים לראות את הפרטים הזעירים של עצם מסוים, יש לנו שתי אפשרויות: הראשונה היא להשתמש בקרינה בעלת אורך גל קטן מאוד, כגון קרני רנטגן. הבעיה היא שחשיפה ממושכת לאנרגיה הגבוהה של אורכי גל קצרים יכולה להרוג יצורים חיים, ולכן איננו יכולים לחקור תאים חיים או אורגניזמים באמצעות אורכי גל קצרים כאלה. האפשרות השנייה היא למצוא ”תחבולה” שתאפשר לנו להשתמש באורכי גל ארוכים יותר, שהם פחות אנרגטיים, ובכל זאת איכשהו להצליח לראות מעֵבר למגבלותיהם של אורכי הגל האלה. זה הרעיון מאחורי מִיקְרוֹסְקוֹפּיָה ברֶזוֹלוּצְיַת-על. כך אנו מכנים כל שיטה של מיקרוסקופיה המאפשרת לנו לראות מעֵבר למגבלות של אורכי הגל שבהם היא משתמשת.
לפני פיתוח המיקרוסקופיה ברזולוציית-העל, יכולנו לראות יצורים חיים בגודל של כ-200 ננומטר (שהם 0.0002 מילימטר) – דוגמאות לכך הם חלקים גדולים יחסית בתוך תאים של בעלי חיים, ואפילו אורגניזמים חד־תאיים כמו חיידקים. אך לא יכולנו לראות אורגניזמים קטנים יותר כמו וירוסים, או חלקים קטנים יותר של תאים, כמו חלבונים בודדים או מולקולות קטנות אחרות (איור 2A, B). היכולת לראות יצורים חיים ברזולוציה כה גבוהה הייתה קפיצת מדרגה ענקית! היא פתחה בפנינו תחומי מחקר חדשים לגמרי, ושיפרה מאוד את האפשרות להבין את התהליכים הבסיסיים ביותר של החיים. פרטים שבעבר לא עלה בידינו לזהוֹת באמצעות טכניקות מיקרוסקופיה קונבנציונליות, נחשפו ממש לנגד עינינו. היכולת החדשה הזאת הולידה בנו ציפייה גדולה לדברים שנוכל לגלות על אודות התעלומות הגדולות של החיים (איור 3A, B).
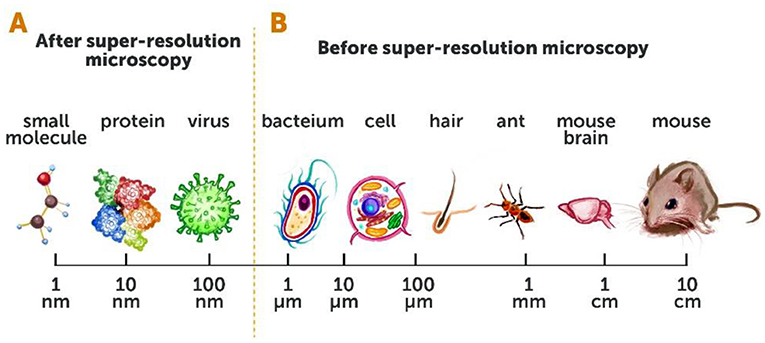
- איור 2 - מיקרוסקופיה קונבנציונלית לעומת מיקרוסקופיה ברזולוציית-על.
- (A) המיקרוסקופיה ברזולוציית-על מאפשרת לנו לראות מגוון גדול מאוד של עצמים, שגודלם מגיע אף לכ-10 ננומטר [ננומטר אחד (nm) = מיליארדית (0.000000001) המטר]. (B) לפני פיתוח המיקרוסקופיה ברזולוציית-על, יכולנו לראות רק עצמים בגודל של 200 ננומטר (בערך בגודל של חיידק) או יותר.
- Super-resolutionmicroscopy = מיקרוסקופיה ברזולוציית-על;
- After super-resolutionmicroscopy = אחרי גילוי מיקרוסקופיה ברזולוציית-על;
- Before super-resolutionmicroscopy = לפני גילוי מיקרוסקופיה ברזולוציית-על;
- nm = ננומטר;
- μm = מיקרומטר;
- cm = סנטימטר;
- Small molecule= מולקולה קטנה;
- Protein = חלבון;
- Virus = וירוס;
- Bacterium = חיידק;
- Cell = תא;
- Hair = שַׂעֲרָה;
- Ant = נמלה;
- Mouse Brain = מוח של עכבר;
- Mouse = עכבר.
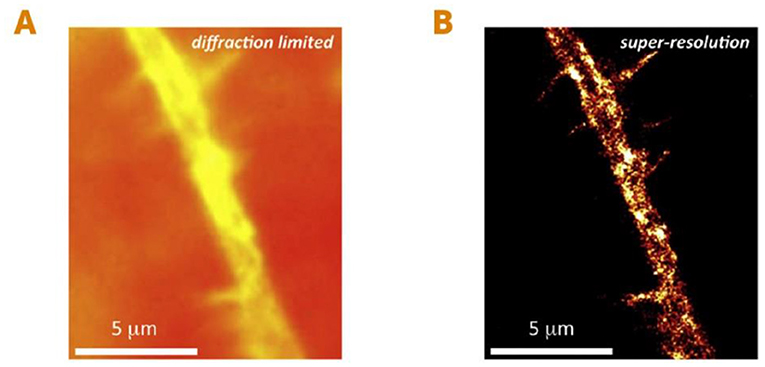
- איור 3 - מיקרוסקופיה ברזולוציית-על מאפשרת לראות חלבונים בודדים בתאים חיים.
- (A) תמונה של ענף קטן של תא-עָצָב חי שצולמה באמצעות מיקרוסקופיה רגילה. (B) אותו ענף של תא-עָצָב שצולם באמצעות מיקרוסקופיה ברזולוציית-על. שיטה זו מאפשרת לנו לראות פרטים קטנים שבעבר לא יכולנו לראות. במקרה הזה אפשר לראות תעלות יונים קטנות – אלו הם חלבונים בממברנה של תא-העָצָב (כתמים צהובים בהירים) האחראים להולכת חשמל בתאֵי-העָצָב [האיור נלקח מ-[1]]. קנה מידה: מיקרומטר (μm) אחד במפה שווה ל-1,000 ננומטר במציאות.
- Diffraction limited= [מיקרוסקופ] מוגבל-דִיפְרָקְצִיָה;
- Super-resolution= רֶזוֹלוּצְיַת-על.
ההתחלה: מיקרוסקופיה אופטית לסריקת שדה קָרוֹב
כשהתחלתי את לימודיי המתקדמים באוניברסיטה ב-1983, לשניים מהמנחים שלי, פרופסור Mike Isaacson ופרופסור Aaron Lewis, היה רעיון מטורף – לנסות לפרוץ את מה שנקרא גבול הדִיפְרָקְצִיָה של אַבֶּה(Abbe). המשמעות של העיקרון הזה היא שהדבר הקטן ביותר שאנו יכולים לראות באמצעות גלי אור חייב להיות בגודל של מחצית מאורך הגל של האור הזה, לפחות. לדוגמה, אם אורך הגל הוא 1 מ”מ, נוכל לראות עצמים שאורכם לפחות 0.5 מ”מ. המנחים שלי חשבו שהם יכולים לפרוץ את הגבול הזה על ידי הפעלת מניפולציה מסוימת על האור. הרעיון שלהם התבסס על ההדגמה הראשונה של פריצת גבול הדִיפְרָקְצִיָה של אַבֶּה שבוצעה כבר ב-1972 [2]. הרעיון הבסיסי היה לקדוח חור זעיר, קטן בהרבה מאורך הגל של האור, בלוחית שחורה קטנה. כאשר מניחים את הלוחית קרוב מאוד לעצם הנבדק, ואור עובר דרך החור, הוא מאיר נקודה זעירה בעצם כלשהו – קטנה בהרבה מאורך הגל של האור. לאחר מכן ”סורקים” את העצם על ידי הזזת הלוחית המוארת על פני העצם, נקודה אחר נקודה. באמצעות התכסיס הזה, אנו יכולים לראות את העצם ברזולוציה גבוהה יותר מהרזולוציה ה”טבעית” של האור הנכנס. כיום שיטה זו נקראת מיקרוסקופיה אוֹפְּטִית לסריקת שדה קרוֹב [3, 4].
זאת הייתה השיטה הראשונה שעבדתי עליה בתחום המיקרוסקופיה ברזולוציית-על. הבעיה העיקרית בשיטה זו היא שהאור שעובר דרך החור הקטן מתפשט מהר מאוד בצד השני. כדי לקבל רזולוציה גבוהה, עלינו לעבוד קרוב מאוד לעצם שאנו מדמים. זהו אתגר משמעותי במקרה של תאים, כיוון שהַתָאים אינם שטוחים, ולכן קשה לשלוט בלוחית שעליהם. לאחר שעבדתי על השיטה הזו במשך כמה שנים וחשבתי שאיני יכול להתקדם יותר, החלטתי לסיים את העבודה הזו, ולפרוש לגמרי מהמדע. לא ידעתי שכמה שנים מאוחר יותר, פריצת דרך גדולה בתחום הביוכימיה תגרום לי לחזור בריצה למדע ולתחום המיקרוסקופיה.
מִיקְרוֹסְקוֹפּיָה פְלוּאוֹרֶסְצֶנְטִית ברזולוציית-על
בשנת 1994 פורסם מחקר חלוצי [5] המראֶה שבאמצעות הנדסה גנטית אנו יכולים לחבֵּר מִקְטַע שמפיץ אור, או ”סַמָּן”, הנקרא חלבון פְלוּאוֹרֶסְצֶנְטִי, לכל חלבון בתאים חיים. זהו חלבון מיוחד שזוהר כאשר מאירים עליו אור באורך גל מסוים. מייד הבנתי שהמחקר הזה יכול לגרום למהפכה אמיתית בתחום המיקרוסקופיה, כיוון שהוא יכול לסייע לנו לראות מִבְנים זעירים בתוך התאים. ב-1995, שנה לאחר מכן, פרסמתי מאמר שהניח את היסודות לשיטה חדשה של מיקרוסקופיה [6]. עם זאת, רק בתחילת שנות ה-2000 התרחשה התקדמות נוספת בתחום המולקולות הפלואורסצנטיות שאפשרה לי לממֵש את הרעיון שלי. הפיתוח החדש אִפשר ליצור מולקולות שלא פלטו אור כל הזמן, אלא שהן ”הופעלו” כאשר מאירים אותן באור באורך גל מסוים [7]. משמעות הדבר הייתה שיכולנו לחבֵּר סַמנים זוהרים לחלבונים מסוימים בתוך תאים חיים, ולהפעיל אותם כרצוננו כדי לחקור מבְנים ותהליכים בתוך התא. כך נולדה שיטת המיקרוסקופיה הפלואורסצנטית ברזולוציית-על שעזרתי לפתח, שנקראה במקור מיקרוסקופיית לוֹקָלִיזַצְיָה המופעלת על ידי אור (PALM, photoactivated localization microscopy) [8, 9]. בשנת 2014 קיבלתי פרס נובל בכימיה על פיתוח שיטה זו.
אספר לכם על העיקרון שמאחורי PALM: כל תא מכיל כ-20,000 סוגים שונים של חלבונים, ולעיתים קרובות אלפים רבים מכל סוג. אנו רוצים להבין איך הם פועלים יחד. כשמסתכלים על החלבונים האלה בתא באמצעות מיקרוסקופ רגיל, כמו שיש לכם בשיעורי ביולוגיה בבית הספר, אפשר לראות רק כתם גדול וזוהר. החלבונים כה קרובים זה לזה, שאי אפשר להבדיל ביניהם. ב-PALM אנו מצמידים לחלבונים סַמנים פלואורסצנטיים מיוחדים שמופעלים באמצעות לייזר בעל עוצמה נמוכה (אור סגול) (איור 4, שלב 1). כאשר מאירים עליהם באור אחר (אור כחול) בעל עוצמה גבוהה יותר, הם זוהרים, וכך מזהים את הַתָאים שרוצים לחקור (איור 4, שלב 2).
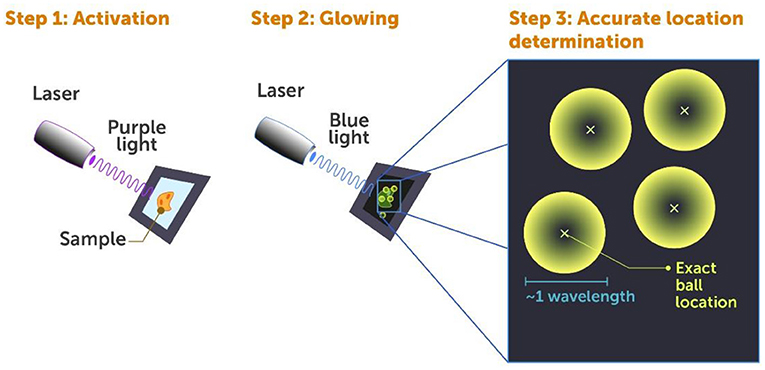
- איור 4 - מיקרוסקופיית לוֹקָלִיזַצְיָה המופעלת באור (PALM).
- מִיקְרוֹסְקוֹפּיָה ברזולוציית-על של תאים עם סַמנים פְלוּאוֹרֶסְצֶנְטִיים בשיטת PALM כוללת שלושה שלבים: שלב 1: מכַוונים על התא קרן לייזר של אור סגול חלש, ומפעילים אותה בפעימות קצרות. כך מאתחלים את הסַמנים הפלורסנטיים רק בכמה חלבונים. החלבונים שאתחלנו מוכנים להפיץ אור. שלב 2: מאירים על התא באמצעות קרן לייזר כחולה, שגורמת לחלבונים המופעלים לזרוח. כך נוכל לזהותם. שלב 3: כאשר הם זורחים, כל חלבון פלואורסצנטי בודד מייצר ”כדור אור”. המחשב מסמן X קטן במרכזו של כל כדור אור, וכך רואים מהו מקומו של כל חלבון.
- Activation= הפעלה;
- Laser = לייזר;
- Sample = דגימה;
- Glowing= הפצת אור;
- Accurate locationdetermination = קביעת מיקום מדויק;
- Wavelength = אורך גל;
- Exact ball location = מיקום מדויק של הכדור.
אם היינו מפעילים את כל הסַמנים בבת אחת, כולם היו זוהרים בו־זמנית, ולא היינו מסוגלים לראות תאים בודדים – אלא היינו רואים כתם זוהר גדול. מִסיבה זו אנו משתמשים בפעימות של אור סגול באנרגיה נמוכה מאוד כדי לאתחל את הסַמנים – רק כמה מהם מופעלים בכל פעימה. אותם החלבונים המעטים מופעלים באופן אקראי, וסביר להניח שהם לא יהיו קרובים מִדַי אחד לשני בתוך התא. אז כשאנו משתמשים באור כחול כדי לזהוֹת את הסַמנים המופעלים הללו, הם נראים כמו כדורי אור קטנים (איור 4, שלב 2) שגודלם הוא אורך גל אחד פחות או יותר, כיוַון שזה הגודל הקטן ביותר שיכול להופיע במיקרוסקופ מוגבל-דִיפְרָקְצִיָה, שבו אנו משתמשים כדי להסתכל עליהם (איור 4, שלב 3).
תוכנת מחשב מעבדת את התמונה שאנו מקבלים מהמיקרוסקופ כדי לאתֵר בדיוק רב את מרכזו של כל אחד מה”כדורים” הללו. אפשר דמיין כדורסל שלצורתו העגולה יש קוטר מסוים. אנו יכולים להצביע על מרכז הכדורסל בדיוק הרבה יותר גבוה משאנו יכולים להעריך את הקוטר שלו, גם אם איננו רואים ישירות את המרכז. הדבר נכון גם לגבי הכדורים המולקולריים האלה – אנו יכולים לדייק מאוד במציאת המרכזים שלהם, שהם קרובים מאוד לגודלם האמיתי לעומת גודלם של כדורי האור שאנו רואים. זה אומר שבכל פעם שאנו מאירים על הַתָאים בפעימות, נוכל למצוא את מיקומם של כמה חלבונים בודדים בתוך התא (איור 4, שלב 3). הפלואורסצנטיוּת של החלבונים הללו נכבית באופן טבעית, ואז אנו יכולים להאיר קבוצה נוספת של חלבונים ולמצוא את מיקומם. בדרך כלל נדרשים עשרות אלפי סבבים של הפעלה כדי למפות תא שלם. עם זאת, המאמץ כדאי כי אנחנו מקבלים תמונה ברזולוציה גבוהה מאוד של התא, או של כל עצם אחר שאנו חוקרים (ראו איור 3B ותמונות ב-[9]).
מִיקְרוֹסְקוֹפּיָה ברזולוציית-על: אתגרים ופוטנציאל
כפי שראיתם ה-PALM הוא די פשוט – כל מה שצריך זה לייזר כדי להאיר על העצם, מצלמה ותוכנה פשוטה יחסית כדי למצוא את מרכזי החלבונים הזוהרים. מדובר בציוד זול ופשוט. למעשה, חברי, פרופ’ Harald Hess, ואני בנינו בסלון שלו את הדגם הראשון של PALM עם ציוד שקנינו מכספנו כששנינו היינו מובטלים! החלק הקשה בתהליך החקר הוא העבודה עם הדגימה הביולוגית. ישנם אתגרים רבים, ביניהם הכנת תאים חיים לניסויים; הסיכוי שהַתָאים יינזקו כשהם נחשפים לאור; והבנת הדרך הטובה ביותר לזהוֹת ולנתח את האור הנפלט מהמולקולות שמעניינות אותנו.
כשהכנו את הַתאים, גילינו שרבים מהסַמנים המופעלים על ידי אור אינם נצמדים בהכרח לחלבונים שאנו רוצים לראות, אלא לעצמים אחרים שבמקרה נמצאים בקרבת מקום. זה אומר שלעיתים קרובות הסַמנים שבהם אנו משתמשים אינם מצביעים על מיקומֵי החלבונים שמעניינים אותנו. בנוסף לכך, גם אם אנו מצליחים לסמֵן את החלבונים הנכונים, אנו מסמנים רק אחוז קטן מהם, ולעיתים קרובות אין זה מספיק כדי להציג לנו תמונה מלאה של התא ברזולוציה הגבוהה ביותר האפשרית. לבסוף, אפילו אם אנו מצליחים לסמֵן מספיק מהחלבונים הנכונים, תאים לא ”אוהבים” שמקרינים עליהם אור חזק, והם ניזוקים. עם זאת, ככל שאנו מאירים על התאים באור חזק יותר, כך באפשרותנו לקבל יותר מידע, ולכן עלינו למצוא תמיד את האיזון העדין בין איסוף מידע רב ככל היותר, לבין הימנעות מנזק לתאים.
האתגר האחרון שעלינו להתמודד איתו ושברצוני לספר לכם עליו הוא תופעה שנקראת הָלְבָּנַת הפְלוּאוֹרֶסְצֶנְטִיוּת. משמעות התופעה היא שסַמָּן זורח רק מספר מסוים של פעמים. במילים אחרות, סַמן מסוים יכול לפלוט כמות מוגבלת של אור לפני שהוא נהרס או נכבה לצמיתות. לפעמים כמות האור הזו אינה מספיקה כדי לחלץ את המידע הדרוש לנו למציאת המיקום המדויק שלו.
כפי שציינתי קודם, המיקרוסקופ הפלואורסצנטי בעל רזולוציית-העל הוא ייחודי, כיוַון שהוא מאפשר לנו לצלם תאים ואורגניזמים חיים. באמצעות טכניקה זו איננו מסתפקים בתיאור המבנה של דברים חיים – ביכולתנו גם לעקוב לאורך זמן אחר תהליכים המתרחשים בתוך תא, כגון תנועת חלבונים (סרטון לצפייה) [10, 11]. באמצעות טכניקה בשם ”מעֲקב אחר מולקולה בודדת”, יש באפשרותנו לצלול אל תוך התעלומות הגדולות ביותר שהַתָאים צופנים בחובם, ולהיות עדים לתהליכים הבסיסיים ביותר של החיים. לדוגמה, מעֲקב אחר מולקולה בודדת עזר לנו להבין כיצד נוצרים עותקי רנ”א (RNA) מדנ”א בתוך גרעין התא – תהליך הנקרא שִׁעְתּוּק.
מעֲקב אחר מולקולות בודדות והבנת תנועתן בתאים עשויים להיות חשובים מאוד לפיתוח תרופות חדשות. המידע שאנו יכולים לאסוף על מנגנונים תאיים שבעָבר לא יכולנו לראות, עשוי לדעתי להוביל לפרדיגמה חדשה לגמרי של גילוי תרופות וטיפולים חדשים וחשובים למחלות שונות, כמו אלצהיימר ופרקינסון. לדעתי זאת תהיה התועלת הגדולה ביותר שלנו ממיקרוסקופיה ברזולוציית-על, וזו הסיבה שעמיתיי ואני הקמנו חברה לגילוי תרופות בשם Therapeutics Eikon ©.
המלצות למוחות צעירים
כפי שציינתי קודם, כשהייתי ילד שאבתי השראה מגיבורי פנטזיה ומאסטרונאוטים. הם ייצגו את הסיכוי להשפיע על העולם, ולשפר מאוד את חייהם של אנשים. עבורי זו המטרה הגבוהה ביותר שאנו יכולים להציב לעצמנו בחיים. לכן, זאת המלצתי – לא משנה באיזו קריירה תבחרו – עשו משהו בעל השפעה, כך שתהיה לעשייה שלכם תרומה משמעותית. זה לא חייב להיות דבר גדול – גם גידול ילדים משפיע וגם אריזת מצרכים תורמת לסביבה. נסו למצוא שילוב טוב בין תחומי העניין שלכם, לבין הפוטנציאל להשפיע לטובה על האנשים שסביבכם, ואפילו על החֶברה כולה (איור 5). אם אתם בוחרים לעסוק במדע, אל תתקבעו על הרצון להיות פרופסורים. זו אינה צריכה להיות מטרה בפני עצמה, שכן ישנן עוד דרכים רבות לתרום תרומות משמעותיות ולגלות תגליות גדולות מאוד, גם אם לא עובדים באוניברסיטה.

- איור 5 - המלצות למוחות צעירים.
- כשאתם בונים את עתידכם, נסו לעשות משהו שאתם אוהבים שיכולה להיות לו גם תרומה משמעותית לחברה.
באופן אישי, בעיניי יש יתרונות רבים למחקר מהסוג שאני עושה. ראשית, אני המנהל של עצמי. זה מוצא חן בעיניי, כי אני מעדיף להחליט בעצמי, במְקום שאחרים יגידו לי מה לעשות. שנית, בסוג המדע שבו אני עוסק, אני מנסה להמציא כלים חדשים לאנשים שמנסים לענות על שאלות מדעיות שאיני מומחה בהן. זה אומר שעליי ללמוד הרבה נושאים חדשים ולהפוך לאיש אשכולות. יש לי ידע מועט על דברים רבים בתחומים רבים – שימוש בחומרים מיטביים לבניית מכונות שונות, ביולוגיה, פיזיקה, תכנון כלי מחקר חדשים ועוד. הידע הרחב הזה גולש לתוך לחיי היום-יום שלי, וכעת אני מבין דברים שאני רואה סביבי ונהנה מהיופי ומהמורכבות שאני מזהה בעולם היום-יומי שלי.
לסיום, ברצוני לדבר על הגישה בה בוחרים לעשות דברים. ראשית, הַפעילו חשיבה ביקורתית בכל סוגיה שעומדת בפניכם. אל תסתפקו בחשיבה שטחית ואוטומטית – נסו לראות לעומקם של הדברים שאתם פוגשים בדרככם. שנית, אל תפחדו להסתכן. לדעתי, כיום החֶברה מפחדת מִדַי מסיכונים, –ולכן אנחנו נמנעים מהתחדשות והתקדמות – הן כיחידים והן כחֶברה. לבסוף – חשוּב לעבוד קשה! לא משנה מה תעשו, בכל גיל, נסו לדרבן את עצמכם – ותיהנו מהתהליך. אם יש נושאים שמאתגרים אתכם, אַל תלקו את עצמכם, אלא עשו ככל שביכולתכם כדי להשיג את שאיפותיכם. אם אינכם מצטיינים בתחום מסוים, זִכרו כי כל אחת ואחד מאיתנו טובים בדברים שונים – אף אחד אינו מושלם בכל התחומים. עם זאת, עודדו את עצמכם בכל מה שאתם עושים – באמצעות עבודה קשה אפשר להשיג הכול. מִצאו את הדבר שאתם אוהבים לעשות, עִבדו קשה, ותהיו טובים במה שאתם עושים. אז, הציבו לכם מטרה, נצלו היטב את יכולותיכם, וגם – תיהנו מהדרך.
מילון מונחים
קרינה (Radiation): ↑ אנרגיה בצוּרַת גלים או בצוּרַת חלקיקים הנפלטת ממקור כלשהו.
אורך גל (Wavelength): ↑ מידת המרחק בין שתי פסגות סמוכות של גל.
מִיקְרוֹסְקוֹפּיָה ברֶזוֹלוּצְיַת-על (Super-resolution Microscopy): ↑ כל שיטה של מיקרוסקופיה המאפשרת לנו להתגבר על מגבלות אורכי הגל שבהם היא משתמשת, שמטרתה לראות עצמים ברזולוציה גבוהה יותר.
גבול הדִיפְרָקְצִיָה של אַבֶּה (Abbe’s Diffraction Limit): ↑ הגבול הפיזיקלי של מיקרוסקופ האור, לפיו אנו יכולים להבחין בין שתי נקודות בעצם רק אם המרחק ביניהן אינו קטן ממחצית אורך הגל של אור ההדמיה.
מיקרוסקופיה אוֹפְּטִית לסריקת שדה קָרוֹב (Near-field Scanning Optical Microscopy): ↑ שיטת המיקרוסקופיה הראשונה ברזולוציית-על. השיטה פותחה בשנות ה-80 של המאה ה-20.
מיקרוסקופיית לוֹקָלִיזַצְיָה המופעלת על ידי אור (PALM, Photoactivated Localization Microscopy): ↑ שיטת המיקרוסקופיה ברזולוציית-על שפיתח פרופסור אריק בציג, שבה משתמשים במולקולות פלואורסצנטיות כדי לשבור את גבול הדיפרקציה של אַבֶּה.
הָלְבָּנַת הפְלוּאוֹרֶסְצֶנְטִיוּת (Photobleaching): ↑ תופעה שבה חומרים פלואורסצנטיים אינם יכולים להפיץ יותר אור, לאחר שהפיצו אור כמה פעמים.
הצהרת ניגוד אינטרסים
המחברים מצהירים כל המחקר נערך בהעדר כי קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
ברצוני להודות לנועה שגב על עריכת הריאיון שהיווה את הבסיס למאמר זה, ועל כתיבה משותפת של המאמר. תודה לאלכס ברנשטיין עבור האיורים.
הצהרת כלי בינה מלאכותית
טקסט חלופי הנלווה לאיורים במאמר זה נוצר על ידי פרונטירז בסיוע כלי בינה מלאכותית, ונעשו מאמרצים על מנת להבטיח את דיוקו, כולל בדיקה על ידי כותבי המאמר כאשר הדבר התאפשר. אם ברצונכם לדווח על בעיה, אנו צרו איתנו קשר.
מקורות
[1] ↑ Ondrus, A. E., Hsiao-lu, D. L., Iwanaga, S., Parsons, W. H., Andresen, B. M., Moerner, W. E., et al. 2012. Fluorescent saxitoxins for live cell imaging of single voltage-gated sodium ion channels beyond the optical diffraction limit. Chem. Biol. 19:902–12. doi: 10.1016/j.chembiol.2012.05.021
[2] ↑ Ash, E. A., and Nicholls, G. 1972. Super-resolution aperture scanning microscope. Nature 237:510–2. doi: 10.1038/237510a0
[3] ↑ Betzig, E., Harootunian, A., Lewis, A., and Isaacson, M. 1986. Near-field diffraction by a slit: implications for superresolution microscopy. Appl. Opt. 25:1890–900. doi: 10.1364/AO.25.001890
[4] ↑ Betzig, E., and Chichester, R. J. 1993. Single molecules observed by near-field scanning optical microscopy. Science 262:1422–5. doi: 10.1126/science.262.5138.1422
[5] ↑ Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., and Prasher, D. C. 1994. Green fluorescent protein as a marker for gene expression. Science 263:802–5. doi: 10.1126/science.8303295
[6] ↑ Betzig, E. 1995. Proposed method for molecular optical imaging. Opt. Lett. 20:237–9. doi: 10.1364/OL.20.000237
[7] ↑ Patterson, G., and Lippincott-Schwartz, J. 2002. A photoactivatable GFP for selective photolabeling of proteins and cells. Science 297:1873–1877. doi: 10.1126/science.1074952
[8] ↑ Shroff, H., White, H., and Betzig, E. 2013. Photoactivated localization microscopy (PALM) of adhesion complexes. Curr. Protocol. Cell Biol. 58:4–21. doi: 10.1002/0471143030.cb0421s58
[9] ↑ Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., et al. 2006. Imaging intracellular fluorescent proteins at nanometer resolution. Science 313:1642–5. doi: 10.1126/science.1127344
[10] ↑ Liu, Z., Lavis, L. D., and Betzig, E. 2015. Imaging live-cell dynamics and structure at the single-molecule level. Mol. Cell. 58:644–59. doi: 10.1016/j.molcel.2015.02.033
[11] ↑ Li, D., Shao, L., Chen, B. C., Zhang, X., Zhang, M., Moses, B., et al. 2015. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science 349:aab3500. doi: 10.1126/science.aab3500
