תַקצִיר
מדענים וחוקרים מנסים לזהות ולפתח דרכים חדשות וטובות יותר לאבחן פגיעות מוחיות, מאחר שפגיעות מוחיות הן קשות לזיהוי. אפילו כשידוע שהמוח פגוע, עדיין קשה לטפל בו. זה מצער מאחר שפגיעה מוחית טראומטית (TBI) היא הלקות המוחית השכיחה ביותר אצל ילדים. אחת הדרכים לאתר TBI היא באמצעות הסתכלות על סַמָּנִים ביולוגיים בדם. סמנים ביולוגיים, מרמת החלבון ועד לדנ“א, מסייעים למדענים לקבוע אם חלק מסוים בגוף נפגע. פגיעות שונות מייצרות סמנים ביולוגיים שונים, מה שמספק לנו מידע על חומרת הפגיעה; וסמנים ביולוגיים אחרים מספקים לנו רמזים על מיקום הפגיעה. מדענים מקווים להשתמש בסמנים הביולוגיים האלה בדם כדי לדעת מה הסיכויים של ילדים עם TBI לחווֹת השלכה שלילית, וחשוב מכך – כיצד רופאים יכולים לטפל טוב יותר בילדים עם פגיעות כאלה.
מהי פגיעה מוחית טראומטית (TBI)?
פגיעה מוחית טראומטית (TBI – traumatic brain injury) היא אחת הלקויות המוחיות השכיחות ביותר אצל ילדים. TBI מתרחשת לעיתים קרובות כתוצאה ממכה חזקה בראש שיכולה לנבוע מהיפגעות על ידי אובייקט מסוים; ריצה אל תוך אובייקט או נפילה על הראש. TBI יכולה להיות מסוכנת מאוד מאחר שהיא יכולה לפגוע במוח באופן קשה, שהוא קריטי לשליטה על הגוף ועל האישיוּת, כמו גם על דיבור, תנועה ודברים רבים נוספים. כתלות באיזה חלק במוח נפגע, עשויות להיות לכך השלכות רציניות. לכן, חשוב להיות מסוגלים לאבחן TBI ברגע שהיא מתרחשת.
כיצד אנו חוקרים את המוח כיום ומהן המגבלות של השיטות האלה?
כאשר המוח ניזוק ההשלכות של הפגיעה יכולות להיות חמורות מאוד. אולם חקירת המוח היא קשה מאחר שהמוח סגור בתוך הגולגולת. לכן, קשה לומר אם ישנה פגיעה ומה מידת החומרה שלה. כיום, הדרך השכיחה ביותר להסתכל לתוך המוח היא באמצעות תהליך שנקרא דימוּת, כאשר ישנם כמה סוגי דימות שמספקים לנו תובנות שונות על המוח. חשבו על סוגים שונים של אפשרויות שיש במצלמה. תמונת פנורמה מספקת לכם מבט רחב על מה שמתרחש. בזמנים אחרים אתם מצלמים סרט וידיאו כך שאתם יכולים לתעד אירוע בזמן אמת. באופן דומה, שיטות דימות שונות מספקות לנו מידע שונה על פגיעות מוחיות. שני סוגי הדימות השכיחים ביותר שמשתמשים בהם אצל מטופלים מוצגים באיור 1.
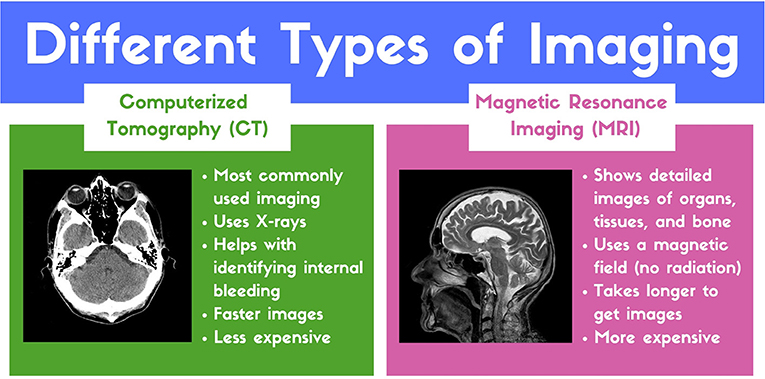
- איור 1 - שתי שיטות הדימות השכיחות ביותר עבור מטופלים עם TBI.
- צילום CT: https://www.flickr.com/photos/ciscel/124548696/ צילום MRI: https://pixabay.com/en/mri-magnetic-x-ray-skull-head-782459/
אף על פי שכיום דימות הוא השיטה השכיחה ביותר לאבחון TBI, ישנן כמה בעיות עם השיטות האלה. ראשית, התמונות לעיתים קרובות לא מצליחות לאתר בעיות במוח לאחר פגיעה. יתרה מזו, תרופות, רמות סוכרים בדם או אפילו שינויים במצב הרגשי של מטופל יכולים להשפיע על פעילות מוחית. זה עשוי להוביל לקריאה בלתי מדויקת שנראית כמו פגיעה מוחית, מה שעלול להוביל למסקנות מוטעות. הדבר חשוב, בהינתן החיסרון השני: העובדה שדימות הוא יקר מאוד! המחיר הממוצע לביצוע סריקות יכול להיות כמה אלפי דולרים! מסיבה זו חשוב לבתי חולים למזער את מספר הסריקות שלא מראות פגיעות, שלעיתים מתייחסים אליהן כסריקות עם תוצאות שליליות. נוסף על כך מאחר שמרבית השיטות האלה מצלמות באופן עקרוני תמונות של המוח בזמן נתון, קשה לראות כיצד פגיעה מתפתחת, משתפרת או מחמירה במהלך הזמן בלי לבצע סריקות נוספות ולשלם עוד כסף [1]. וכמובן, בחלק מסוגי הדימות כמו סריקות CT וסריקות PET עושים שימוש בקרינה או בחומרים רדיואקטיביים כדי להסתכל לתוך המוח, וקרינה מקושרת לסיכון מוגבר לחלות בסרטן.
מדוע כדאי להשתמש בדם כדי לחקור את המוח?
אם כן, מדוע מדענים מסתכלים על הדם כדרך לחקור פגיעות מוחיות? הסיבה הראשונה היא שֶׁקַּל לקחת דם ממטופלים באמצעות עירוי או באמצעות הוצאת דם רגילה דרך וריד ביד. מאחר שהמטופלים באופן טיפוסי מבצעים בדיקת דם במטרה לבחון את הרמות של מולקולות שונות בגוף כמו למשל גלוקוז או ברזל, בדיקת דם היא דרך קלה לחפש סמנים אחרים בדם שעשויים לספר לנו יותר על הפגיעה המוחית. שנית, לקיחת דם היא תהליך עם סיכון נמוך, כשהסיכונים העיקריים הם חבלה, כאב או זיהום. לבסוף, לקיחת דם היא שיטה לא יקרה לאבחונים ומחקרים מדעיים! בהשוואה לאלפי הדולרים שמבוזבזים על בדיקות דימות יקרות, בדיקות דם הן דרך ברת-השגה יותר למבדקי אבחון, גם לבתי החולים וגם למטופלים.
מה אנו יכולים למדוד בדם?
סמן ביולוגי הוא מולקולה שאפשר לנתח אותה ולגלות מידע שנוגע לתהליכים ביולוגיים המתרחשים בגוף [2]. לדוגמה, רמת הגלוקוז בדם שלכם היא סמן ביולוגי שאומר לרופאים אם אתם נמצאים בסיכון לחלות בסכרת. מאחר שאבחון TBI מהיר מספּק למטופלים סיכויי החלמה טובים יותר, גילוי סמנים ביולוגיים שאפשר להשתמש בהם כדי לאבחן TBI במהירות יכול לסייע מאוד. שלושת הסוגים הפוטנציאליים של סמנים ביולוגיים שנחקרים לאבחון TBI הם חלבונים, דנ”א/רנ“א ואקסוזומים (איור 2).
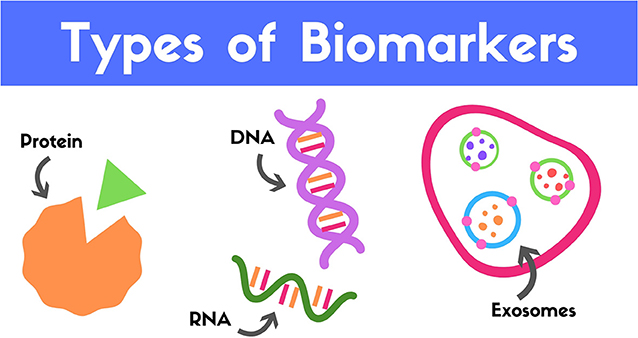
- איור 2 - סמנים ביולוגיים שמשתמשים בהם לזיהוי TBI.
חומצה דאוקסיריבונוקלאית (דנ”א) היא חומר גנטי שאומר לכל אחד מהתאים שלנו כיצד לייצר את כל החלבונים שהוא זקוק להם. כאשר התאים מייצרים חלבונים הם משתמשים בדנ“א ראשית כדי לייצר חומצה ריבונוקלאית (רנ”א). גם הדנ“א וגם הרנ”א יכולים לשמש כסמנים ביולוגיים, כמו גם החלבונים שהם מקודדים. אקסוזום הוא למעשה בועה (מוצג בכחול ובירוק באיור) שמאוחסנת בתוך התא יחד עם אקסוזומים אחרים, במבנה גדול יותר שנקרא גופיף מולטיווסיקולרי (Multivesucular body) (מוצג בוורוד). כל גופיף מכיל כמה חלבונים, רנ“א ומולקולות אחרות (כפי שמוצג בכתום, באדום ובסגול) שיכולים להיות משוחררים אל מחוץ לתא, לעיתים קרובות כצורת תקשורת בין תא לתא.
סמנים ביולוגיים חלבוניים הם בין הסמנים הנחקרים ביותר [3]. בעקבות TBI, רמותיהם של חלבונים מסוימים יכולות לעלות או לרדת, כתוצאה משינויים שמתרחשים בתוך תאי המוח שנפגעו. מדענים יכולים למדוד את הרמות של החלבונים המסוימים האלה בדמו של אדם, ברוק, בשתן או בכל נוזל גוף אחר. רמות אבנורמליות של החלבונים האלה יכולות לספר לנו אם למטופל יש TBI ומהו צפי ההחלמה שלו. למרות התקדמויות בתחום, חוקרים עדיין מחפשים את החלבון שיהווה סמן ביולוגי אידיאלי עבור TBI. מאחר שמרבית החלבונים שהם סמנים ביולוגיים מיוצרים על-ידי תאים אחרים בנוסף לתאים במוח, קשה להשתמש בסמנים האלה כמצביעים באופן חד משמעי על פגיעה מוחית. מחצית החיים השונה של חלבונים גם גורמת לכך שקשה למדוד את הרמות של חלבון מסוים באופן אמין. מחצית החיים מתייחסת לכמות הזמן שלוקח לרמה של חלבון לרדת ב-50%. חלק מהחלבונים מתפרקים מהר בדם, מה שמקשה על השימוש בהם במחקרים של סמנים ביולוגיים.
דנ”א ורנ“א הם סוגים אחרים של סמנים ביולוגיים שנחקרים. דנ”א הוא מולקולה שמרכיבה את התרשים הגנטי שלנו, והיא משמשת לייצור של רנ“א, שבתורו משמש ליצירת חלבונים. העובדה שדנ”א, רנ“א וחלבונים קשורים כולם משמעותה ששלושתם הם סמנים ביולוגיים פונטציאליים שיכולים לומר לנו דברים מעט שונים. לדוגמה, נזק למוח יכול להגביר את ייצורם של חלבונים מסוימים, כולל חלבון שנקרא קלצינורין. באופן מעניין, לחלק מהאנשים ישנן גרסאות מעט שונות של גֶּן קלצינורין שמקושרות לתוצאות פחות טובות בעקבות TBI [4]. אם נצליח להבין אלה גרסאות גֶּנים מקושרות עם שיקום מ-TBI, אולי נגלה שיטות חדשות לאבחון פגיעות כאלה ולטיפול בהן.
בעוד שדנ”א וחלבונים הם סמנים ביולוגיים פוטנציאליים מבטיחים, איננו יכולים להיות בטוחים לגמרי אם הם מגיעים מהמוח או לא, מאחר שכל התאים שלנו מכילים דנ“א. חוסר הוודאות הזה הוביל מדענים להשתמש במשהו שנקרא אקסוזומים כסמנים ביולוגיים. אקסוזומים הם סוג של מבנה שנקרא בועיות חוץ-תאיות, שהוא נושא מחקר ”חם“ כיום [5]. אקסוזומים מאוחסנים בתוך התאים בקבוצות שנקראות גופים מולטיווסיקולרים (Multivesicular bodies), שהם כמו בועות שמתערבבות עם ממברנת הפלזמה ומשחררות את התכנים (האקסוזומים) אל מחוץ לתא (איור 3). חשבו על ממברנת פלזמה כדופן של בלון. מאחר שלכל תא יש את הסמנים החלבוניים היחודיים שלו, כאשר הגופים המולטיווסיקולרים מתערבבים עם ממברנת הפלזמה, האקסוזומים אוספים את הסמנים האלה מממברנת התא. כתוצאה מכך, הסמנים האלה אומרים לנו מאיזה סוג תא הגיעו הגופים המולטיווסיקולרים ומה מתרחש בתוך התא. ב-TBI הסמנים שנוכחים באקסוזומים עשויים לסייע לנו להבין מה מתרחש במוח אחרי פגיעה מוחית.
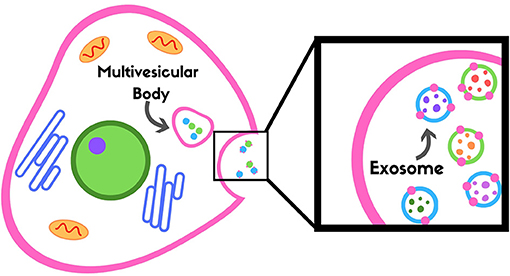
- איור 3 - אקסוזומים מאוחסנים בגופים מולטיווסיקולרים (Multivesicular bodies) ומשוחררים אל מחוץ לתא ולתוך הדם.
אקסוזומים יכולים להראות לנו מה מתרחש בסוג תא מסוים מאחר שכשהם משוחררים הם אוספים חתיכות מהממברנה של אותו התא (שמוצגות כנקודות ורודות על צדם החיצוני של אקסוזומים כחולים וירוקים בתיבה השחורה מצד ימין באיור, אשר שוחררו מתוך התא).
דוגמאות לסמנים ביולוגיים שמשמשים לאיתור TBI
חוקרים ממשיכים לחקור סמנים ביולוגיים רבים במטרה לראות אלה מהם עשויים להיות טובים לאבחון TBI. כאן נציג רק מעט מהסמנים הביולוגיים הפוטנציאליים ל-TBI ומה הם עשויים לומר לנו על פגיעה מוחית.
GFAP הוא סמן ביולוגי חלבוני שנמצא רק בתאים במוח ובעמוד השדרה. זהו חלבון מבני, כלומר הוא מסייע לתאים לשמור על הצורה שלהם. אחרי פגיעה מוחית, GFAP משוחרר מתאים שניזוקו ונכנס לתוך הדם, שם הוא ניתן למדידה בדוגמיות דם. GFAP גדל בדם מעט אחרי TBI וקטן בהדרגה במשך הזמן. GFAP עשוי לסייע בקביעת מידת השיקום של מטופלים מ-TBI לאורך הזמן [6].
סמן ביולוגי חלבוני אחר שמראה פוטנציאל הוא קבוצת חלבונים שנקראת ציטוקינים. ציטוקינים משוחררים על-ידי מערכת החיסון אחרי פגיעה מוחית. שני ציטוקינים שנראים מבטיחים במחקר TBI נקראים IL-10 ו-IL-6. מחקר אחד מצא שלמטופלים שאינם משתקמים טוב אחרי TBI היו רמות IL-10 גבוהות פי שלושה מאשר מטופלים שהשתקמו טוב [7]. IL-6 נראה מועיל מיד אחרי TBI, אולם אם רמות ה-IL-6 נשארות גבוהות במשך זמן רב מדי, הן יכולות למעשה לפגום בהשתקמות המטופל [8]. מחקר נוסף עם IL-6 עשוי לאפשר לנו לעקוב אחרי טיב ההשתקמות של המטופל אחרי TBI.
מחקרים שהשתמשו בדנ”א וברנ“א כסמנים ביולוגיים הראו לנו שווריאציות בגנים מסוימים, כמו אחד שנקרא PPP3CC, עשויות לנבא כמה טוב המטופל ישתקם מ-TBI [4]. זה יכול להיות מבטיח מאחר שדנ”א נגיש בקלות באמצעות הדם או הרוק. כיום, מדענים חוקרים דרכים חדשות להשתמש באקסוזומים כדי לזהות חלבונים או סמנים ביולוגיים מסוימים בדם. במחקר אחד עכברים נחשפו ל-TBI קל או בינוני. כאשר החוקרים לקחו אקסוזומים ממוחות העכברים, הם ראו שלאקסוזומים האלה יש רמות נמוכות יותר של חלק מרצפי הרנ“א ורמות גבוהות יותר של רצפי רנ”א אחרים. באמצעות הניסויים האלה אנו יכולים לראות את ההבטחה שיש בשימוש באקסוזומים כאמצעי לאבחון TBI.
מסקנות
תשומת הלב המשמעותית שסמנים ביולוגיים קיבלו בשנים האחרונות עשויה להוביל לזיהוי של הטיפול היעיל הראשון ל-TBI! ככל שאנו לומדים יותר על המוח ועל האופן שבו הוא משתקם מפגיעות, תקוותנו היא שנוכל למצוא דרכים טובות ומהירות יותר לאבחן פגיעות מוחיות ובסופו של דבר לגלות שיטות חדשות לטפל בהן. בינתיים, שמרו על מוחותיכם בטוחים ומוגנים!
מילון מונחים
פגיעה מוחית טראומטית (TBI – traumatic brain injury): ↑ טראומה פיזית למוח שיכולה להשפיע על החשיבה ועל יכולות קוגניטיביות שונות.
סמן ביולוגי (Biomarker): ↑ מולקולה ביולוגית בתוך הגוף שאפשר למדוד אותה. נתונים שנוגעים לנוכחות של סמנים ביולוגיים ולרמות שלהם מאפשרים למדענים לאתר מצבים אבנורמליים ומחלות אצל מטופלים.
אקסוזומים (Exosomes): ↑ בועיות שמשתחררות מהתא ויכולות לנוע דרך נוזלי גוף שונים. אקסוזום יכול להכיל מולקולות שמצביעות על התא שמהן הגיעו ועל מה שמתרחש באותו התא.
מחצית חיים (Half-life): ↑ כמות הזמן שנדרשת לחומר לרדת לחצי מהכמות המקורית שלו.
ציטוקינים (Cytokines): ↑ שם כללי לחלקים של מערכת החיסון שמשתתפים בתקשורת תאית ומשפיעים על התנהגות התאים.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Lee, B., and Newberg, A. 2005. Neuroimaging in traumatic brain imaging. NeuroRx 2:372–83. doi: 10.1602/neurorx.2.2.372
[2] ↑ Willheim, M. 2012. Biomarkers. Wien. Med. Wochenschr. 162:453. doi: 10.1007/s10354-012-0161-5
[3] ↑ Yokobori, S., Hosein, K., Burks, S., Sharma, I., Gajavelli, S., and Bullock, R. 2013. Biomarkers for the clinical differential diagnosis in traumatic brain injury–a systematic review. CNS Neurosci. Ther. 19:556–65. doi: 10.1111/cns.12127
[4] ↑ Osier, N., Bales, J., Pugh, B., Shin, S., Wyrobek, J., Puccio, A., et al. 2017. Variation in PPP3CC genotype is associated with long-term recovery after severe brain injury. J. Neurotrauma 34:86–96. doi: 10.1089/neu.2015.4343
[5] ↑ Osier, N., Motamedi, V., Edwards, K., Puccio, A., Diaz-Arrastia, R., Kenney, K., et al. 2018. Exosomes in acquired neurological disorders: new insights into pathophysiology and treatment. Mol. Neurobiol. 55:9280–93. doi: 10.1007/s12035-018-1054-4
[6] ↑ Nylén, K., Öst, M., Csajbok, L. Z., Nilsson, I., Blennow, K., Nellgård, B., et al. 2005. Increased serum-GFAP in patients with severe traumatic brain injury is related to outcome. J. Neurol. Sci. 240:85–91. doi: 10.1016/j.jns.2005.09.007
[7] ↑ Battista, A., Rhind, S., Hutchinson, M., Hassan, S., Shiu, M., Inaba, K., et al. 2016. Inflammatory cytokine and chemokine profiles are associated with patient outcome and the hyperadrenergic state following acute brain injury. J. Neuroinflammation 13:40. doi: 10.1186/s12974-016-0500-3
[8] ↑ Kumar, R. G., Diamond, M. L., Boles, J. A., Tisherman, S. A., Kochanek, P. M., and Wagner, A. K. 2015. Acute CSF interleukin-6 trajectories after TBI: associations with neuroinflammation, polytrauma, and outcome. Brain Behav. Immun. 45:253–62. doi: 10.1016/j.bbi.2014.12.021