תַקצִיר
חלבונים הם מכונות ביולוגיות קטנות שפועלות בגופנו ובגוף כל בעלי החיים, הצמחים והחיידקים, האחראים על מגוון גדול של פעולות חיוניות לתפקודם. החלבונים מיוצרים בתוך התאים על פי הצופן הגנטי על ידי אברון רב מרכיבים שנקרא רִיבּוֹזוֹם. הריבוזום מרכיב חלבונים במהירות רבה מאוד, תוך הקפדה על רמת דיוק גבוהה. מרבית המחקר המדעי שלי מוקדש להבנת מבנה הריבוזום ואופן תפקודו. במאמר זה אפרט על הממצאים המרכזיים של מחקרי, על חלק מהיישומים החשובים של ממצאים אלה, ועל האתגרים שעמדו בדרכי אליהם.
פרופסור עדה יונת זכתה בפרס נובל לכימיה לשנת 2009 על פענוח מבנה הריבוזום.
מדנ“א לחלבונים
כל תא חי מכיל חומר שעובר בתורשה מההורים לצאצאים, הנקרא צופן גנטי, כלומר הוראות לבניית מרכיבי התא והיצור החי כולו. החומר התורשתי נקרא דנ”א , ותוכלו לְדַמּוֹתוֹ לספר מתכונים המכיל את כל המידע הדרוש ליצירת ולתפקוד היצור החי. אחד המרכיבים החשובים ביותר של הדנ”א הם הגנים, שהם ההוראות ליצירת חלבונים - ה’מכונות’ של התא ושל הגוף החי. החלבונים מבצעים פעולות רבות שחשובות לתפקוד התא והגוף כולו.
כל החלבונים בטבע בנויים מכ-20 אבני בניין שנקראות חומצות אָמִינוֹ. חומצות האמינו מחוברות ביניהן אחת אחרי השנייה, כמעין חרוזים בשרשרת, ויוצרות את החלבון. חלבון בינוני מכיל בין 150 ל-500 חומצות אמינו המחוברות ביניהן בקשר מיוחד שנקרא קשר פפטידי. המחרוזת הארוכה הזו מתקפלת במרחב למבנה ייחודי תלת-ממדי, שנקבע על ידי רצף חומצות האמינו המרכיבות אותו, ומותאם בדיוק לתפקיד שהחלבון צריך לבצע (איור 1).
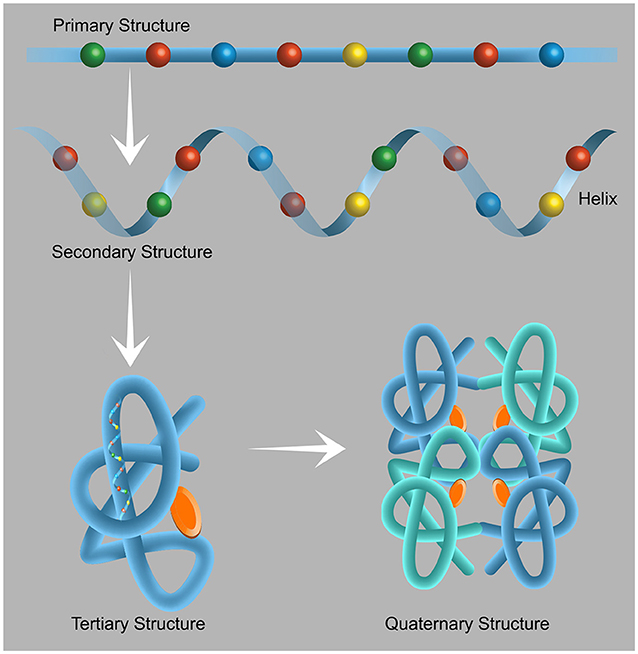
- איור 1 - מבנה החלבון.
- חלבונים מורכבים מ-20 אבני בניין שנקראות חומצות אמינו. כשחומצות אמינו מחוברות זו לזו, הן יוצרות שרשרת שנקראת מבנה ראשוני (Primary structure). לכל חומצת אמינו יש תכונות כימיות מיוחדות, הדרושות לביצוע תפקודי החלבון ולכן ישנהּ חשיבות רבה לרצף שבו מופיעות חומצות האמינו. שרשרת החלבון מתקפלת לפי סדר התכונות של מרכיביה למבנה שניוני (Secondary structure) היכול להכיל מספר אלמנטים מבניים, ביניהם סלילים (Helix). המבנה השלישוני (Tertiary structure) הוא המבנה התלת-ממדי של החלבון, כלומר מיקום ההליקסים והשרשרות המחברות אותם, המאפשר ביצוע התפקודים המסוימים של אותו חלבון. חלק מהחלבונים פעילים כצברים בעלי מבנה רביעוני (Quaternary structure). צברים אלה מורכבים מלפחות שני מרכיבים חלבוניים הקשורים זה לזה באופן שמאפשר את פעילותם. נלקח מכאן.
ייצור חלבונים בתא מתרחש בכמה שלבים (איור 2). בשלב הראשון, הדנ”א, החומר התורשתי, משועתק. העותק מאפשר לחומר התורשתי לנוע בתוך התא בלי ”לסכן” את הצופן המקורי. תהליך זה מכונה שעתוק (transcription), והמולקולה שנוצרת נקראת רנ”א שליח (mRNA). בשלב הבא, הרנ”א שליח מגיע אל הריבוזום, שהוא המפעל לייצור החלבונים בתא. הריבוזום קורא את הוראות הייצור מהרנ”א שליח, ומכין לפיהן את החלבון הרצוי. תחילה, נוצרת שרשרת של חומצות אמינו המחוברות ביניהן בקשרים פפטידיים. לאחר היציאה מהריבוזום, השרשרת מתקפלת (folding) למבנה תלת-ממדי המתאים לתפקיד החלבון. תהליך זה של יצירת החלבון בריבוזום נקרא ”תרגום”(translation). כיצד מתרחש תהליך התרגום בריבוזום?
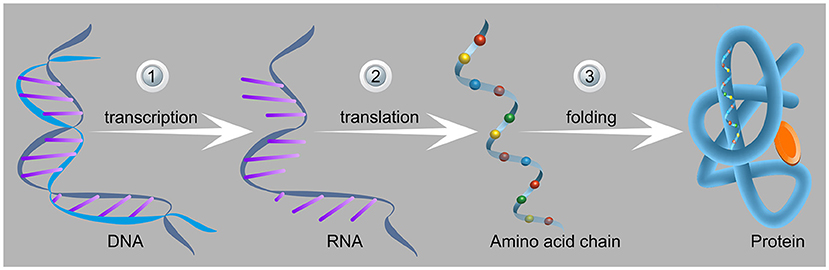
- איור 2 - שלבי ייצור חלבונים בתא.
- (1) בשלב הראשון, חלק הדנ”א המכיל את הרצף של החלבון (משמאל) משועתק ליצירת רנ”א שליח. (2) בשלב השני, הריבוזום יוצר את שרשרת החומצות האמיניות (שהיא החלבון), שעוזבת את הריבוזום דרך מנהרה מוגנת. (3) לאחר צאתה, השרשרת מתקפלת למבנה התלת-ממדי של החלבון (מימין). מבנה ייחודי זה מותאם לתפקיד החלבון שנוצר (מתוך מגוון התפקידים של חלבונים בגוף). התמונה נלקח מכאן.
הריבוזום
תרגום של חלבון חדש הוא תהליך מסובך. ה”מתכון” ליצירת חלבונים מקודד בדנ”א וברנ”א שליח, ב”שפה” של ארבע אותיות המתורגמות ל”שפה” של חומצות אמיניות המכילות כ-20 אבני בניין שונות. אתם וודאי תוהים, כיצד זה אפשרי? זהו תהליך התרגום. הריבוזום קורא את הקוד הגנטי כסדרה של רצף של שלושה בסיסים (נוקלאוטידים) הנקראים קודונים. כל קודון תואם לחומצה אמינית מסוימת (ישנן חומצות אמיניות להן מתאים יותר מקודון אחד – או אפילו ארבעה) או לסימן סיום. הריבוזום אחראי לתרגום: הוא יוצר את הקשרים בין החומצות האמיניות לחלבון המתהווה.
הריבוזום הוא אברון בתוך התא, שמורכב משתי תתי-יחידות: תת-היחידה הקטנה ותת-היחידה הגדולה (איור 3). לכל תת יחידה תפקיד משלה. היחידה הקטנה מכילה את האתר בו נקרא הצופן הגנטי מהרנ”א שליח (Decoding center). הגדולה את האתר בו מתחברות חומצות האמינו זו לזו דרך קשר פפטידי (Peptide bond formation center) אל התעלה בה יוצא החלבון המתהווה. במרכז הקטליטי של הריבוזום, החומצות האמיניות מתחברות אחת לשנייה דרך יצירת קשר פפטידי. תת-היחידות האלה מתחברות בעת תהליך הרכּבת החלבון, ומתנתקות בסיומו.
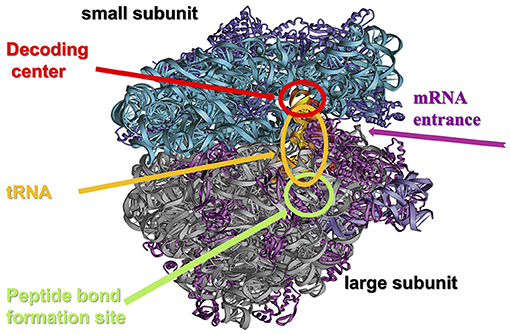
- איור 3 - מבנה הריבוזום.
- הריבוזום בנוי מעשרות חלבונים (בסגול), ומשרשראות של רנ”א ריבוזומלי (בכחול ובאפור), אשר מסודרים בשתי תתי-יחידות: הקטנה (small subunit, בכחול ואפור), והגדולה (Large subunit, באפור). היחידה הקטנה מכילה אתר שבו נקרא הצופן הגנטי (Decoding center), שמגיע לריבוזום כמולקולת רנ”א שליח (mRNA) ומתחבר לרנ”א המוביל (tRNA) על פי הצופן הגנטי, המיוצג על ידי 3 אותיות (ראו איור 4). היחידה הגדולה מכילה אתר (Peptide bond formationcenter) שבו חומצות האמינו, שנישאות על ידי רנ”א מוביל, מתחברות זו לזו. שתי תתי-היחידות של הריבוזום מתחברות בעת הרכבתו של חלבון חדש, ועוזבות זו את זו חזרה בסיום תהליך הרכבת החלבון. האיור באדיבות עדה יונת.
כל תת-יחידה בנויה מעשרות חלבונים ושרשראות רנ”א ארוכות עד מאד הנקראות רנ”א ריבוזומלי (איור 3) [1]. בתוך כל תא חי ישנם ריבוזומים רבים – מעשרות אלפים, אצל חיידקים למשל, ועד מיליונים בתאים של בני אדם. פעולת הריבוזומים צורכת אנרגיה רבה – יותר מ-60% מסך צריכת האנרגיה של התא [2]. עובדה זו מדגישה את חשיבותו של הריבוזום בתא, בהיותו המפעל לייצור החלבונים הנדרשים לפעילוּת התא. הריבוזום פועל במהירות מדהימה: ריבוזום חיידקי אחד מסוגל ליצור חלבון סטנדרטי בזמן שבין מספר שניות לדקה.
התהליך מתרחש בשלושה שלבים. בשלב ההתחלתי (Initiation) רנ”א שליח מגיע אל תת-היחידה הקטנה של הריבוזום. אז מצטרף לריבוזום רנ”א מוביל (tRNA), הנושא את החומצה אמינית מתיונין, והוא נקשר לקודון ההתחלה ברצף הרנ”א שליח. הרצף של קודון ההתחלה בכל מולקולות הרנ”א שליח הוא AUG, המקודד למתיונין. מרכיבים נוספים מצטרפים לתת היחידה הקטנה, לרנ”א שליח ולרנ”א מוביל. בשלב השני, תת היחידה הגדולה נקשרת ויוצרת את מצב הריבוזום הפעיל – קומפלקס התרגום. זהו שלב ההארכה שבו הריבוזום מתרגם כל קודון בתורו. לכל חומצה אמינית יש רנ”א מוביל משלה, הנקשר לריבוזום כשהוא נושא עימו את חומצת האמינו. הריבוזום נע לאורך הרנ”א שליח, בעוד שמולקולות רנ”א מוביל עם חומצת אמינו מגיעות ונקשרות בשלושה אתרים הסמוכים זה לזה בריבוזום ),4 איור אתרים P ,Aו-E). הקשרים נוצרים בין החומצות הנמצאות באתר הראשון (A) והשני (P) ושרשרת החלבון המתהווה נכנסת לתעלה. אז, הרנ”א המוביל יוצא דרך האתר השלישי (E) ומשתחרר מהריבוזום. בכל פעם שמגיעה חומצת אמינו חדשה היא מתחברת בקשר פפטידי לחומצת האמינו הקודמת. כך נוצרת מחרוזת הולכת וגדלה של חומצות אמינו [3]. המחרוזת המתארכת הזו יוצאת מתעלה בקצהו של הריבוזום, עד לסיומו של תהליך חיבור חומצות האמינו זו לזו. בשלב השלישי והאחרון, הריבוזום מגיע לקודון הסיום. זהו קודון על הרנ”א שליח שמולקולות רנ”א מוביל אינן יכולות לזהותו. כעת, התרגום הסתיים ושתי תתי-היחידות של הריבוזום נפרדות זו מזו. המחרוזת היוצאת מתקפלת למבנה תלת-ממדי- לבד או באמצעות עזרים (צ’פרונים). כך החלבון החדש משתחרר מהריבוזום, וכעת הוא יכול לבצע את תפקידו בתא1 (צפו בסרטון המתאר את התהליך).
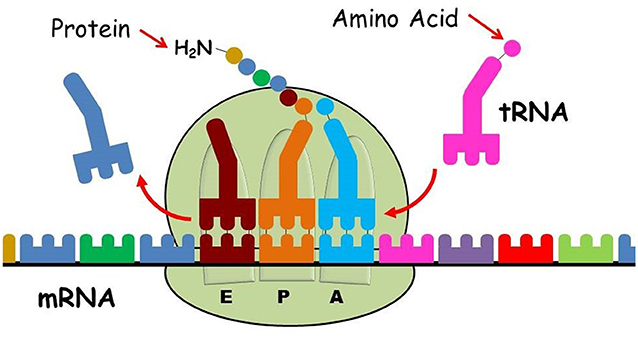
- איור 4 - יצירת חלבון בריבוזום.
- הריבוזום מורכב משתי תתי-יחידות בסיסיות: תת-היחידה הקטנה (למטה) ותת-היחידה הגדולה (למעלה). תת-היחידה הקטנה קוראת מתוך הרנ”א שליח (mRNA, שרשרת צבעונית למטה) את ההוראות להרכבת החלבון. תת-היחידה הגדולה אחראית ליצירת הקשר הפפטידי ומרכיבה את החלבון החדש לפי ההוראות בmRNA באופן הזה: רנ”א מוביל (tRNA, מצד ימין בוורוד) נושא איתו את החומצה האמינית המתאימה (עיגול ורוד) ונקשר לאתר P, לאחריו הרנ”א המוביל הבא נקשרלאתר A שעל הריבוזום. נוצר קשר פפטידי חדש בין חומצות האמינו הקשורות ל tRNA באתר P ו-A (בתכלת ובכתום). ה-tRNA מאתר P עובר לאתר E, אתר היציאה (באדום כהה) בעוד שה- tRNA מאתר A עובר לאתר P יחד עם שרשרת החלבון המתהווה כך שtRNA נוסף יחד עם חומצת אמינו יכול להכנס לאתר A. בסיום התהליך שרשרת חומצות האמינו משתחררת מתוך הריבוזום ומתקפלת לחלבון פעיל. האיור באדיבות עדה יונת.
כיצד גילינו את המבנה המיוחד של הריבוזום? לשם כך פיתחנו שיטה ייחודית שעל אודותיה נפרט בפרק הבא של המאמר.
קריסטלוגרפיה בהשראת דובי קוטב
את מבנה הריבוזום ותפקודו פענחנו באמצעות שיטה שנקראת קריסטלוגרפיה. שיטה זו מאפשרת לחקור חומרים מגובשים. גביש הוא מבנה המורכב מיחידות בעלות סימטריה פנימית, שחוזרות על עצמן באופן מסודר במרחב. היחידה הפשוטה והקטנה ביותר החוזרת על עצמה בגביש נקראת ’תא יחידה’. דוגמה לתא יחידה של גביש מלח בישול ניתן לראות באיור 5A. לתא היחידה יש מידות קבועות של אורך, גובה ורוחב, וכן זוויות בין הפאות השונות. בגביש, תאי היחידה מסודרים זה לצד זה באופן מחזורי, בדומה לאריחי ריצוף. בתהליך הקריסטלוגרפיה מקרינים את הגביש באמצעות קרן רנטגן אחידה ומרוכזת מאוד (איור 5B). האטומים השונים שנמצאים בתוך כל תא יחידה בגביש גורמים לקרן הרנטגן להתפזר על פי תכונותיהם ומיקומם אחרי שהיא פוגעת בהם, על פי חוק בראג. תוך כדי ההקרנה אוספים תמונות של פיזור הקרן על גבי מסך (איור 5B, מסך בצד ימין). באמצעות התמונות האלה, ושימוש בשיטה המבוססת על משוואות מתמטיות שנקראות משוואות פורייה, אפשר לפענח את המבנה התלת-ממדי של תא היחידה.
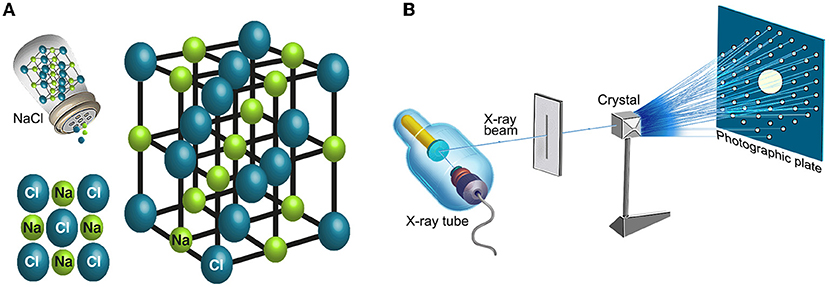
- איור 5 - פענוח מבנה של גביש באמצעות קריסטלוגרפיה.
- (A) דוגמה לגביש שכולנו מכירים מחיי היומיום – מלח בישול. מלח הבישול מורכב משתי מולקולות – נתרן (יון חיובי, בצהוב) וכְלוֹר (יון שלילי, בכחול), המאורגנות באופן מחזורי בתאי יחידה שחוזרים על עצמם בכל הכיוונים במרחב. (B) פענוח מבנה של גביש באמצעות קריסטלוגרפיה. בשיטה זו, הגביש מוקרן בקרן רנטגן אחידה ומרוכזת. הסידור המרחבי של האטומים השונים שמרכיבים את הגביש גורם לקרן הרנטגן להתפזר אחרי שהיא פוגעת בגביש. במהלך הניסוי, מקרינים על הגביש את קרן הרנטגן בזוויות פגיעה שונות, ומודדים את עוצמת ומיקום המרכיבים של התמונות המתקבלות על מסך (מימין). על בסיס התמונות האלה ניתן לפענח את המבנה התלת- ממדי של הגביש.
התנאי הראשון לפענוח מבנה בשיטת הקריסטלוגרפיה הוא הכנת גבישים. ישנם חומרים שבאופן טבעי מגיעים בצוּרת גביש, כמו למשל מלח בישול, סוכר ואבן קוורץ. גבישים אלה יציבים ומוצקים. אך מרבית החומרים והמבנים בטבע בכלל ובגוף האדם בפרט, לרבּות החלבונים ובכללם הריבוזום, אינם מגובשים. לכן, האתגר הראשון במחקר שלנו היה למצוא דרך לגבש ריבוזומים, מטלה שנחשבה לבלתי אפשרית, היות ולפנינו מדענים מפורסמים רבים כשלו בה. במשך תקופה ארוכה לא הצלחנו כלל לייצר גבישים של ריבוזומים עקב המבנה המורכב במיוחד שלהם. הדרישות התפקודיות שלהם בגוף גורמות לכך שיהיו בעלי יכולת תנועתית, והם נוטים להתפרק כשהם מחוץ לתא, מה שמקשה עוד יותר על גיבושם.
אחת מפריצות הדרך החשובות שעשינו בתהליך התאפשרה בהשראתם של דובי הקוטב. התברר שבזמן תרדמת החורף חלק גדול מהריבוזומים של הדובים נשמרים במבנה צפוף וכמעט מחזורי לכל אורך החורף, עד שהדובים מקיצים משנתם באביב. הנחנו שבאופן זה הדובים משמרים את הריבוזומים, כדי שלא יתפרקו בחורף ויוכלו לתפקד באביב. עובדה זו שימשה כראיה עבורנו לכך שבתנאי לחץ הריבוזומים נוטים להסתדר בצפיפות כמעט מחזורית, ולכן בחרנו לייצר גבישים מריבוזומים של חיידקים החיים בתאי לחץ קיצוניים בים המלח. אכן, בעבודה מאומצת, וניסיונות של אינספור תנאים שונים, הצלחנו לקבל גבישים יציבים של ריבוזומים פעילים.
לאחר שהדבר עלה בידינו, הבנו שעלינו להתמודד עם קושי נוסף. קרני הרנטגן המשמשות לפענוח מבנה הגביש הן בעלות אנרגיה גבוהה מאוד, המשפיעה על הקשרים הכימיים בין האטומים של הריבוזומים בגביש. כלומר, בזמן שאנו מקרינים את הגביש במטרה לאסוף מידע על המבנה שלו, אנו למעשה הורסים אותו, ולכן בפועל לא הצלחנו למדוד מעל אחוזים בודדים מהמידע הדרוש לפתרון מבנה הריבוזום. האתגר שעמד בפנינו היה להצליח לאסוף מספיק מידע על מבנה הריבוזום הגבישי לפני שהגביש נהרס. לכן היינו צריכים למצוא דרך שבה הגבישים ישארו יציבים לאורך זמן כך שנוכל לבצע יותר מדידות. לשם כך, פיתחנו שיטה שמפחיתה את נזקי קרינת הרנטגן לריבוזומים באמצעות הקפאה מהירה מאוד של הגבישים בטמפרטורה נמוכה מאוד (מינוס מאתיים מעלות צלזיוס, באמצעות חנקן נוזלי) בתנאים בהם התמיסה בה מצוי הגביש לא תהפוך לקרח. המטרה היתה למזער את היכולת של האטומים המרכיבים את הריבוזום לנוע לאחר שהקשרים ביניהם נשברו על ידי קרני הרנטגן. על ידי שימוש בממיסים מיוחדים הנזק שנגרם מהקרינה תוך כדי המדידה לא התפשט לכל אזורי הגביש שטרם הוקרנו. באמצעות שיטה זו, בשילוב עם שיטות ניסיוניות נוספות שפותחו במכון ויצמן למדע עשרות שנים קודם לכן, הצלחנו לשמור על פעילותו התקינה של הריבוזום הגבישי לאורך זמן, ובסופו של דבר, אחרי 20 שנים, גם לפענח את מבנהו ולהבין את תפקודו.
לכל אורך עבודתנו, הדעה הרווחת של מדענים רבים הייתה שבלתי אפשרי לפענח את מבנה הריבוזום. מדענים ידועים אף הקניטו אותנו ולעגו לנו על האתגר הגדול שהצבנו לעצמנו. למרות כל זאת, הנחישות והיצירתיות שלנו אפשרו לנו להשלים את המשימה תוך חיפוש מתמיד אחר פתרונות מחוץ לקופסה. למעשה, למרות שהקהילה המדעית לא האמינה בנו ובשיטות שפיתחנו, לאור הצלחתנו השיטות שלנו אומצו ויושמו לאחר חודשים ספורים. הצלחתנו הולידה גם יישומים רפואיים חשובים שעליהם אספר לכם כעת.
הקרב על הבריאות – איך משביתים חיידקים?
כפי שציינו קודם, הריבוזום הוא רכיב חשוב ביותר בכל תא חי. כאשר תפקודו של הריבוזום נפגע בצורה משמעותית, התא מפסיק לייצר חלבונים ועל כן לא מסוגל להמשיך לתפקד. הדבר נכון גם במקרה של חיידקים, שמכילים ריבוזומים הדומים באופן הפעולה לריבוזום האנושי. עם זה, ישנם כמה הבדלים קטנים, אך משמעותיים, בין מבנה של ריבוזום חיידקי לזה של ריבוזום אנושי. הבדלים אלה הם שמאפשרים לנו ליטול אנטיביוטיקה ולפגוע בחיידק בלי לפגוע בחולים שנוטלים אותה.
יש כמה סוגים של אנטיביוטיקות. אנטיביוטיקות טבעיות שנמצאות בשימוש מיוצרות על ידי חיידקים כתוצאה מ”מלחמות” בין סוגי החיידקים השונים שצריכים להשתמש באותם מקורות. הן פוגעות בחיידקים על ידי שיתוק מנגנונים חיוניים הדרושים לפעילות החיידקים. אחת מהמטרות היא הריבוזום. למרות שהריבוזום עצום בהשוואה לגודל האנטיביוטיקה, רוב האנטיביוטיקות נקשרות ובכך חוסמות את אחד מהאתרים הפעילים של הריבוזום. לדוגמא, הן גורמות לסתימה של אתר מסוים בתת-היחידה הגדולה של הריבוזום (איור 4) – כך שהחלבון לא יכול להתארך. מטרה אחרת בריבוזום היא חסימה של התקדמותו של הרנ”א שליח בתת-היחידה הקטנה. חסימה זו אינה מאפשרת קריאה תקינה של הרנ”א שליח, שהכרחית ליצירת חלבון תקין. אנטיביוטיקות אחרות חוסמות את האתר A בתת היחידה הקטנה כך שהרנ”א מוביל שנושא את חומצת האמינו לא יכול להקשר אליו. באופן זה חומצת האמינו לא יכולה לחומצת האמינו הבאה במחרוזת [4]2. לחצו כאן על מנת לצפות בסרטון המדגים כיצד אנטיביוטיקות מפריעות לפעילות הריבוזום החיידקי.
אכן, לתובנות שנבעו מהמחקר שלנו יש השלכות יישומיות רבות-חשיבוּת בתחום הרפואה. אולי שמעתם שחלק מהחיידקים מחוללי המחלות פיתחו עמידות לאנטיביוטיקה מה שהופך אותם למסוכנים יותר. הֲבָנַת מבנה הריבוזום ופעילותו אפשרו הבנה טובה יותר של דרכי הפעולה של האנטיביוטיקות השונות ולכן גם למלחמה בעמידות. זו אחת הדוגמאות לכך שהעקשנות והמאמץ הרב שהשקענו בפענוח מבנה הריבוזום ותפקודו במשך עשרות שנים היו מוצדקים ונשאו פרי. בהקשר זה, אבקש לחלוק עמכם כמה המלצות שאותן גיבשתי בעקבות התהליך.
המלצות למדענים הצעירים
ההמלצה העיקרית שלי היא: לכו בעקבות סקרנותכם. אם תנסו לתרום למדע מידע חדש על תהליך שמאד מעניין אתכם, קחו בחשבון שאולי לא יתמכו בכם, ודאי שלא בתחילת הדרך. חלק אולי יגידו שאתם מנסים לעשות משהו חסר סיכוי. אחרים עשויים לומר שאתם מטעים, ואולי אפילו יטענו שהמחקר שלכם מבזבז כספי ציבור. ההמלצה שלי היא להתמקד בסקרנות שלכם ובאמונה בכוחכם, גם אם עוד לא הגעתם למטרה הסופית שייחלתם לה. אם תצללו לעומק הבעיה ולבסיסה, תגדילו את הסיכויים להגיע לפתרון. במקרה שלי, הצבתי מטרה לפענח את מבנה הריבוזום. לכל אורך הדרך האמנתי שגם אם לא אצליח לפענח את המבנה כולו, יהיו בכל זאת תוצרים מדעיים משמעותיים שאליהם אגיע בדרכי. ואכן, עוד לפני שמבנה הריבוזום פוענח, מחקרי הוביל לפיתוח שיטות חדשות בקריסטלוגרפיה. שיטות אלה תרמו באופן משמעותי להבנת תהליכים ביולוגיים, ובאמצעותן אף נקבעו עשרות אלפי מבנים שלא היו ידועים קודם לכן.
היבט נוסף שאני מבקשת לחלוק איתכם הוא, שככל שהדרך קשה יותר, כך הסיפוק בסיומה גדול יותר. לכן, הֱיוּ נחושים והתגברו על הקשיים שעומדים בפניכם בידיעה ששביעות רצון רבה מחכה לכם מעבר לפינה.
המלצות למקורות מידע נוספים
מה זה מוזה במעבדה עונה 2 – פרופסור עדה יונת
מילון מונחים
דנ”א (DNA): ↑ חומר תורשתי שעובר מהורים לצאצאים ומכיל את הוראות ההפעלה לייצור מרכּיבי התא, הנקראים גנים. הדנ”א מורכב מארבע אבני בניין, הנקראות חומצות גרעין.
חלבונים (Proteins): ↑ ה’פועלים’ של התא – מולקולות שמבצעות את מרבית הפעולות בתא, ובגוף בכללותו. עם פעולות אלה נמנות, למשל, יצירת תנועה (הפעלת שרירים); נשיאת חמצן וסילוק פחמן דו-חמצני מהדם (נשימה); בניית העור ורקמות החיבור של הגוף (מבנה) והגנה על הגוף מפני פולשים (מערכת החיסון).
חומצות אמינו (Amino acids): ↑ אבני הבניין שמרכיבות את החלבונים. ישנן כ-20 חומצות אמינו שונות, שכל שתיים מהן נקשרות זו לזו בקשר פפטידי. קשרים אלה מחבּרים בין חומצות האמינו כמחרוזת, וכך נוצר החלבון. חלבון בגודל ממוצע מורכב מבּין 150 ל-300 חומצות אמינו.
קשר פפטידי (Peptide bond): ↑ הקשר הכימי שמחבר בין כל שתי חומצות אמינו.
שעתוק (Transcription): ↑ התהליך שבו נוצרת מולקולת רנ”א שליח, על בסיס מולקולת דנ”א. הדנ”א מכיל את כלל הוראות ההפעלה ליצירת החלבונים בתא. מאחר שהדנ”א הוא עותק המקור ואין לו תחליף, התא מכיל מנגנונים שונים שמטרתם להגן עליו, ובהם מנגנון השעתוק. מולקולת הרנ”א שנוצרת בתהליך זה מיוצרת בעותקים רבים בתוך התא, ומשמשת כעותק זמין ובטוח לפעילותו.
רנ”א שליח (mRNA – Messenger RNA): ↑ רנ”א המעתיק את המידע הגנטי מהדנ”א, המשמש כתבנית ליצירת חלבונים בתא. בזמן תהליך יצור החלבון, הריבוזום קורא את הרנ”א שליח וכך נוצרת שרשרת של חומצות אמינו בסדר הנכון לפי הקוד הגנטי. הרנ”א שליח משמש כעותק נגיש ובטוח המתורגם לחלבונים.
ריבוזום (Ribosome): ↑ אברון בתא, שמייצר חלבונים. הריבוזום מורכב משתי תת-יחידות, הקטנה והגדולה, שהן עצמן מורכבות מחלבונים רבים ומרנ”א ריבוזומלי. תת-היחידה הקטנה אחראית על קריאת הקוד הגנטי דרך הרנ”א שליח, ותת-היחידה הגדולה אחראית על יצירת החלבון לפי הוראות הדנ”א.
תרגום (Translation): ↑ השלב שמגיע לאחר שלב השעתוק בתהליך יצירת החלבון בריבוזום. בשלב התרגום החלבון מיוצר לפי מידע המצוי במולקולת רנ”א שליח, לפי הוראות הקוד הגנטי. מידע זה מתורגם לתֹכֶן של מחרוזת חומצות האמינו אשר מרכיבה את החלבון. מדובר במעבר מורכב, כשבד בבד עם שלב התרגום מתחיל קיפול החלבון למבנה מרחבי תלת-ממדי, אשר יוצר את החלבון הסופי.
רנ”א ריבוזומלי (rRNA – Ribosomal RNA): ↑ רצף רנ”א מיוחד היוצר את המבנה של הריבוזום; בערך כשני שלישי מהריביזום מורכב מרנ”א ריבוזומלי, השליש הנוסף מורכב מחלבונים ריבוזומלים.
רנ”א מוביל (tRNA – Transfer RNA): ↑ מולקולה המשתתפת בתהליך ההרכבה (התרגום) של חלבון בריבוזום. רנ”א מוביל מביא לריבוזום חומצה אמינית מסוימת. כל רנ”א מוביל הוא ייחודי לרצף מסוים התואם לרנ”א שליח.
קריסטלוגרפיה (Crystallography): ↑ שיטת מחקר המאפשרת לחקור את המבנה התלת מימדי של חומרים מגובשים ואת תפקודיהם, באמצעות הקרנתם בקרני רנטגן.
גביש (Crystal): ↑ מבנה יציב ומוצק של חומר המורכב מיחידות שחוזרות על עצמן באופן מסודר במרחב. מדענים משתמשים בגבישים על מנת ללמוד את המבנה והקשרים הפנימיים בין מולקולות כמו מתכות, חומרים אורגנים, חלבונים ודנ”א.
הצהרת ניגוד אינטרסים
המחברים מצהירים כל המחקר נערך בהעדר כי קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
תודה לאלינור בריינר על שעברה על כתב היד המקורי ולזהבה כהן על ה איורים1, 2 ו 5.
sהערות שוליים
1. ↑לצפייה בסרטון המתאר את התהליך, היכנסו לקישור זה.
2. ↑לצפייה בסרטון הממחיש את הדרכים השונות שבהן אנטיביוטיקות משבשות את פעולתו של הריבוזום החיידקי, היכנסו לקישור זה.
הצהרת כלי בינה מלאכותית
טקסט חלופי הנלווה לאיורים במאמר זה נוצר על ידי פרונטירז בסיוע כלי בינה מלאכותית, ונעשו מאמרצים על מנת להבטיח את דיוקו, כולל בדיקה על ידי כותבי המאמר כאשר הדבר התאפשר. אם ברצונכם לדווח על בעיה, אנו צרו איתנו קשר.
מקורות
[1] ↑ Schluenzen, F., Tocilj, A., Zarivach, R., Harms, J., Gluehmann, M., Janell, D., et al. 2000. Structure of functionally activated small ribosomal subunit at 3.3 Å resolution. Cell 102:615–23. doi: 10.1016/S0092-8674(00)00084-2
[2] ↑ Zhou, X, Liao, W-J, Liao, J-M, Liao, P, Lu, H. 2015. Ribosomal proteins: functions beyond the ribosome. Mol. Cell. Biol. 7:92–104. doi: 10.1093/jmcb/mjv014
[3] ↑ Bashan, A, Agmon, I, Zarivach, R, Schluenzen, F, Harms, J, Berisio, R, et al. 2003. Structural basis of the ribosomal machinery for peptide bond formation, translocation, and nascent chain progression. Mol. Cell 11:91–102. doi: 10.1016/S1097-2765(03)00009-1
[4] ↑ Schlünzen, F., Zarivach, R., Harms, J., Bashan, A., Tocilj, A., Albrecht, R., et al. 2001 Structural basis for the interaction of antibiotics with the peptidyl transferase center in eubacteria. Nature 413:814–21. doi: 10.1038/35101544
