תַקצִיר
מאמר זה מבוסס על ריאיון שנערך בין שני כותבי המאמר.גוף האדם הוא כמו ג’ונגל שבתוכו מתרחשים טריליוני פעילויות מרתקות בכל שנייה, ואיננו מודעים לרבות מהן. במאמר זה נתמקד בחלק מעניין מאוד בג’ונגל הזה של הפעילויות בגוף האדם – מערכת החיסון. מערכת החיסון מְגִנָּה על הגוף מפני פולשים. לשם כך היא מפעילה ”מומחים באומנויות לחימה”, הנקראים תאי T הורגים, או ציטוטוקסיים. התאים הללו אחראיים לחיסול תאים שנדבקו בנגיף, כדי שהנגיף לא יצליח להתרבוֹת ולהתפשט בכל הגוף. הצטרפו אליי למסע הרפתקני אל תוך מערכת החיסון, שבו נגלה כיצד תאֵי T ציטוטוקסיים יודעים אֵילו תאים לתקוף, ומאֵילו תאים עליהם להתעלם.
פרופסור פיטר דוֹהֶרְטִי זכה בפרס נובל לפיזיולוגיה או לרפואה בשנת 1996 יחד עם פרופסור רוֹלְף צִינְקֶרְנָגֶל, עבור תגליותיהם הנוגעות לספציפיוּת של ההגנה החיסונית המְתֻוֶּכֶת באמצעות תאים.
התאים המגינים על הגוף
מערכת החיסון היא אחת המערכות החיוניות של הגוף. היא מורכבת מתאֵי דם לבנים ומהחומרים שהם מייצרים. תפקידהּ של מערכת החיסון הוא לשמור על בריאותנו. לשם כך, עליה להתגבר על זיהומים (למידע נוסף על מערכת החיסון, ראו חומרים נוספים). בין הפולשים שעלולים להיכנס לגוף ולגרום למחלה הם הנגיפים. נגיפים (וירוסים) הם חלקיקים זעירים שמדביקים את תאֵי האורגניזם, הנקרא ”מארֵחַ”. הנגיפים ”מְרַמים” את תאֵי המארח וגורמים להם לייצר עותקים נוספים של הנגיף. התאים הנגועים מתים בדרך כלל, ומשחררים עותקים חדשים רבים של הנגיף שיכולים להתפשט בכל הגוף ולהדביק תאים נוספים (למידע נוסף על נגיפים, עיינו במאמר זה באוסף פרסי הנובל).
למערכת החיסון יש שתי דרכים עיקריות להתמודד עם זיהומים שמקורם בנגיפים. האסטרטגיה הראשונה כוללת ייצוּר של נוגדנים [1]. לִימְפוֹצִיטִים מסוימים, הנקראים תאֵי B, אחראיים לייצוּר נוגדנים. הנוגדנים נקשרים לנגיף ומשביתים אותו לפני שהוא מצליח להדביק תאים נוספים (איור 1A). תוכלו לדַמות את הנוגדנים כחבורה של שחקני כדורגל שחוסמים את החלוץ של היריב (הנגיף) כדי למנוע ממנו להתקדם עם הכדור.
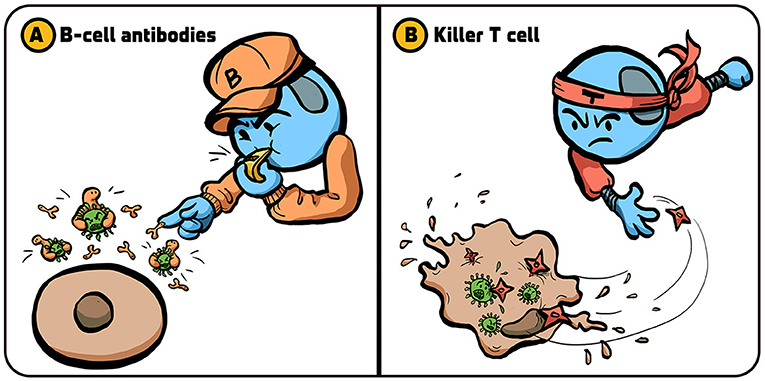
- איור 1 - אסטרטגיות המשמשות את מערכת החיסון במלחמה בנגיפים.
- למערכת החיסון מספר אסטרטגיות להתמודדות עם זיהומים נגיפיים: (A) תאֵי B משחררים חלבונים הנקראים נוגדנים (מעין ”צבתות” קטנות), הנצמדים לנגיפים (מופיעים בציור בירוק) ומונעים מהם לחדור לתאֵי הגוף. (B) תאֵי T ציטוטוקסיים הורגים תאים שנדבקים בנגיפים, ומונעים ייצוּר של נגיפים חדשים שיכולים להדביק תאים נוספים. איור: איריס גת.
- B cell antibodies- תאֵי B המייצרים נוגדנים;
- Killer T cells = תאֵי T ציטוטוקסיים.
האסטרטגיה השנייה של מערכת החיסון היא להרוג תאים הנגועים בנגיפים (איור 1B). אסטרטגיה זו מוֹנעת מִתָאים נגועים לייצר עותקים רבים של הנגיף. הלימפוציטים שהורגים תאים הנגועים בנגיף נקראים תאֵי T לימפוציטיים צִיטוֹטוֹקְסִיים, או בקיצור – תאֵי T ציטוטוקסיים [2]. כאשר תאֵי T ציטוטוקסיים נתקלים בתא הנגוע בנגיף, הם הורגים אותו על ידי יצירת תעלות במֶמְבְּרָנַת התא והפעלת מנגנון להֶרֶס עצמי בתא הנגוע, בתהליף הנקרא אָפּוֹפְּטוֹזִיס (למידע נוסף על אָפּוֹפְּטוֹזִיס, קִראו מאמר זה).
האם זה אני או לא אני?
מערכת החיסון נוקטת באמצעים קיצוניים כמו הֶרֶג תאים, כדי להתמודד עם סכנות אפשריות. איך מערכת החיסון יודעת נֶגֶד אֵילו מִבְנִים עליה לייצר נוגדנים, או אֵילו תאים להרוג? במילים אחרות, איך היא מחסלת זיהומים בלי לפגוע בגוף עצמו? המחקרים מצביעים על כך שזהו איזון עדין שבמרכזו עומדת שאלה מהותית: מה זה אני, או ה”עצמי” (הַתָּאים והמולקולות שלי) לעומת לא-אני, או ”לא-עצמי” (פולשים)? מערכת החיסון חייבת לענות נכונה על השאלה הזאת. כי אם, מצד אחד, מערכת החיסון אינה יודעת לזהות ביעילות את הפולשים, אזי המארח לא יהיה מוגן מפני האיומים הללו. מצד שני, אם מערכת החיסון תזהה בטעות את תאֵי הגוף עצמם כפולשים, היא עלולה לתקוף את הגוף ולגרום לנזק חמוּר. מחלות הנובעות ממערכת חיסון מוטעית שתוקפת את הגוף נקראות מחלות אוֹטוֹאִימוּנִיוֹת, ולרבות מהן אין טיפולים יעילים (החוקרים בודקים כעת את האפשרות שנגיף ה-SARS-CoV-2 הגורם למחלת הקורונה, מעורר צורה נדירה של אוטואימוניות באנשים שנדבקו. אוטואימוניות כזו יכולה להיות אחת הסיבות האפשריות לביטויים ארוכי הטווח של מחלת הקורונה).
קולטן אחד או שני קולטנים?
כשהתחלתי לחקור תאֵי T ציטוטוקסיים בתחילת שנות ה-70 של המאה הקודמת, המדענים טרם הבינו כיצד הלימפוציטים הללו יכולים להבחין בין מה שהוא ”אני” לבין מה שהוא ”לא-אני”. גילינו שתאֵי T ציטוטוקסיים ”מתוכנתים” לפגוע בדרך כלשהי במולקולות ה”עצמי”, שהן חלבוני ההשתלה המוּכָּרים מדחיית השתלות איברים. בעקבות התגלית הזאת, רוב המדענים חשבו שלתאֵי T ציטוטוקסיים יש שני סוגים שונים של קולטנים (חלבונים המזהים מולקולות מסוימות) על פני השטח שלהם: סוג אחד של קולטן שיכול לזהות את מולקולות ה”עצמי”, וסוג אחר שיכול לזהות מולקולות זרות (של נגיפים) – ”לא עצמי” (איור 2A). הרעיון היה שמולקולות ה”עצמי” ומולקולות ”לא עצמי” הן שני סוגים שונים של רכיבים בגוף, שכדי לזהות אותם יש צורך בשני סוגים שונים של קולטנים.
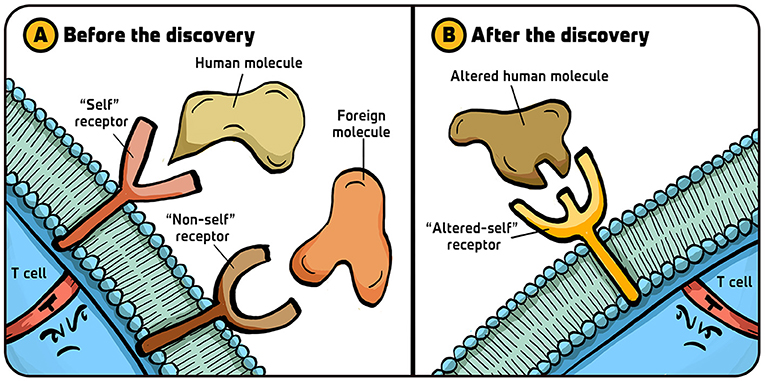
- איור 2 - השערת הקולטנים של תאֵי T קטלניים.
- (A) התגלית שלנו שזכתה בפרס נובל קושרת בין תהליך הזיהוי של תאֵי ה-T הציטוטוקסיים לבין תאֵי ה”עצמי”. לפני פרסום התגלית, הדעה הרווחת בקרב המדענים החוקרים את תאֵי ה-CD4+T ה”מסייעים” הייתה שללימפוציטים אֵלו יש שני סוגי קולטני על פני השטח שלהם: אחד שמזַהֶה את מולקולות הגוף (”עצמי”) ועוד אחד שמזַהֶה מולקולות זרות (”לא-עצמי”). (B) לאחר התגלית שלנו התברר שלכל תאֵי ה-T יש רק קולטן אחד ספציפי מבחינה אימונולוגית, המזהה שינויים במולקולות הגוף (”העצמי השונה”). איור: איריס גת.
- Before the discovery = לפני התגלית;
- After the discovery = אחרי התגלית;
- T cell = תא T; ”Self” receptor = קולטן ”עצמי”;
- ”Non self” receptor = קולטן ”לא-עצמי”;
- Human molecule = מולקולה אנושית;
- ”Altered self” receptor = קולטן ”העצמי השונה”;
- Altered human molecule = מולקולה אנושית שעברה שינוי.
עמיתי, רוֹלְף צִינְקֶרְנָגֶל, ואנוכי טענו שאין שני סוגים של קולטנים, אלא ישנו רק סוג אחד של קולטן על גבי תאֵי ה-T הציטוטוקסיים אשר מזַהֶה שינויים במולקולות ה”עצמי” (איור 2B). רעיון זה פתח צוהר לפרשנות שונה של תורת החיסון (אִימוּנוֹלוֹגְיָה), ואכן בעקבות שיפור בפיתוחים הטכנולוגיים שעמדו לרשותנו בבדיקת הסוגיה, התברר שצדקנו בהשערתנו. לפני שאספר לכם כיצד תאֵי T מזהים פולשים מסוכנים באמצעות קולטן אחד בלבד, הַרשו לי לספר לכם על כמה מנקודות הציוּן החשובות שהובילו אותנו לממצא החשוב הזה.
המסע האישי שלי: מפתרון של מַשְבֵּר המזון העולמי לפענוח הסודות של מערכת החיסון
כשהייתי בן 17 החלטתי ללמוד וטרינריה. זו הייתה החלטה מוזרה כי הייתי ילד עירוני שגדל בקווינסלנד שבאוסטרליה (Queensland, Australia), אך בכל זאת, חשבתי שזו תהיה הרפתקה מעניינת, ושאוּכל לתרום לפתרון של משבר הרעב העולמי על ידי הרבעה טובה יותר של בעלֵי חיים. כיום, בעקבות שינויי האקלים, אנו יודעים שכדי להתמודד עם משבר המזון העולמי עדיף להתמקד במזון מבוסס-צמחים, לפחות במדינות המתקדמות, אבל באותה התקופה חשבנו אחרת. בעת לימודֵי הדוקטורט שלי התעניינתי מאוד בדרך שבה זיהומים גורמים למחלות, ולכן בהמשך לימודיי חקרתי זיהומים בצאן ובבקר.
אחת התגליות המוקדמות שלי התרחשה כשחקרתי זיהום שהתפתח מנגיף במוחן של כבשים. באותה התקופה חֶקֶר תפקידם של הלימפוציטים היה בראשיתו, והמדענים עדיין לא הבינו את מנגנוני הפעולה המדויקים שלהם. באוניברסיטת אֶדִינְבּוּרוֹ שבסקוטלנד (Edinburgh, Scotland) היוג’ רייד (Hugh Reid) ואני הראינו שישנם תאֵי B המייצרים נוגדנים במוחן של הכבשים הנגועות בנגיף, ושתאֵי B אלו מייצרים נוגדנים כדי להילחם בנגיף [3]. זו הייתה העדוּת הישירה הראשונה לכך שברקמה נגועה נמצאים תאים המייצרים נוגדנים. הגילוי הזה עורר בי השראה רבה, ורציתי ללמוד עוד על פעולת תאֵי מערכת החיסון ברקמות.
כשחקרתי את הכבשים באוניברסיטת אדינבורו, הבנתי שעליי להעמיק את ידיעותיי על תאֵי T, ולכן הצטרפתי לקבוצה פעילה מאוד של חוקרים המתמחים בתחום זה באוניברסיטה הלאומית של אוסטרליה בקנברה (Canberra, Australia).
מערכת הניסוי שבחרתי הייתה דלקת מוח לימפוציטית במקלעת הדמים LCMV, (lymphocytic choriomeningitis) בעכברים. מניסיוני במחקרים קודמים, סיגלתי שיטה שבעזרתה אני מגיע לנוזל המוחי-שִׁדְרָתִי שנמצא במוח כדי להשיג את תאֵי הדם הלבנים הדלקתיים, שהיו ברובם תאֵי T הפולשים למוח ולקרומים הסובבים אותו (קרומי המוח) בעקבות זיהום LCMV. למעבדה שלנו הצטרף רוֹלְף צִינְקֶרְנָגֶל (Rolf Zinkernagel), סטודנט לתארים מתקדמים ברפואה מאוניברסיטת באזל . יחד ערכנו את הניסויים שזיכו אותנו כ-20 שנה מאוחר יותר בפרס נובל לפיזיולוגיה או לרפואה.
קולטן אחד שמזהה את ה”עצמי שונה”
רולף ואני ערכנו את הניסוי הבא: הדבקנו עכברי מעבדה ב-LCMV, וכעבור שבוע, כשהתגובה החיסונית שלהם הייתה בשיאה, אספנו מהם את תאֵי ה-T הציטוטוקסיים שהעכברים יִיצרו כדי להילחם בנגיף ה-LCMV (איור 3). את תאֵי ה-T הציטוטוקסיים האלה שמנו במבחנות והוספנו תאים נגועים ב-LCMV מהעכברים כדי לראות את התגובה. תאֵי ה-T הציטוטוקסיים הגיעו מעכברים שונים – חלקם היו בעלי התאמה מולקולרית (הנקראים H2 בעכברים, HLA בבני אדם) לתאים הנגועים ב-LCMV (תאֵי מטרה), ואחרים לא. גילינו שתאֵי ה-T חסינֵי ה-LCMV הזהים ל-H2 הרגו את המטרות הזהות ל-H2 ביעילות רבה, בעוד שהַתָאים הציטוטוקסיים שלא התאימו ל-H2 התעלמו מהם לחלוטין. ממצאים אלו הובילו אותנו למסקנה שלתאֵי ה-T הציטוטוקסיים יש קולטן יחיד המזהה את ”העצמי השונה”, כלומר הקולטן מזהה רק תאים נגועים שמתאימים להם מבחינת מולקולת ההשתלה. בעקבות השערה זו, פיתחנו תֵאוריה חדשה באימונולוגיה על האופן שבו תאֵי T מזהים ומגיבים לזיהומים.
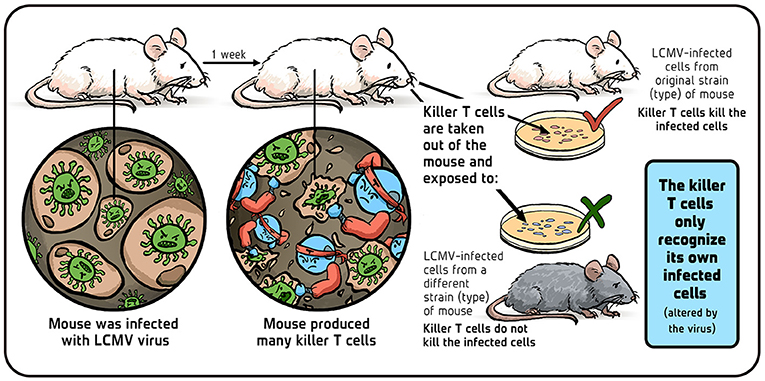
- איור 3 - האם תאֵי T קטלניים תוקפים תאים מזני עכברים שונים?
- מקרא: העכבר הודבק בנגיף ה-LCMV – לאחר שבוע אחד: העכבר יִיצר תאֵי T ציטוטוקסיים רבים – לקחנו תאֵי T ציטוטוקסיים מהעכבר וחשפנו אותם לשני סוגים של תאי עכברים תאים נגועים ב-LMCV מהזן (הסוג) של העכבר המקורי. התוצאה: תאֵי ה-T הציטוטוקסיים הרגו את התאים הנגועים. [ליד העכבר האפור] תאים נגועים ב-LMCV מזן (סוג) אחר של עכבר. התוצאה: תאֵי ה-T הציטוטוקסיים לא הרגו את התאים הנגועים. [במסגרת התכלת]. מסקנה: תאֵי ה-T ציטוטוקסיים זיהו רק את התאים הנגועים של עצמם (ששונו על ידי הנגיף). איור: איריס גת.
במילים אחרות, הנחנו שהנגיף משַנֶה את אחת ממולקולות ה”עצמי” הנורמליות, שהן מולקולות של תאים שאינם נגועים, הדומות בעכברים שזהים מבחינה גנטית ושונוֹת בעכברים שהם שונים מבחינה גנטית. מולקולות ”עצמיות” אלו נמצאות תמיד על פני השטח של תאֵי המארֵחַ, וחשבנו שתאֵי T ציטוטוקסיים מזהים את השינוי שהנגיף מחולל כאות לזיהום, ותגובתם היא הריגת התא הנגוע [4].
כשפיתחנו את התאוריה על תאֵי ה-T, לא היו בידינו הטכנולוגיות המתאימות לניסויים שיאפשרו לנו להוכיח שההשערה שלנו נכונה. אך ההתפתחות הטכנולוגית שהתרחשה בשני העשורים שלאחר מכן אִפשרה לחוקרים אחרים להוכיח שצדקנו [5–8]. באמצעות השיטות החדשות הללו, נמצאו על פני הַתָאים מולקולות ”עצמיות” הנקראות מולקולות המערך הראשי של ההתאמה הרקמתית (major histocompatibility complex, או MHC). כאשר נגיף פולש לתא, חלבוני הנגיף נחתכים ומולקולות ה-MHC מציגות מקטעי נגיפים קטנים על פני התא (איור 4). כאשר מולקולות ה-MHC מחזיקות את חתיכות הנגיף, צורתן משתנה, ותאי ה-T הציטוטוקסיים ”רואים” את השינוי הצורני הזה ומגיבים אליו [9]. במילים אחרות, תאֵי T מזהים תא ”עצמי” נגוע בגלל שמִבנה מולקולת ה-MHC שלו השתנה.
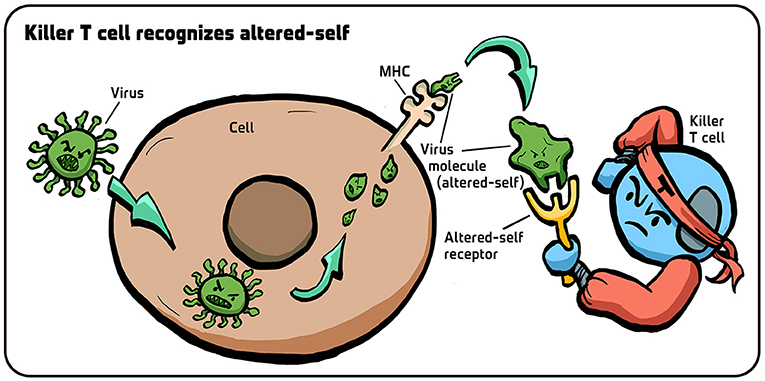
- איור 4 - כיצד תאֵי T מזהים את ”העצמי השונה”?
- כאשר נגיף מדביק תא, החלבונים שלו נחתכים. חתיכות קטנות של הנגיף (מבנים ירוקים קטנים) נישאות לאחר מכן אל פני התא, ומוחזקות על ידי מולקולות MHC. נוכחותם של מקטעי הנגיף הללו על גבי מולקולות ה-MHC משַנֶה את המבנה של מולקולות ה-MHC. הקולטנים בתאֵי ה-T הציטוטוקסיים מזהים את הצורה השונה הזאת (”העצמי השונה”), וכך מבינים שהתא נגוע. איור: איריס גת.
- Killer T cellrecognizes altered-self = תא T ציטוטוקסי מזהֶה ”עצמי שונה”;
- Virus molecule(altered-self) = מולקולה של נגיף (”העצמי השונה”);
- Altered-self receptor = קולטן של ”העצמי השונה”;
- Killer T cell = תא T ציטוטוקסי.
כשהתברר שהתאוריה שלנו נכונה, היא גרמה לשינוי מהותי בהבנה של דרך פעולתם של תאֵי T, המהווים נדבך מרכזי במערכת החיסון.
כיצד הממצאים שלנו יכולים לשפר את בריאות האדם?
ההבנה שלנו לגבי דרכי הפעולה של תאֵי T ציטוטוקסיים יכולה להועיל בכמה תחומים ברפואה. ראשית, זהו יֶדע שיכול לעזור לנו לשפר חיסונים. כעת אנו יודעים שמערכת החיסון מזהָה חלקי נגיפים המוצגים על ידי מולקולות MHC, אנו מקווים לכלול מִגוון רחב של חלקים מהנגיף, וכך לשפר את החיסונים שלנו. ככל שהחיסון מכיל מֵגוון גדול יותר של חלקים שונים של הנגיף, כך קל יותר לעורר תגובה חזקה של תאֵי T ציטוטוקסיים. חיסוני הקורונה (COVID-19), למשל, מכילים פיסות של חלבון אחד בלבד (הנקרא חלבון ספייק), בעוד שלנגיף יש יותר מ-20 חלבונים שונים שפוטנציאלית יכולים לעורר תגובות של תאֵי T ציטוטוקסיים.
ריכזתי הרבה ממאמציי גם בניסיון להבין את טבעם של תאֵי ה-T ה”רדומים”, הנקראים תאי T זכרון. אלו הם תאֵי הגנה הזוכרים שהם תאֵי T ציטוטוקסיים אִם המארֵחַ נדבק שוב בנגיף. מדענים אחרים מצאו כיצד ”להעיר” תאי T ציטוטוקסיים שהתמקמו בתוך תאֵי סרטן, אך ככל הנראה ”נרדמו” (כך פועלים טיפולים אנטי-סרטניים מסוימים שעליהם תוכלו ללמוד עוד כאן [10]). הידע הזה יכול להועיל גם בטיפולים חדשים למחלות אוטואימוניות, שבהם נוכל למצוא דרכים להחזיר את האיזון לתאֵי T ולתאֵי B סוררים שתוקפים את תאֵי הגוף עצמו.
המלצות למוחות צעירים
לדעתי הכשרה מדעית היא חשובה, גם אם בסופו של דבר לא תהיו מדענים פעילים, כיוון שכך תלמדו איך להתמודד עם סוגיות ועם נתונים (איור 5), איך לנסח טיעונים, ואיך תוכלו לכתוב ולתווך בצורה ברורה את המחשבות ואת הרעיונות שלכם. אלו מיומנויות חשובות שמועילות במקרים רבים בחיים.

- איור 5 - שלוש המלצות למוחות צעירים.
- (A) חִשבו על בעיה לעומק. (B) המדע הוא מעֵין מגרש משחקים גדול מאוד. (C) אם משהו מרתק אתכם – קדימה! צְאוּ וְלִמְדוּ! איור: איריס גת.
אם אתם באמת רוצים להיות מדענים, ובמיוחד אם אתם מתעניינים בביולוגיה, אז יש לי כמה חדשות טובות בשבילכם. ראשית, יש עוד הרבה מה לגלות בתחום הזה. שנית, תחום הביולוגיה, ובמיוחד המחקר הביו-רפואי, מציעים הזדמנויות נהדרות לאנשים בעלי כישורים מגוּוָנים וגישות שונות. יש אנשים שהם כישרוניים במחשבים שרוצים ליצור מערכות המנתחות נתונים ומוצאות את הַקשרים ביניהם. אחרים רוצים לבצע ניסויים מחשבתיים ולנסח רעיונות ותיאוריות חדשות. אנשים עם כישורֵי ניהול טובים או בעלי יכולת לפתח מוצר יכולים גם הם לפרוח במחקר ביו-רפואי. המדע הוא ”מגרש משחקים” גדול מאוד המקדם בברכה אנשים עם סוגים רבים של יכולות. אלו מכם שנהנים לפתור חידות עשויים ליהנות במיוחד מקריירה במדע.
העצה האחרונה שלי אליכם היא: אם משהו מרתק אתכם – קדימה! התעמקו ככל יכולתכם בדבר ועשו הכול כדי להתמיד בו. לעולם איננו יודעים לאן תחומי העניין שלנו עשויים להוביל אותנו. במהלך המסע הזה תוכלו לפתח דרכי חשיבה ייחודיות שישרתו אתכם בכל מקום שאליו תגיעו. לכן, אל תראו את חוסר הוודאות שהחיים מזמנים כדבר מייאש; הֱיוּ בטוחים בכישורים שלכם וסִמכו על כך שתהיה לכם הזדמנות להשתמש בהם בדרכים מפתיעות.
חומרים נוספים
- How the Innate Immune System Fights for Your Health
- The Immune System, in Sickness & in Health—Part 1: Microbes and Vaccines
- Types of immune responses: Innate and adaptive, humoral vs. cell-mediated | NCLEX-RN | Khan Academy
- .Doherty, P. (2006). The Beginner’s Guide to Winning the Nobel Prize: Advice for Young Scientists. Columbia University Press
מילון מונחים
מערכת החיסון (Immune System): ↑ מערכת ההגנה של הגוף השומרת עלינו מפני זיהומים ומחלות מסוימות.
תאֵי דם לבנים (White Blood Cells): ↑ השחקנים העיקריים במערכת החיסון, המסייעים לגוף להילחם בזיהומים.
נוגדנים (Antibodies): ↑ חלבונים הנצמדים לנגיפים ומנטרלים אותם.
לִימְפוֹצִיטִים (Lymphocytes): ↑ תאֵי דם לבנים האחראיים על ייצוּר נוגדנים והֶרֶג תאים נגועים. תאי B ותאי T הם לימפוציטים.
תאֵי T לימפוציטיים צִיטוֹטוֹקְסִיים (Cytotoxic T Lymphocytes): ↑ נקראים גם תאֵי T ציטוטוקסיים; תאֵי דם לבנים שהורגים תאים הנגועים בנגיף.
אָפּוֹפְּטוֹזִיס (Apoptosis): ↑ תהליך ”התאבדות” של תאים שמטרתו להיפטר מִתָאים פגומים או נגועים.
מחלות אוֹטוֹאִימוּנִיוֹת (Autoimmune Diseases): ↑ מחלות שבהן הגוף מותקף על ידי מערכת החיסון שלו עצמו.
קולטנים (Receptor): ↑ חלבון על פני התא הנקשר למולקולה מסוימת התואמת את צורתו, ומעורר תגובה תאית.
תורת החיסון (אִימוּנוֹלוֹגְיָה) (Immunology): ↑ חקר אופן פעולתה של מערכת החיסון.
המערך הראשי של ההתאמה הרקמתית (MHC) (Major Histocompatibility Complex): ↑ מולקולות ”עצמיות” שנמצאות על גבי תאים.
תודות
ברצוננו להודות לפרופ’ סטפן יונג על הערותיו החשובות לכתב היד, לאיריס גת עבור האיורים ול-Susan Debad על העריכה הלשונית של כתב-היד.
הצהרת ניגוד אינטרסים
המחברים מצהירים כל המחקר נערך בהעדר כי קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Johnson, A., Lewis, J., Raff, M., Roberts, K., and Walter, P. 2002. Molecular Biology of the Cell. New York, NY: Garland Science p. 4.
[2] ↑ Andersen, M. H., Schrama, D., thor Straten, P., and Becker, J. C. 2006. Cytotoxic T cells. J. Investig. Dermatol. 126:32–41. doi: 10.1038/sj.jid.5700001
[3] ↑ Doherty, P. C. 1970. Studies in the experimental pathology of louping-ill encephalitis (Doctoral dissertation). Edinburgh: University of Edinburgh.
[4] ↑ Zinkernagel, R. M., and Doherty, P. C. 1979. MHC-restricted cytotoxic T cells: studies on the biological role of polymorphic major transplantation antigens determining T-cell restriction-specificity, function, and responsiveness. Adv. Immunol. 27:51–177. doi: 10.1016/S0065-2776(08)60262-X
[5] ↑ Townsend, A. R. M., Rothbard, J., Gotch, F. M., Bahadur, G., Wraith, D., and McMichael, A. J. 1986. The epitopes of influenza nucleoprotein recognized by cytotoxic T lymphocytes can be defined with short synthetic peptides. Cell 44:959–68. doi: 10.1016/0092-8674(86)90019-X
[6] ↑ Brown, J. H., Jardetzky, T., Saper, M. A., Samraoui, B., Bjorkman, P. J., and Wiley, D. C. 1988. A hypothetical model of the foreign antigen binding site of class II histocompatibility molecules. Nature 332:845–50. doi: 10.1038/332845a0
[7] ↑ Garcia, K. C., Degano, M., Stanfield, R. L., Brunmark, A., Jackson, M. R., Peterson, P. A., et al. 1996. An αβ T cell receptor structure at 2.5 Å and its orientation in the TCR-MHC complex. Science 274:209–19. doi: 10.1126/science.274.5285.209
[8] ↑ Garboczi, D. N., Ghosh, P., Utz, U., Fan, Q. R., Biddison, W. E., and Wiley, D. C. 1996. Structure of the complex between human T-cell receptor, viral peptide and HLA-A2. Nature 384:134–41. doi: 10.1038/384134a0
[9] ↑ Wieczorek, M., Abualrous, E. T., Sticht, J., Álvaro-Benito, M., Stolzenberg, S., Noé, F., et al. 2017. Major histocompatibility complex (MHC) class I and MHC class II proteins: conformational plasticity in antigen presentation. Front. Immunol. 8:292. doi: 10.3389/fimmu.2017.00292
[10] ↑ Leach, D. R., Krummel, M. F., and Allison, J. P. 1996. Enhancement of antitumor immunity by CTLA-4 blockade. Science 271:1734–6. doi: 10.1126/science.271.5256.1734
