תַקצִיר
נגיפים, או בשמם הלועזי, וירוסים, הם מערכות ביולוגיות ייחודיות. אלו הם טפילים המשתמשים בתאים של אורגניזמים אחרים, המכונים מארחים, כדי להתרבּוֹת. לעיתים קרובות, נגיפים אף גורמים למארחים לחלות. ישנם נגיפים בעלי מאפיין מעניין ביותר – החומר הגנטי שלהם הוא רנ''א, בעוד כל שאר האורגניזמים המוכרים לנו משתמשים בדנ''א. בתחילת הקריירה שלי חקרתי נגיפי רנ''א, וניסיתי להבין את התהליכים ואת ההתנהגויות הבסיסיים שלהם. כשהתמקדתי בנגיפי רנ''א הידועים כמחוללי סרטן, גיליתי כי הם יכולים לייצר דנ''א מגֶּנוֹמִי הרנ''א שלהם, בתהליך המכונה 'שִׁעֲתוּק לאחור'. זו הייתה תגלית משמעותית ששינתה את דרך המחשבה הרווחת, והשפיעה באופן מרחיק לכת על תחומי הביולוגיה, הרפואה והביוטכנולוגיה. במאמר זה, אספר לכם על נגיפים ועל אודות גילוי השעתוק לאחור. כמו כן אתאר כמה השלכות חשובות שהיו לממצאינו, השלכות שתרמו לשיפור חיי אדם רבים, ואפילו להצלתָם.
פרופסור דייוויד בּוֹלְטִימוֹר זכה בפרס נובל לפיזיולוגיה או לרפואה לשנת ,1975 במשותף עם פרופ' רֶנָאטוֹ דוּלְבֶּקוֹ ופרופ' הווארד מרטין טֶמִין, על תגליותיהם הנוגעות לאינטראקציה בין נגיפים מחוללי גידולים לחומר הגנטי של התא.
עולמם המרתק של הנגיפים
נגיפים הם חלקיקים קטנים המדביקים תאים, ולעיתים מחוללים מחלות. מספרם של הנגיפים עצום ואינו ניתן למנִייה. לכל יצור חי, ואפילו לכל חיידק, יש מַעֲרַךְ נגיפים משלו. עד כה זוהו יותר ממיליון סוגים שונים של נגיפים! אתם ודאי מכירים כמה מהם, כמו נגיף הַשַּׁפַּעַת שמחולל את מחלת השפעת; נגיף סַארְס-קוֹב-2 הגורם לקוֹבִיד-19 (מחלת נגיף קורונה 2019), ונגיף הוָורִיצֶלָה-זוֹסְטֶר, הגורם לאבעבועות רוח. אולי שמעתם על נגיף הַכֶּשֶׁל החיסוני האנושי (HIV), הגורם למחלת האיידס, או על נגיף האֶבּוֹלָה. הנגיפים שונים מאוד במבנה (רְאו איור 1) במספר הזנים שהם יכולים להדביק (כלומר אם ביכולתם להדביק רק זן מסוים או כמה זנים), ובמידת הסיכון שהם מהווים לאורגניזמים שהם מדביקים, המכונים 'מארחים'.
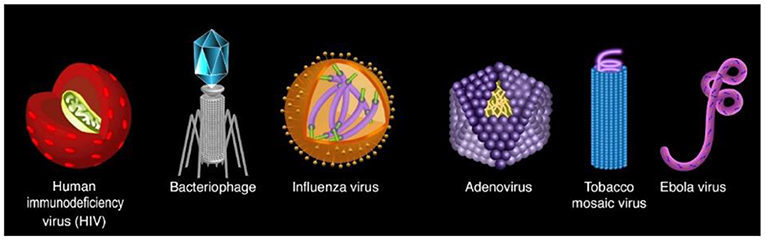
- איור 1 - סוגי הנגיפים השונים.
- נגיפים קיימים במִּגוון צורות. לכל חיה ולכל חיידק מַעֲרַךְ נגיפים משלהם (התמונה נלקחה מכאן). מקרא (משמאל לימין): נגיף הכשל החיסוני האנושי (HIV) – בָּקְטֶרְיוֹפָאג' (נגיף התוקף חיידק) – נגיף השפעת – נגיף אָדֶנוֹ (גורם לזיהום בדרכי הנשימה) – נגיף מוֹזָאיקַת הַטַּבָּק (פוגע בצמחים) – נגיף האֶבּוֹלָה (מחלה קטלנית מידבקת).
כדי להתרבּוֹת, הנגיפים חודרים לתא המארח ומכניסים אליו את החומר הגנטי שלהם. בדרך זו, הם גורמים לתא להתייחס לחומר הגנטי שלהם כאל שלוֹ, ו'משעבדים' את התא המארח במִּרמה, כך שייצר עותקים רבים של הנגיף. הנגיפים מתרבים במהירות מסחררת – בתוך 30-20 דקות בחיידקים, ובתוך שעות ספורות ביונקים, ובכלל זה בני אדם. הם מתפשטים כשהם עוברים ממארח אחד לאחר. לדוגמה, ישנם נגיפים שיכולים לעבור בין בני אדם בעיטוש, או כשמישהו נוגע במִּשטח שאדם שנושא את הנגיף נגע בו קודם לכן. אנו יכולים להגן על עצמנו מפני נגיפים מסוימים בעזרת חיסונים, וקל יותר להתמודד עם נגיפים המדביקים רק בני אדם.
כפי שאתם אולי יודעים, דנ''א הוא מולקולה הנושאת את המידע הגנטי במערכות חיות. לדנ''א יש 'קרוב משפחה' בשם רנ''א. הוא מְתפקד כעותק נייד של המידע הקיים בדנ''א, ומאפשר ייצור של חלבונים (כדי ללמוד עוד על אודות דנ''א, רנ''א וחלבונים, קִראו את המאמר מתוך אוסף הנובל על אודות פירוק ממוקד של חלבונים, ואת המאמר מתוך אוסף הנובל על אודות שִחְבּוּר רנ''א). החומר הגנטי של כל האורגניזמים בממלכת החיות הוא דנ''א. נגיפים הם יוצאי דופן כיוון שבסוג מסוים של נגיפים, המכונה נגיפי רנ''א, החומר הגנטי הוא רנ''א (ישנהּ סְבָרָה שלפיה הנגיפים הם שרידים של עולם קדום יותר, שבו רנ''א שימש בתור החומר הגנטי. קִראו כתבה זו כדי ללמוד עוד על אודות עולם הרנ''א הקדום הזה). נגיפי דנ''א ונגיפי רנ''א משתמשים בחומר הגנטי שלהם בדרכים שונות כדי לייצר סוג מסוים של רנ''א בשם רנ''א שָׁלִיחַ (mRNA) [1], המשמש לייצור חלבונים. במסגרת מחקרי יצרתי מערכת סיווג לנגיפים המכונה סיווג בולטימור. מערכת זו ממיינת נגיפים לפי הדרך שבה הם מייצרים רנ''א שליח. במסגרת סיווג זה, ישנם שני סוגים של נגיפי דנ''א המשתמשים בדנ''א בלבד לייצור רנ''א שליח (קבוצות I ו-II); שלושה סוגים של נגיפי רנ''א המשתמשים ברנ''א בלבד לייצור רנ''א שליח (קבוצות III, IV ו-V), ושתי קבוצות של נגיפים המשתמשים הן בדנ''א הן ברנ''א לייצור רנ''א שליח (קבוצות VI ו-VII) [2, 1].
חוקרים את נגיפי רנ''א
כשהתחלתי את הקריירה המדעית שלי בשנות ה-60' של המאה הקודמת, רציתי לחקור את הכימיה היסודית של החיים. הבנתי שהנגיפים מְספקים הזדמנות מיטבית לעשות זאת, כיוון שהם האורגניזמים הפשוטים ביותר בעולם. יכולנו לחקור את הנגיפים ולהבין את מגנוני הפעולה שלהם בפירוט – עד לרמה המולקולרית.
בתקופה ההיא, ידענו מעט מאוד על אודות הדרך שבה נגיפי הרנ''א מתרבים. בתחילה, חקרתי נגיף רנ''א דמוי נגיף הפּוֹלְיוֹ (שיתוק ילדים), שגדֵּל בעכברים (קבוצה IV לפי סיווג בולטימור, דומה למדי לנגיף סארס-קוֹב-2). ניסיתי להבין איך הנגיף הזה מתרבה, וכיצד הוא משפיע על חיי המארח. פענחתי את מנגנון ההתרבות של הנגיף, ואז הרחבתי את הממצאים לנגיפי רנ''א אחרים. לאורך התהליך גיליתי כמה חלבונים חשובים, המכונים אֶנְזִימִים, היוצרים את הדנ''א ואת הרנ''א [3, 4].
בסביבות 1970, התחלתי לתהות אם ייתכן שנגיפי הרנ''א מתרבים בדרכים אחרות, שאינן מוכרות לנו. התעניינתי במיוחד בנגיפי רנ''א הגורמים למחלת הסרטן, אשר מכונים נגיפי רנ''א מחוללי גידול. כשהתחלתי לחקור את הנגיפים הללו, לא ידעתי איזו הפתעה גדולה צופן לי העתיד.
שִׁעֲתוּק לאחור
בשנות ה-60' של המאה ה-20, עמיתִי, פרופ' הווארד טֶמִין, הציג את ההשערה שלפיה נגיפי רנ''א מחוללי גידול יכולים לשעתק דנ''א מהרנ''א שלהם. לאף אחד לא היו ראָיות ברורות כי זה המצב, ורבים לא האמינו לכך. התפיסה שרווחה אז (המכונה 'הדּוֹגְמָה המרכזית של הביולוגיה המולקולרית', להלן: 'הדּוֹגמה') הייתה שרנ''א מיוצר מדנ''א (בתהליך המכונה שִעתוּק), ולא להפך (רְאו איור 2). אף על פי כן, לא היה שום דבר בלתי אפשרי בשעתוק של רנ''א לדנ''א, כיוון ששניהם מולקולות דומות מאוד, המיוצרות באופן דומה. ב-1970, החלטתי לבדוק את ההשערה שלפיה ייתכן כי רנ''א משועתק 'חזרה' לדנ''א. כדי לעשות זאת, פתחתי את נגיפי הרנ''א מחוללי הגידול, והוספתי מולקולות רדיואקטיביות של קְדַם-דנ''א (רְאו מסגרת 1). אלו הן אבני הבניין המאפשרות לנו לזהות נוכחות של כל דנ''א שנוצר בדגימה מסוימת, היות שהדנ''א הזה הופך רדיואקטיבי. בתוך כמה ימים מתחילת הניסוי עלה בידי להראות כי דגימת נגיפי הרנ''א מחוללי הגידול הצליחו לייצר דנ''א [4].
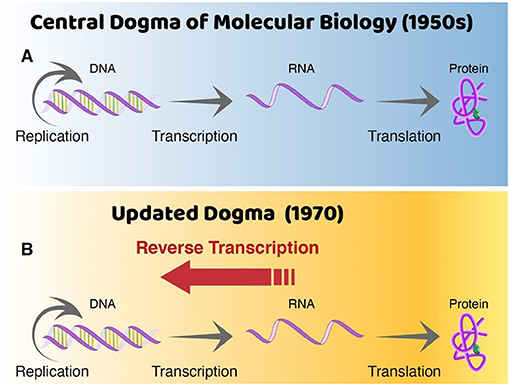
- איור 2 - שינוי בדּוֹגְמָה.
- (A) לפני שהשעתוק לאחור התגלה, האמינו כי רנ''א יכול להיות מיוצר מדנ''א בתהליך השעתוק. עם זה הדעה הרווחת בקרב המדענים הייתה כי לא ניתן לייצר דנ''א מרנ''א. (B) התגלית שלי ב-1970 הראתה שאפשר לייצר דנ''א מרנ''א, בתהליך המכונה 'שעתוק לאחור'. ממצא זה שינה את אחד הרעיונות (דּוֹגְמות) הבסיסיים בביולוגיה המולקולרית. שכפול דנ''א – התהליך של יצירת שתי מולקולות דנ''א זהות ממולקולת דנ''א מקורית. מקרא: (A) הדּוֹגְמָה המרכזית של הביולוגיה המולקולרית (שנות ה-50' של המאה ה-20); (B) הדּוֹגְמָה המעודכנת Replication = שכפול Transcription = שעתוק Translation = תרגום Protein = חלבון Reverse Transcription = שעתוק לאחור.
מסגרת 1. מציאת דנ''א בתוך נגיפי רנ''א מחוללי גידול.
כך ביצעתי את התהליך לגילוי דנ''א באמצעות קְדַם-דנ''א רדיואקטיבי: קניתי נוּקְלֵאוֹטִידִים מוכנים (אבני הבניין של הדנ''א – C, T, A ו-G), מסומנים באמצעות מימן רדיואקטיבי. הנחתי את הנגיף ואת הנוקלאוטידים המסומנים במבחנה, והשתמשתי בדטרגנט כדי לפרק את קרום התא השומני המְּכסה את הנגיף. זה אִפשר לנוקלאוטידים המסומנים לבוא במגע עם הרנ''א של הנגיף ועם אֶנְזִים הטְרַנְסְקְרִיפְּטָז (שעתוק) ההוֹפְכִי, שיוצר דנ''א מרנ''א בתהליך השעתוק. הוספתי מַגְנֶזְיוּם, הדרוש לפעולת האנזים, והנחתי את המבחנה באמבט מים בטמפרטורה של 37 מעלות צלזיוס. האנזים בנה דנ''א רדיואקטיבי מהנוקלאוטידים המסומנים. השתמשתי במסננת כדי להפריד את מולקולות הדנ''א הארוכות משאריות הנוקלאוטידים המסומנים, וכשהפעלתי את גלאי הקרינה, גיליתי כי מולקולות הדנ''א היו רדיואקטיביות! כדי להוכיח שהמולקולה אכן הייתה מולקולת דנ''א, השתמשתי באנזים בשם Dnase, המְּפרק דנ''א. כשהוספתי את האנזים הזה לתוצרי התגובה וסיננתי אותם שוב באמצעות המסננת, לא קיבלתי אות רדיואקטיבי. זה הוכיח כי החומר שבדקתי בתגובה המקורית בהחלט היה דנ''א.
הממצאים שלי הצביעו על כך שנגיפי הרנ''א מחוללי הגידול יכולים לייצר דנ''א מגֶּנוֹם הרנ''א שלהם, כיוון שלא היה מקור אפשרי אחר של דנ''א בניסוי. הראיתי גם שאם אנו מוציאים את הרנ''א מהדגימות, אין בהן דנ''א. זו הייתה תגלית ענקית של התהליך שזכה לשֵּׁם שִׁעֲתוּק לאחור(reverse transcription). עבור תגלית זו זכיתי, במשותף עם פרופ' רֶנָאטוֹ דוּלְבֶּקוֹ ופרופ' הווארד מרטין טֶמִין, בפרס נובל לפיזיולוגיה או לרפואה לשנת 1975 – חמש שנים בלבד לאחר שערכתי את הניסויים.
אֶנְזִים חדש הממיר רנ''א לדנ''א
כשגיליתי את השעתוק לאחור, היה ידוע כי אנזימים הם המעתיקים את הרנ''א ואת הדנ''א. לכן היה לי ברור שבחלקיקי הנגיף נכח אֶנְזִים. באותה עת, לא ידענו איזה אנזים ממיר רנ''א לדנ''א, ולא הבנו את התהליך שאנזים זה מְבצע. עמיתיי ואני השקענו עשר שנים נוספות במטרה לגלות איזה אנזים היה אחראי לשעתוק לאחור, ולפענח את המנגנון המורכב של יצירת עותק של דנ''א מרנ''א. כדי לעשות זאת, פיתחנו מערכת חדשנית שבה יכולנו להוסיף מולקולות ידועות מראש של רנ''א, ולבחון מה נוצר מהן. מערכת זו אפשרה לנו להתבונן בתגובות כימיות שאף אחד לא ראה בעבר. מצאנו את האנזים שמייצר עותקים של דנ''א מרנ''א, וקראנו לו 'טְרַנְסְקְרִיפְּטָאז הוֹפְכִי' (reverse transcriptase) [5]. כמה שנים לאחר שגילינו את האנזים הזה, מדענים מקבוצות מחקר אחרות גילו את המבנה שלו בעזרת שיטת דימוּת בשֵׁם 'קְרִיסְטָלוֹגְרָפְיָה בקרני רנטגן' (כדי להרחיב את ידיעותיכם על אודות שיטה זו והתפתחותה, קִראו את מאמר אוסף הנובל הזה). המדענים הללו גילו כי לאנזים הטְרַנְסְקְרִיפְּטָז ההוֹפְכִי מבנה דמוי כף יד עם 'אצבעות', ובכלל זה 'אגודל' בעל יכולת תנועה המסוגל להיפתח ולהיסגר, ואזור מרכזי בשם 'האתר הפָּעיל', שבו דנ''א מיוצר מרנ''א (איור 3).
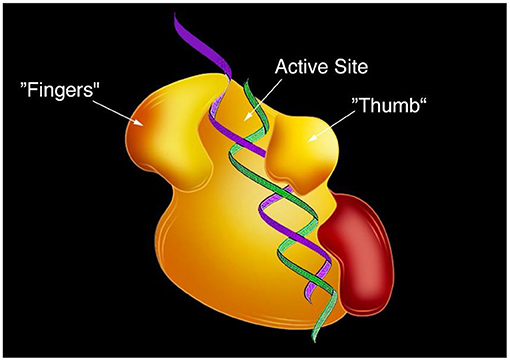
- איור 3 - המִּבנה של אנזים הטְרַנְסְקְרִיפְּטָז ההוֹפְכִי.
- מבנהו של הטְרַנְסְקְרִיפְּטָז ההוֹפְכִי דומה בצורתו לכף יד בעלת 'אצבעות' (Fingers), ו'אגודל' (Thumb) אשר לו יכולת תנועה, ומסוגל להיפתח ולהיסגר. באזור המרכזי של האנזים יש אתר פעיל (Active site), שבו דנ''א מיוצר מרנ''א [נלקח ממקור [6]].
טיפולים חדשים לזיהומים נגיפיים ולסרטן
תגליתנו לגבי השעתוק לאחור והטְרַנְסְקְרִיפְּטָאז ההופכי היא בעלת השלכות מרחיקות לכת – הן מבחינת הבנתנו של תהליכים מולקולריים בסיסיים בתאים והן בהיבט טיפול במחלות. ראשית, התגלית שלנו סללה את הדרך להבנַת נגיפים מסוג מסוים, המכונים רֶטְרוֹ-וִירוּסִים. אלה הם נגיפי רנ''א שעושים שימוש בשעתוק לאחור כדי ליצור דנ''א נגיפי מרנ''א נגיפי. אז, הדנ''א הנגיפי מוטמע (מוכנס) בדנ''א של התא המארח (בעזרת אנזים אחר שנקרא אִינְטֶגְרָאז). כך הוא הופך לחלק מהחומר הגנטי של התא המארח (איור 4). לאחר שהדנ''א הנגיפי מוטמע בדנ''א של המארח, המארח מייצר חלבונים נגיפיים היוצרים חלקיקים חדשים של הנגיף.
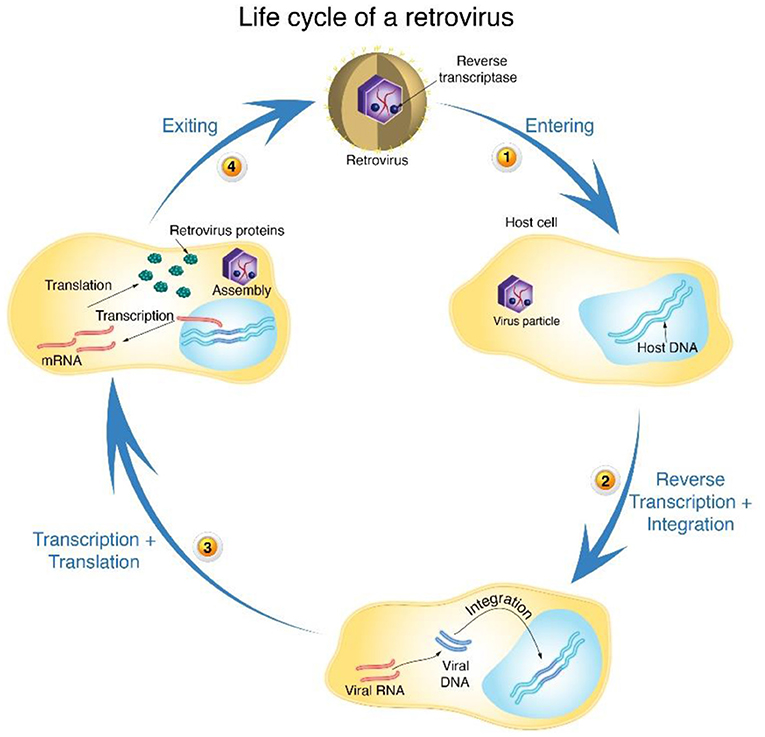
- איור 4 - iמחזור חייו של רֶטְרוֹ-וִירוּס (Life cycle of retrovirus).
- (1) רטרו-וירוס נכנס (Entering) לתא המארח (Host cell), וּמַשִּׁיל את המעטפת החיצונית שלו. (2) הרטרו-וירוס משתמש בשעתוק לאחור (Reverse Transcription) כדי ליצור דנ''א נגיפי (Viral DNA) מגֶנוֹם הרנ''א שלו. אז, הדנ''א הנגיפי נטמע Integration בגנום של התא המארח, והופך חלק מהדנ''א של המארח. (3) לאחר ההטמעה, המארח משׁעתק (Transcription) רנ''א שליח (mRNA) מהדנ''א הנגיפי, ואז מתרגם (Translation) את הרנ''א שליח הנגיפי, במטרה לייצר חלבונים ויראליים (Retrovirus proteins) שלאחר מכן יוצרים (Assembly) חלקיקי נגיף חדשים. (4) הנגיפים החדשים מדביקים תאים אחרים (האיור נלקח מאיור של פרופ' דייוויד בולטימור). מקרא: Host DNA = דנ''א של המארח Virus particle = חלקיקי נגיף Viral RNA = רנ''א נגיפי Exiting = יציאה.
נגיף HIV (ראשי תיבות של Human immunodeficiency virus – נגיף הַכֶּשֶׁל החיסוני הנרכש) הגורם למחלת האיידס, הוא רטרו-וירוס מוכר ובעייתי ביותר (כדי ללמוד עוד על אודות HIV ואיידס, קִרְאו את מאמר אוסף הנובל הזה). נגיף HIV התגלה לראשונה ב-1983, כשנתיים לאחר שמחלת האיידס הייתה למגפה עולמית. הנגיף זוהה הודות לטרנסקריפטאז ההופכי שלו, וכך פותחו תרופות לטיפול במחלת האיידס. לולא היינו מגלים את הטרנסקריפטאז ההופכי ב-1970, כעשׂור לפני התפרצות האיידס, כנראה שלא היה ביכולתנו לגלות את הנגיף, והיינו משקיעים זמן רב בניסיון להבין מדוע המחלה מתרחשת. התגלית המהירה יחסית של נגיף HIV הצילה ושיפרה את חייהם של אנשים רבים, שהיו ודאי סובלים הרבה יותר לוּ מחלת האיידס הייתה מתפרצת לפני גילוי השעתוק לאחור.
התגלית שלנו גם מילאה תפקיד מרכזי בטיפול בסרטן. לפניה, לא ידענו מדוע וכיצד נגיפי רנ''א גורמים לסרטן. במחלת הסרטן לסוגיה השונים, גדילת התאים משתנה מגדילה מבוקרת לגדילה בלתי מבוקרת. זו יוצרת לעיתים גושים גדולים, הנקראים גידולים, ברקמות הגוף, או מתבטאת בגדילה מהירה של תאים בדם, כמו במקרה של לוֹקֶמְיָה (סרטן הדם). כיוון שמולקולת הרנ''א אינה יציבה באופן כללי, לא סברנו שהיא יכולה לגרום לשינוי קבוע בהתנהגות התא. לעומת זאת הדנ''א היא מולקולה יציבה מאוד. גילינו כי נגיפי הרנ''א מחוללי הגידול מְבצעים שעתוק לאחור ויוצרים עותקי דנ''א מהרנ''א שלהם, ובכך הופכים עצמם לגֶּנים בתאים שהם מדביקים. אז, הנגיפים מביאים גנים חדשים לתוך התא, והגנים הללו מייצרים חלבונים. החלבונים הנגיפיים יכולים 'לעקוף' את הגֶּנים של המארחים, להכריח את התא לגדול ולהתחלק בצורה מתמדת, וכך להפוך את התא הנגוע לתא סרטני.
הַקֶּשֶׁר בין סרטן לגֶּנים, שאותו גילינו כשחקרנו את נגיפי הרנ''א מחוללי הגידול, התברר כתהליך חשוב מאוד בהתפתחות הסרטן. התגלית שלנו הציגה תרחיש מסוים לדברים המשתבשים בתאים סרטניים, והסתבר שהוא נכון לסוגים רבים של סרטן, ולא רק לסוגים הנגרמים על ידי נגיפים. ההשׁערה שהעלינו, שלפיה סרטן עלול להיות בעיה גנטית, הביאה להרחבה של חֵקֶר הסרטן, והובילה לגילוי תרופות מצילות חיים, לרבּוֹת 'סם הפלא' הנקרא גְלִיבֶק, שחוסם חלבון מסוים המסמן לתאים כי עליהם לגדול. פיתוח התרופות הללו התבסס על ההבנה שלפיה גֶּן מסוים גורם לסוג מסוים של סרטן. כשאנו יכולים לדכא את פעולתו של חלבון מסוים המיוצר מאותו הגֶּן, ביכולתנו לדכא את הסרטן.
שימושים בביוֹטכנולוגיה ובריפוי גֶּנִי
תגליתנו אף סייעה לקדֵּם את תחום הבִּיוֹטכנולוגיה, שבו לעיתים קרובות מייצרים חלבונים המשמשים ליישׂומים שונים, ובכלל זה לתרופות. אחת השאלות הראשונות ששאלנו לאחר שגילינו את הטרנסקריפטאז ההופכי, הייתה: האם הוא יכול להעתיק כל רנ''א, או רק רנ''א נגיפי? התברר כי הטרנסקריפטאז ההופכי יכול לייצר עותקים של דנ''א מכל רנ''א, אם מְספקים לו חתיכה קטנה של דנ''א המתאים לרנ''א שאנו רוצים להעתיק, בתור 'מַתְנֵעַ'. המשמעות הייתה כי באפשרותנו להפוך כל רנ''א שליח – המהווה את התבנית לייצור החלבון – לדנ''א, וכך למעשה להפוך אותו לגֶּן. מרגע שרנ''א שליח זה מתקיים כגֶן, אנו יכולים להניח אותו בתאים (כמו חיידקים), שיכולים לייצר ממנו עותקים רבים של רנ''א שליח, ולאחר מכן חלבונים. היכולת להפוך כל רנ''א שליח לדנ''א ואז לייצר עותקים רבים של החלבון הרצוי הייתה בשׂוֹרה מהפכנית עבור תעשיית הבִּיוֹטכנולוגיה, והובילה לפיתוח מִגוון תרופות חדשות.
בריפוי גֶּני, משתמשים בדרך כלל ברטרו-וירוסים ככלי לריפוי מחלות גנטיות [7]. אחת הדוגמאות המוצלחות ביותר לריפוי גני באמצעות רטרו-וירוסים היא במקרה של 'מחלת ילד הבועה', או בשמהּ הרשמי, כֶּשֶׁל חיסוני משולב חמור (Severe combined immunodeficiency, SCID). לתינוקות שנולדים עימה אין מערכת חיסונית מְתפקדת, ולכן כל זיהום הוא קטלני עבורם. בעבר, היה על התינוקות הללו לִחְיות בבועות פלסטיק שהפרידו אותם מהסביבה החיצונית כדי שלא יֶחלו. כיום, ריפויִים גניים חדשניים באמצעות רטרו-וירוסים שמחליפים את הגנים הפגומים בגנים מְתפקדים, יכולים לשקם את המערכות החיסוניות של תינוקות חולים ולאפשר להם לחיות חיים רגילים.
במקור, לא התמקדתי בחֵקֶר מחלות ובניסיון לרפא אנשים. בתחילה התעניינתי רק במדע הבסיסי. הייתי סקרן לגבי נגיפים, ורציתי להבין אותם וכיצד הם משפיעים על המארחים שלהם. אולם רצה הגורל וליֶּדַע החדש שסייעתי לחשוף היו, ועדיין ישנן, השלכות מרחיקות לכת על ביוטכנולוגיה ועל תחומים מסוימים בעולם הרפואה. זו אחת הדוגמאות למוֹטיב חוזר במדע: יישׂומים המשפרים את איכות החיים, ואף מצילי חיים, נובעים לעיתים קרובות מיֶּדַע מדעי חדש.
המלצות למוחות צעירים
כשאני עובד עם תלמידים וסטודנטים, אני מעודד אותם להיות עצמאים עד כמה שניתן – לחשוב באופן עצמאי על אודות בעיות ופתרונות, ולחקור את הבעיות הללו במעבדות שמעודדות אותם בדרכם לעצמאות. לעיתים קרובות קשה לסטודנטים צעירים לעבוד בצורה עצמאית, אך עליהם לעשות זאת, כיוון שהמדע מבוסס על היֶּדַע של מדענים בודדים, ועל עבודתם הפרטנית. כיום, אנו מתמקדים בעיקר בשיתוף פעולה ובעבודה משותפת, וזה בהחלט חשוב מאוד. אולם בסופו של דבר הדמיון של המדענית או המדען, היֶּדע של כל אחד מהם ועבודתם הקשה הם שמובילים לתגליות כמו הטרנסקריפטז ההופכי, ולתגליות רבות אחרות שמתרחשות מִדֵּי יום. אני מעודד את תלמידיי, וגם אתכם, לבחור בקריירה שתספֵּק לכם עצמאות בשלב מוקדם ככל הניתן, ותאפשר לכם למצוא את דרככם האישית במדע (איור 5). המשמעות היא לא רק לחקות את שיטות המחקר של המנחים שלכם, אלא למצוא את דרככם הייחודית לעשות דברים. כדי לנהל מחקר מוצלח, עליכם לגבש הבנה מעמיקה של הנושא שבו אתם מתמקדים, למשל אורגניזם או מחלה מסוימים. כשאתם נכנסים לתחום הביולוגיה, שבו הדברים מורכבים ומצריכים כישורים רבים ומגוונים, עליכם להבין לעומק בעיה מוגדרת אחת או שתיים, ולהתמקד רק בהן. זה יאפשר לכם להעמיק את הידע שלכם. בשלב מאוחר יותר בקריירה שלכם, ייתכן שתבחרו להרחיב את מבטכם ולבחון את המתרחש בתחומים אחרים בביולוגיה ובמדע בכלל, אך בשלבים הראשוניים של הקריירה המדעית, המיקוד וההעמקה חשובים מאוד.

- איור 5 - המלצות למוחות צעירים.
- אני מעודד את אלו מכם המעוניינים בקריירה מדעית להיות עצמאיים ולמצוא את דרככם הייחודית.
את ההנאה הגדולה ביותר שלי כמדען אני שואב מגילוי דברים חדשים דרך הניסיון למצוא פתרון לבעיות בתחום הביולוגיה. אני מוצא שאלו החיים המתגמלים ביותר שאפשר לִחְיות, ומעודד אנשים לִפְנוֹת לכיוון זה, אם מוחותיהם פועלים בצורה זו. רבּים אינם מעוניינים לבלות את זמנם בניסיון לפתור בעיות, וזה בסדר. הכי חשוב להבין מהו הדבר שמסב לכם הנאה, ולעסוק בו ב'מִשְׂרה מלאה'. לא קל להיות מדען, כמו גם לעשות כל דבר שהוא מתוך מחויבות מלאה ובעומק רב. עם זאת כאשר תגיעו לעומקים הללו, תחושו סיפוק שייתכן כי לא תחוו לעולם באף דרך אחרת.
מילון מונחים
נגיף (Virus): ↑ בלַעַז: וירוס. חלקיק זעיר שמדביק תאים חיים ומשתמש במנגנוני התָּאים כדי לייצר נגיפים נוספים. נגיפים יכולים להדביק את כל צורות החיים.
רנ''א שָׁלִיחַ (Messenger RNA, mRNA): ↑ סוג של רנ''א הנושא את ההוראות לייצור חלבונים, אשר נע מגרעין התא למפעל החלבונים של התא (הרִיבּוֹזוֹם).
אֶנְזִימִים (Enzymes): ↑ חלבונים ששולטים במהירות התהליכים הכימיים המתרחשים בתאים חיים.
נגיפי רנ''א מחוללי גידול (RNA tumor viruses): ↑ נגיפי רנ''א הגורמים לגידול על ידי הטמעַת הגֶּנוֹם (מכלול המידע התורשתי באורגניזם מסוים) שלהם בגֶּנוֹם של המארחים.
שִׁעֲתוּק לאחור (Reverse Transcription): ↑ התהליך שבו דנ''א מועתק מרנ''א – 'היפוכו' של השעתוק הרגיל, שבו רנ''א מועתק מדנ''א.
טְרַנְסְקְרִיפְּטָאז הוֹפְכִי (Reverse Transcriptase): ↑ אנזים המְּבצע שעתוק לאחור (רְאוּ להלן במילון המונחים). מכונה בעברית 'המשעתק במהופך'.
רטרו-וירוסים (Retroviruses): ↑ נגיפים המייצרים דנ''א על ידי העתקַת גֶּנוֹם הרנ''א שלהם, תוך שימוש בשעתוק לאחור.
בִּיּוֹטֶכְנוֹלוֹגְיָה (Biotechnology): ↑ תחום תעשייתי שבו נעשה שימוש בתהליכים ביולוגיים למטרת פיתוח מוצרים.
הצהרת ניגוד אינטרסים
המחברים מצהירים כל המחקר נערך בהעדר כי קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
ברצוני להודות לנועה שגב על עריכת הריאיון שהיווה את הבסיס למאמר זה, ועל כתיבה משותפת של המאמר, ולזהבה כהן על האיורים.
מקורות
[1] ↑ Baltimore, D. 1971. Expression of animal virus genomes. Bacteriol. Rev. 35:235–41.
[2] ↑ Koonin, E. V., Krupovic, M., and Agol, V. I. 2021. The Baltimore classification of viruses 50 years later: how does it stand in the light of virus evolution? Microbiol. Mol. Biol. Rev. 85:e00053-21. doi: 10.1128/MMBR.00053-21
[3] ↑ Baltimore, D., and Franklin, R. M. 1962. The effect of Mengovirus infection on the activity of the DNA-dependent RNA polymerase of L-cells. Proc. Natl. Acad. Sci. 48:1383–90.
[4] ↑ Baltimore, D. 1970. Viral RNA-dependent DNA polymerase: RNA-dependent DNA polymerase in virions of RNA tumour viruses. Nature 226:1209–11.
[5] ↑ Coffin, J. M., and Fan, H. 2016. The discovery of reverse transcriptase. Annu. Rev. Virol. 3:29–51. doi: 10.1146/annurev-virology-110615-035556
[6] ↑ Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., and Walter, P. 2002. Site-Specific Recombination. In Molecular Biology of the Cell. 4th ed. New York, NY: Garland Science.
[7] ↑ Anson, D. S. 2004. The use of retroviral vectors for gene therapy-what are the risks? A review of retroviral pathogenesis and its relevance to retroviral vector-mediated gene delivery. Genet. Vacc. Ther. 2:1–13. doi: 10.1186/1479-0556-2-9
