תַקצִיר
חלבונים הם המנועים של כל צורות החיים – של גוף האדם, של בעלי החיים והצמחים מכל הממלכות. החלבונים משמשים הן לבניית איברי הגוף: העצמות, השרירים והעור, למשל, הן לביצוע תפקידי הגוף: החל בעיכול המזון, עיבודו והפיכתו לאנרגיה ולמרכיבי הגוף המאפשרים תנועה וחישה (ראייה ושמיעה למשל), וכלה בהגנה על הגוף מפני פולשים זרים – הנוגדנים שבגופנו, שגם הם חלבונים. מה הם החלבונים? אפשר להשוותם למילים בשפה הבנויות מאותיות. באלף-בית העברי יש 22 אותיות (ועוד 5 סופיות), ומהן אפשר לבנות אין-סוף מילים. אבל כשאנו כותבים, אנו משתמשים רק בחלק קטן מהאפשרויות האין-סופיות האלה, כשמספר האותיות במילה הוא בממוצע בין 8-3. האלפבית הביולוגי מורכב מ-20 ''אותיות'' הקרויות חומצות אָמִינִיּוֹת, והן אבני הבניין של החלבונים המרכיבים את כל הנמנים על ממלכות החי והצומח. החלבונים מורכבים משרשרות של חומצות אמינו הקשורות זו לזו בקשר פיזי וערוכות בסדר קפדני מאוד הנקבע על-ידי החומר הגנטי, הדנ''א. בניגוד למילים בשפה המדוברת, חלבון ממוצע בנוי מרצף של מאות חומצות אמיניות. האורך הגדול והמבנה הכימי של האותיות הופכים את החלבונים לרגישים לשינויים הנגרמים כתוצאה מחשיפה לגורמים רבים כמו טמפרטורה גבוהה (אפילו טמפרטורת הגוף שהיא 37 מעלות צלסיוס ואשר חיוניות לקיום התהליכים הרבים המתרחשים בו בקצב הנכון), קרינה (קרינת השמש האולטרה סגולה), החמצן שבאוויר (החיוני לקיום החיים) וכימיקלים (זיהומי תעשייה, עישון, וגם הגזים הנפלטים מכלי רכב). כל אלה פוגעים בחלבונים, משנים את המבנה העדין שלהם, ומשפיעים לרעה על תפקודם. כשחלבונים נפגעים, או כשהם סיימו את פעולתם והם אינם חיוניים עוד, הגוף מפרק אותם כדי למנוע נזקים שנגרמים מהצטברות חלבונים שניזוקו או כתוצאה מפעילות של חלבונים שאמורה היתה להסתיים. עם המנחה שלי לעבודת הדוקטורט, הפרופ' אברהם הרשקו, ושותפנו לעבודת המחקר, הפרופ' אירווין רוז מהמכון לחֵקֶר הסרטן בפילדלפיה, גילינו את המערכת שאחראית על פירוק ספציפי של חלבונים בתאי הגוף. פירוק זה מבחין בין חלבונים שניזוקו, שיש לסלקם, וחלבונים שאיננו זקוקים להם עוד, ומותיר שלמים את אלה ה''בריאים'' והמתפקדים. המערכת הזו נקראת מערכת היוביקוויטין על שם החלבון המרכזי אשר מרכיב אותה, שהיה גם הראשון שגילינו. תפקיד היוביקוויטין הוא לסמן את החלבונים הבלתי רצויים, כך שה''מַּגְרֵסָה'' תוכל לזהותם ולפרקם, והתא יוכל להמשיך לתפקד באופן תקין. במאמר זה אסביר לכם על החלבונים בגוף ועל מערכת היוביקוויטין שגילינו במחקר שזיכה אותנו בפרס הנובל לכימיה לשנת 2004 ובמספר פרסים חשובים לפניו.
פרופ' אהרן צ'חנובר זכה בפרס נובל לכימיה לשנות 2004, במשותף עם אברהם הרשקו ואירווין רוז, על גילוי מערכת היוביקוויטין לפרוק חלבונים.
חלבונים: מה הם, ואילו תפקידים הם מבצעים בגוף?
שרשרות חרוזים מפותלות
חלבונים הם מולקולות ביולוגיות בסיסיות שמורכבות מאבני בניין הנקראות חומצות אמינו. ישנן סך הכול 20 חומצות אמינו שמרכיבות את כל החלבונים שבגופנו ובכל ממלכות הצומח והחי. ניתן לחשוב על חומצות האמינו כחרוזים שמתחברים יחד ומרכיבים שרשרת. השרשרת הזו היא הצורה הפשוטה ביותר שיכולה להיות לחלבון, והיא נקראת מבנה ראשוני (איור 1, למעלה). כאשר הצורה הזו מתחילה להתפתל במרחב, נוצרים מבנים מורכבים יותר, והם מובחנים לפי היררכיה, או מידת המורכבוּת, של המבנה המרחבי שלהם. המבנה הבא, אחרי מבנה ראשוני, נקרא מבנה שניוני (איור 1, שני מלמעלה), והצורות הנפוצות ביותר שלו הן צורה של סליל שנקרא סליל אלפא, או של משטח שנקרא משטח בטא. המבנה השלישוני (איור 1, שני מלמטה) הוא מבנה תלת-ממדי שמורכב ממבנים שניוניים, והוא מייצר חלבון שכבר יכול לבצע תפקידים שונים בתא (כפי שנראה בחלק הבא). המבנה הרביעי והאחרון נקרא מבנה רביעוני (איור 1, למטה), והוא מבנה שמורכב לפחות משני חלבונים שיש ביניהם אינטראקציה.
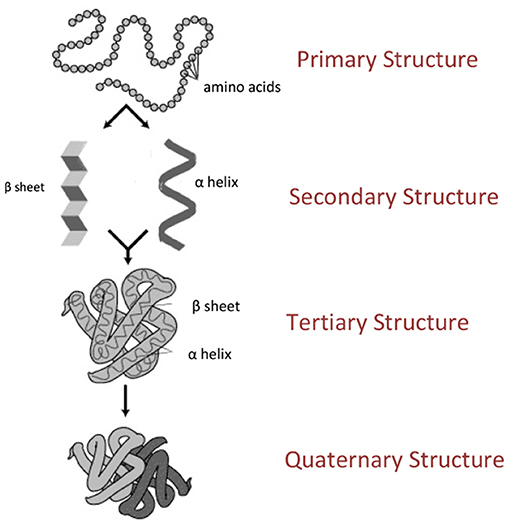
- איור 1 - מבנה החלבון.
- חלבונים מורכבים מ-20 'חרוזים' שנקראים חומצות אמינו. כאשר חומצות אמינו מתחברות, הן יוצרות שרשרת שנקראת מבנה ראשוני (Primary structure). המבנה הראשוני יכול להתפתל במרחב ולקבל צורות מורכבות יותר, והן נקראות מבנה שניוני, מבנה שלישוני ומבנה רביעוני, לפי מידת המורכבת שלהן. המבנה השניוני (Secondary structure) מופיע בשתי צורות עיקריות – סליל אלפא ומשטח בטא. המבנה השלישוני (Tertiary structure) הוא מבנה תלת-ממדי של חלבון שכבר יכול לבצע תפקודים מסוימים בתא. המבנה הרביעוני (Quaternary structure), שנוצר רק בחלבונים מסוימים, מורכב מלפחות שני חלבונים שונים שנמצאים זה עם זה באינטראקציה. האיור לקוח מוויקיפדיה.
חשוב לציין כי כאשר אנו צורכים חלבונים דרך מזון, כמו למשל ביצים קשות, גבינות, או בשר, אי אפשר לספוג אותם במצבם המורכב מאחר שבמצב זה הם כמו גוף זר שחודר לגוף, ולכן הוא עלול לעורר תגובה חיסונית. במקום זאת, מערכת העיכול שלנו מפרקת את החלבונים מצורתם המורכבת לחומצות האמינו שמרכיבות אותם, ואלו נספגות בגוף. הגוף יכול להשתמש באותן חומצות האמינו שנספגו כדי לייצר חלבונים חדשים שמתאימים לצרכיו ומכיוון שהוא ייצר אותם, הם אינם נדחים על ידי המערכת החיסונית.
סימפוניית החלבונים שבגופנו
בגוף האדם ישנם כ-25,000 חלבונים שונים, ולכל אחד מהם מיליוני עותקים בתאי הגוף. חלקם, החיוניים לפעילויות בסיסיות בגוף כמו יצירת אנרגיה, מתבטאים בכל התאים, וחלקם אופייניים לרקמה מסוימת, כמו קולטני אור ברשתית העין, והם מתבטאים רק באותה רקמה. החלבונים האלה מנגנים יחד סימפוניה מופלאה, הלא היא סימפוניית החיים. היופי בתזמורת זו הוא שהחלבונים אפילו לא זקוקים למנצח – כל חלבון יודע בדיוק מה עליו לעשות בכל רגע נתון. רובן המכריע של הפעולות הן אוטומטיות – הלב פועם, הריאות משחלפות גזים, הכליות מפרישות, מערכת העיכול מעכלת, ואפילו היציבה שלנו וההליכה הן אוטומטיות. אנו מקדישים מחשבה רק למיעוט קטן שבקטנים מפעולותינו – למשל לחשיבה, דיבור וכתיבה וגם אלו נעשות בחלקן באופן אוטומטי.
החלבונים מבצעים פעולות שונות ומגוונות מאוד בגוף (ראו איור 2). אתן לכם כמה דוגמאות. בשביל לזוז, הגוף צריך להפעיל שרירים. אבל, מה מפעיל את השרירים שלנו? אלה הם שני חלבונים שנקראים אקטין ומיוזין שנמצאים לאורך תאי השריר שלנו (איור 2, פינה שמאלית עליונה). אתם יכולים לחשוב על האקטין והמיוזין כמו גלגלי שיניים שנעים אחד מול השני וננעלים האחד על גבי השני. למעשה, קצה (''ראש'') המיוזין יכול לנוע לכיוון האקטין, וכאשר קצה המיוזין נקשר לסיב האקטין הוא מושך אותו, ובד בבד מושך כלפיו סיב אקטין נוסף שנמצא מולו. המשיכה הזו של שני סיבי האקטין אחד כלפי השני (המבוצעת בד בבד על-ידי הרבה מאוד ראשי מיוזין), היא שיוצרת את כיווץ השריר (אפשר לראות הדגמה של פעולת המיוזין והאקטין בסרטון הזה).
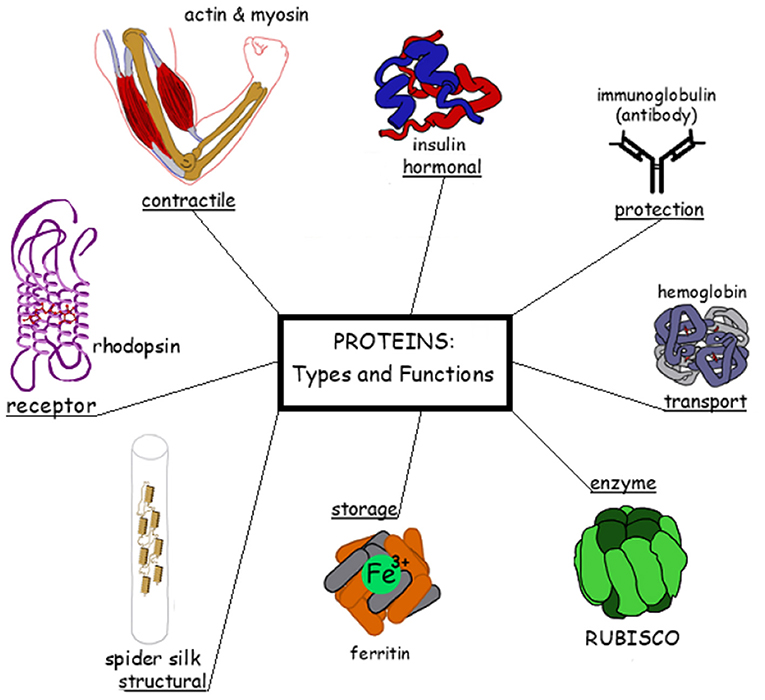
- איור 2 - דוגמאות לתפקודים שונים של חלבונים בגוף.
- משמאל עם כיוון השעון: שעה 9 - קולטן אור ברשתית העין בשם רודופסין, המאפשר ראייה בתנאים של תאורה חשוכה (כמו למשל בלילה); שעה 10:30 - שני חלבונים בתא השריר בשם אקטין ומיוזין, אשר יוצרים יחד את תנועת הכיווץ של השריר; שעה 12 - הורמון בשם אינסולין המופרש מהלבלב ואחראי, בין השאר, על ויסות רמות הסוכר (גלוקוז) בדם. זהו ההורמון שמקבלים כתרופה אנשים עם סוכרת מסוג 1, שגופם לא מייצר אינסולין טבעי בכמויות מספיקות; שעה 1:30 חלבון במערכת החיסון בשם נוגדן, שתפקידו לסייע בנטרולם של גורמים מזיקים; שעה 3 - חלבון בתאי הדם האדומים בשם המוגלובין, שאחד מתפקידיו החשובים הוא נשיאת חמצן מהריאות אל תאי הגוף; שעה 4:30 - חלבון בשם רוביסקו המתפקד כאנזים (זָרָז) בתהליך הפוטוסינתיזה בצמחים ובאורגניזמים שונים. בתהליך זה, אור השמש מוּתמר לאנרגיה בצורת סוכרים, כאשר אנזים הרוביסקו מסייע באחד השלבים שכוללים שימוש בפחמן דו-חמצני שנקלט מהאוויר; שעה 6 - חלבון בשם פריטין הקושר ברזל בדם במטרה לאחסן אותו בתאי הגוף. מחסור בפריטין בגוף עלול להוביל למצב של אנמיה, כלומר חוסר ברזל בגוף; שעה 7:30 - קורי עכביש הבנויים מחלבונים שאותם העכביש מפריש וטווה. במקרה זה, החלבונים נקראים חלבונים מבניים, מאחר שהם אלה שיוצרים את המבנה של קורי העכביש.
נסתכל על דוגמה אחרת – הנשימה. אתם יודעים מדוע אנו נושמים? כדי לייצר אנרגיה. אנו קולטים חמצן מהאוויר ומעבירים אותו לרקמות במטרה לייצר אנרגיה עבור פעילות התאים בגופנו. בתהליך יצירת האנרגיה נוצר גם גז פסולת שנקרא פחמן דו-חמצני, שאותו צריך לסלק מהגוף. הן העברת החמצן מהריאות אל התאים לצורך הפקת האנרגיה (המבוצעת בשאיפת האוויר) והן העברת הפחמן הדו-חמצני מהתאים אל הריאות לצורך סילוקו לאוויר (המבוצעת בנשיפת האוויר) מבוצעות על-ידי חלבון ההמוגלובין (שנמצא אצלנו בתאי הדם האדומים והוא שמקנה לדם את צבעו האדום; ראו איור 2, מימין).
גם אם נסתכל על מערכת החיסון של הגוף, שמגינה עליו מפני מחלות ומזיקים, נמצא שם חלבונים – הנוגדנים. מה קורה כשפולש זר, כמו וירוס או חיידק, חודר לגוף בלי הזמנה? הגוף שואף לנטרל אותו, והוא עושה זאת באמצעות מערכת החיסון. חלק ממנגנון הפעולה של מערכת החיסון מתוּוָּך על ידי נוגדנים (שדרך אחת ליצירתם היא תגובת הגוף לפלישה הזרה) שהם חלבונים הנצמדים אל הפולשים הזרים ומביאים לנטרולם ולחיסולם (איור 2, פינה ימנית עליונה). לעיתים הנוגדנים מנטרלים את הגוף הזר באופן ישיר, ולעיתים הם מסמנים אותו, כך שחלקים אחרים במערכת החיסון יוכלו לזהותו ולנטרל אותו. דרך אחרת ליצירת נוגדנים היא על-ידי מתן חיסונים כנגד מחלות שונות כמו שפעת, שיתוק ילדים או חצבת. החיסון עשוי לעיתים מווירוס מת או וירוס מוחלש שאינם גורמים למחלה, אך יכולים עדיין לעורר את המערכת החיסונית כדי שתייצר נוגדנים כנגדו, כך שאם בעתיד יחדור לגוף הווירוס מן הטבע שאיננו מוחלש (והוא עלול לגרום למחלה), הגוף כבר יהיה מוכן להתמודד איתו ולחסלו בעזרת הנוגדנים שנוצרו בעבר כנגד הווירוס המוחלש או המת. ולעניין הקשור לימינו אלה – הנוגדנים הם גם אלה שאנו מקווים שיגנו עלינו מפני וירוס הקורונה, ושיווצרו בין אם לאחר שנחלה חס ושלום, או לאחר שנחוסן (החיסון הנפוץ ביותר כנגד וירוס הקורונה יוצר בגוף חלבון המצוי במעטפת הוירוס החי ועוזר לו לחדירה לתאי הגוף. חלבון זר זה גורם למערכת החיסונית לייצר נוגדנים. כשהוירוס החי חודר לגוף האדם המחוסן, הנוגדנים שנוצרו כנגד החלבון המחסן נדבקים עתה לחלבון הזה שמצוי במערכת הוירוס ומנטרלים אותו). דוגמאות לתפקודים נוספים של חלבונים אפשר לראות באיור 2.
חלבונים רגישים: מדוע אי אפשר להחזיר ביצה מבושלת למצבה הנוזלי?
כפי שתיארנו, ישנם סוגי חלבונים רבים בגוף אשר מבצעים פעולות שונות וחשובות. הבעיה היא שחלבונים רגישים מאוד, הם נפגעים בקלות. למשל, אם תשאירו חלב או בשר טרי מחוץ למקרר הם יתקלקלו תוך זמן קצר (איור 3). באותו האופן, בהכנת ביצה קשה, החימום גורם לחלבונים לעבור ממצב נוזלי למוצק ולא ניתן להחזיר אותם (ואת הביצה) למצבה הראשוני – לא משנה מה תעשו. כנ''ל גם לביצה המטוגנת - גם אם הייתם משחזרים את הקליפה השבורה ומכניסים את הביצה המטוגנת חזרה לתוכה ומקררים את הביצה לטמפרטורת המקרר, היא עדיין לא הייתה חוזרת למצבה הנוזלי הטבעי הראשוני.

- איור 3 - חלבונים הנמצאים במזונות נפגעים בטמפרטורת החדר ובטמפרטורות גבוהות יותר.
- חלב ובשר מתקלקלים מחוץ למקרר תוך זמן קצר, מאותה הסיבה שאי אפשר להחזיר ביצה קשה למצבה הלא מבושל. בטמפרטורות החדר ובטמפרטורות גבוהות יותר, החלבונים מאבדים את המבנה המסודר שלהם, שמספק להם את צורתם התלת-ממדית המאפשרת את תפקודם התקין, ונעשים ''מבולגנים''. תהליך זה של שינוי מבנה החלבון נקרא דנטורציה, והוא יכול להתרחש ממגוון סיבות שביניהן חשיפה לחום, חשיפה לחמצן וחשיפה לקרינה. קרדיט לתמונה: fcafotodigital/ istockphoto.com.
מדוע זה קורה? משום שהחלבונים במזון מתקלקלים בטמפרטורת החדר ובוודאי שבטמפרטורות גבוהות יותר, כמו בבישול. החלבונים, כפי שתיארנו, מתקפלים במרחב בצורה מורכבת (כמו סליל כדורי) קיפול שחיוני לתפקידם. כשהחלבונים מתחממים, הקשרים הכימיים החלשים המחזיקים את המבנה המרחבי נחלשים, ואז החלבון מאבד את המבנה התלת-ממדי הסדור שלו והוא הופך להיות ''מבולגן'' (תחשבו על כדור צמר שהתפרק ונהפך לרשת קשרים שקשה למצוא בה יד ורגל). בנוסף, הטמפרטורה מזרזת התנגשויות בין מולקולות החלבון הרבות בתמיסה (אל נשכח שהסביבה של התאים בגוף היא מימית, גופנו עשיו מכ-70% מים). כתוצאה מכך פעילותם נפסקת. לתהליך זה אנו קוראים דֶּנָטוּרַצְיָה. סיבה נוספת לדנטורציה או שינוי מבני היא קרינה, כמו קרינה רדיואקטיבית או קרינה אולטרה סגולה (שמקורה יכול להיות בשמש) – שני סוגי קרינה אשר להן אנרגיה גבוהה. סיבה נוספת לירידה בפעילות החלבונים היא שינויים כימיים במבנה חומצות האמינו המרכיבות אותם כתוצאה מריאקציות כימיות, למשל עם חמצן האוויר הגורם לחמצון שלהן. הנזקים למבנה כתוצאה מן הסיבות השונות גורמים לחלבונים להפסיק לתפקד באופן תקין.
נוסף על חלבונים שניזוקים, ישנם חלבונים רבים שהפעילות שלהם נדרשת רק במצבים מסוימים, כמו למשל במצב של חלוקת תאים. שלב אחד במחזור החיים של התא נקרא חלוקת התא, שבמצב תקין מתבצעת אחת לזמן מסוים. נוצרים שני תאים, ובתזמון מדויק, כשאחד מהם מת, התא הנותר מתחלק שוב וממלא את החסר. החלוקה הזו מתוּוכת על-ידי חלבונים מסוימים ('זרזי חלוקה'), וברגע שהיא מסתיימת כבר אין צורך בחלבונים האלה. הם מפורקים ובמקומם מיוצרים 'מעכבי חלוקה', וחוזר חלילה. אם למשל אותם חלבונים מזרזי החלוקה יישארו בתא, התא ימשיך להתחלק פעמים רבות ללא בקרה, מצב אשר עלול להוביל למחלות כמו למשל לסרטן. דוגמא נוספת היא יצירת נוגדנים נגד פולשים זרים אשר מתווכת על ידי חלבוני-על הקרויים פקטורי שעתוק. כאשר הוירוס או החיידק מחוסלים, אין צורך עוד בנוגדנים (רק בתאי זיכרון בודדים) ואז אותם חלבוני-על, למרות שהם תקינים ומתפקדים, מתפרקים, פשוט כי אין צורך בהם, ותהליך ייצור החלבונים נפסק.
מכל הסיבות שהוזכרו לעיל - נזקים או אי צורך - חייבת להיות מערכת שתפרק את החלבונים.
נקודה חשובה מאוד לציון היא שהחיים ב-37 מעלות צלסיוס וב-21% חמצן שקיים באוויר שאנו נושמים הם הכרח, כדי לייצר את האנרגיה ולקיים באופן אופטימלי את כל הריאקציות הביוכימיות שמטרתן אחת – קיום החיים. לכן באופן פרדוקסלי אולי, שני הגורמים החשובים ביותר לקיום חיים התגלו גם כמזיקים למבנה החלבונים. ברור אם כך, כי האבולוציה היתה חייבת יילדאוגיי בד בבד עם התפתחות החיים המורכבים, לפתח מנגנוני תיקון ובקרת איכות שיתמודדו עם הנזק, ינטרלו אותו ויאפשרו חיים. אותם מנגנונים הם חלק בלתי נפרד מעצם החיים. לא מדובר בתאונת דרכים ובתיקון רכב שניזוק, שֶׁכֵּן תאונות או שמתרחשות או שאינן מתרחשות בחיי הנהג הפרטי. מדובר כאן בהליכים צמודים – או במחיר שאנו משלמים עבור עצם קיום החיים, תכונה שהייתי מכנה הֶרֶס לצורך בנייה (destruction for the sake of construction). לגוף מערכות בקרת-איכות רבות, המגינות על כל מרכיביו כולל החומר הגנטי, ה-DNA, מפני נזקי קרינה למשל שיביאו למוטציות, ואפילו קיימות כמה מערכות שונות לכל מרכיב, מעין חגורת ביטחון, עד כדי כך חשובה ההגנה הזו מפני גורמי הסביבה ייהמזיקיםיי. אנו נעסוק כאן רק באחת המערכות, המערכת אותה גילינו אנו, זו המפרקת חלבונים שניזוקו או שהגוף לא זקוק להם יותר, כדי למנוע את הנזק שבהצטברותם.
איך הגוף מתמודד עם חלבונים פגומים או חלבונים שסיימו את עבודתם ואין בהם יותר צורך?
אם כן, איך הגוף מטפל בחלבונים שהתקלקלו ובחלבונים שפעולתם הסתיימה ואין בהם צורך עוד, והמשך פעולתם ו/או הצטברותם עלול לגרום לנזק? הוא מפרק אותם לרכיביהם הבסיסיים – החומצות האמיניות. קצב הפירוק מדהים: כ-7-6% מהחלבונים בגוף מתפרקים מידי יום ביומו ומוחלפים בדיוק רב בחלבונים חדשים המיוצרים תחתם (באמצעות מערכות הדנ''א והרנ''א הקיימות בכל תא בגופנו). זה אומר שבתוך פרק זמן של בין חודש לחודשיים, כמעט כל החלבונים בגוף – למעט מספר חלבונים קטן היציבים באופן חריג – מוחלפים. יצוין שמדובר במספר ממוצע – ישנם חלבונים, במיוחד חלבוני בקרת תהליכים, שהם קצרי חיים ומתחלפים כמה פעמים בשעה, וישנם כאלו – חלבוני מבנה או נשיאה כמו ההמוגלובין – שהם ארוכּי-חיים ומתחלפים רק אחת לכמה חודשים. שאלה מרתקת הצפה ועולה היא כיצד יכול להיות שלמרות שכל החלבונים בגוף שלנו היום שונים מהחלבונים שהיו בו לפני חודשיים, אנו עדיין אותם האנשים שהיינו? איך הועברו ונשמרו הזיכרון, הכישרון, הרגשות – התוכנה שמתפעלת אנשים, בעוד החומרה התחלפה. שאלה נוספת היא: אם אנו מתחדשים כל העת מדוע אנו מזקינים? אלה שאלות מרתקות ועליהן אין לנו עדיין תשובות. אבל, מה שאנו כן יודעים הוא כיצד פועלת המערכת בתא שאחראית על פירוק ספציפי של חלבונים – רק אלה שהתקלקלו או אלה שאין בהם צורך (בעוד האחרים הבריאים והמתפקדים ושיש צורך בהם נשמרים) המערכת שנקראת מערכת היוביקוויטין [1].
כאן המקום לציין שישנן כמה מחלות, חלקן מחלות קשות, שקשורות לחוסר תפקוד תקין של מערכת פירוק החלבונים בגוף. במחלת אלצהיימר, למשל, חלבונים מסוימים שאמורים להתפרק לא מפורקים ומצטברים במוח, מה שמוביל בסופו של דבר להצטמקות המוח ולאובדן תפקודים קוגניטיביים ובהם הזיכרון. כך גם במחלת הפרקינסון ומחלות ניווניות אחרות של המוח. גם גידולים ממאירים נגרמים לעתים בשל מוטציות בגנים המקודדים לחלבוני בקרה תקינים, מוטציות שהופכות אותם לאונקוגנים - גנים גורמי סרטן. הבנת מערכת פירוק החלבונים בגוף עשויה לכן לאפשר לנו לפתח תרופות ולטפל במחלות כגון אלצהיימר באמצעות השבת פעילותה התקינה של מערכת פירוק החלבונים. עוד נציין כי אפשר להשתמש בפגיעה יזומה במערכת פירוק החלבונים בתאים במטרה לטפל במחלות שונות. דוגמה אחת לכך היא סרטן מסוג מיאלומה נפוצה. במחלה זו מתרחשת חלוקה תאית בלתי מבוקרת של תאי פלזמה – התאים אשר יוצרים נוגדנים – במח העצם. החלוקה המזורזת הזו מובילה לפגיעות שונות בגוף ובהן פגיעה במבנה העצם (בעיקר החוליות והעצמות הארוכות של הגפיים הקרובות יותר לגוף - הזרוע והירך), תוך גרימת שברים, ודיכוי יצירת שאר התאים המיוצרים במח העצם, כמו תאי דם אדומים ולבנים על ידי תאי הגידול, על כל התוצאות הנגרמות מכך, כמו קשיים בנשימה בשל ירידת כושר נשיאת החמצן ועל ידיה הכדוריות האדומות וזיהומים בשל היעדר תאים לבנים הלוחמים בהם. על ידי התערבות במערכת פירוק החלבונים של תאים אלה, ומניעה מכוונת של פירוק נוגדנים שהם מייצרים ומפרישים (שחלקם פגומים מלכתחילה בשל פגמים הקיימים בכל קו ייצור) אפשר לגרום להצטברותם ולהרג התאים שמייצרים אותם, ובכך למנוע את התפתחות המחלה. בהמשך המאמר נתייחס ביתר פירוט למחלת המיאלומה הנפוצה ולטיפול התרופתי שניתן לה.
מערכת לפירוק חלבונים
יוביקוויטין: נשיקת המוות לחלבונים המיועדים לפירוק
כפי שציינו קודם, ישנן כמה סיבות לפירוק חלבונים בגוף. סיבה ראשונה היא לצורך בקרת איכות, כלומר פירוק של חלבונים בלתי תקינים בגוף, למשל כאלה שהתקלקלו בתהליך הדנטורציה שהוזכר לעיל. סיבה נוספת היא לצורך בקרת תהליכים, כלומר זירוז או הפסקת תהליכים שתלויים בחלבונים, כמו למשל תהליך של התחלקות תאים. סיבה שלישית היא לצורך התמיינות תקינה של רקמות. כחלק מהתפתחות העובר, תאים שונים צריכים להתמיין כדי לבנות את הרקמות והאיברים השונים בגוף: תאי מוח, תאי כבד, תאי מעי, תאי לבלב, תאי שריר וכדומה. כל רקמה בנויה מחלבונים מסוימים הנדרשים לתפקודה בלבד, ולא מסך כל החלבונים הנמצאים בגוף. לכן, כחלק מתהליך התמיינות התאים נדרש פירוק חלבונים שמבטיח את המיון הנכון של תאים וחלבונים לרקמה המתאימה.
אולם, כיצד הגוף יודע להבחין בין חלבונים מקולקלים או כאלה שסיימו את תפקידם והמשך נוכחותם עלול לגרום נזק ובין חלבונים תקינים שהמשך נוכחותם בתא הכרחי? ואחרי שהוא מזהה את החלבונים שיש לפרקם, כיצד הוא עושה זאת? מתברר שכל החלבונים המיועדים לפירוק בתאי הגוף עוברים קודם כל סימון שאנו קוראים לו ''נשיקת המוות''. כאשר החלבון עובר שינוי מבני שמצריך את פירוקו, אותו שינוי מזוהה על ידי מערכת הפירוק ומביא לסימונו ב''נשיקת המוות''. אחת ההשׁערות היא שמנגנון הסימון קשור בזיהוי חלקים פנימיים של החלבון שנחשפים כלפי חוץ אם החלבון עובר דנטורציה (חלקים שלא 'אמורים' להיות חשופים אם החלבון במצב תקין). אפשרות אחרת היא כי השינוי המבני מביא לשינוי נוסף, למשל על-ידי מולקולת זרחן המוצמדת לחלבון, והיא מצידה מושכת אליה את ''נשיקת המוות''. אותה ''נשיקה'' מתבצעת על-ידי חלבון בשם יוביקוויטין. בשלב הראשון, החלבון שאותו צריך לסמן, זה המיועד לפירוק (חלבון המטרה - Target protein, איור 4 בצהוב), נצמד אל אחד מאלף חלבונים שנקראים קושרני יוביקוויטין ומסומנים ב-E3 (איור 4, בוורוד). ההצמדה הזו מתרחשת על בסיס התאמה מבנית וכימית בין החלבון לבין אחד מקושרני היוביקוויטין – מעין 'מפתח ומנעול'. קשירה זו בין ה''קורבן'' לקושרן מקבעת את חלבון המטרה למקומו, כמו תושבת שעליה מניחים טלוויזיה, כדי שליוביקוויטין יהיה ''נוח'' להתחבר אליו.
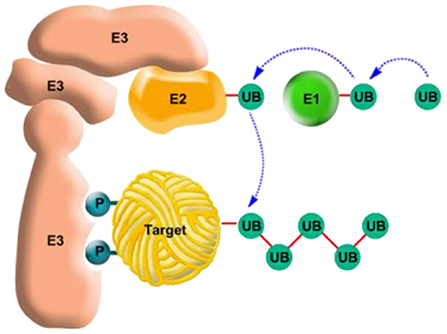
- איור 4 - חלק אחד של מערכת היוביקוויטין לסימון חלבונים המיועדים לפירוק בתא.
- מערכת היוביקוויטין היא מערכת מורכבת שמטרתה- לסמן חלבון המיועד לפירוק להצמיד לו את יינשיקת המוותיי (חלבון מטרה, מסומן ב-Target במרכז). המערכת מורכבת משלושה סוגי חלבונים: שני חלבונים נשׂאים, E1 ו- E2 (למעלה, בירוק כתום, בהתאמה), שתפקידם לשפעל ולאחר מכן לשאת את חלבון היוביקוויטין, וקושרן ליוביקוויטין (E3, משמאל בוורוד), שתפקידו להחזיק את חלבון המטרה בזמן שהיוביקוויטין נצמד אליו. לאחר שחלבון היוביקוויטין עובר שפעול אל E1 הוא מועבר ל E2 וזה מצמידו אל חלבון המטרה ה''רתום'' ל-E3 (לעתים הוא מועבר קודם ל-E3 ורק אז מוצמד לחלבון המטרה). תחילה מוצמדת מולקולה אחת של יוביקוויטין לחלבון המטרה, ולאחר מכן נצמדות מולקולות יוביקוויטין נוספות זו לזו, ראש לזנב, ליצירת שרשת רב-יוביקוויטין (UB, בירוק כהה מימין למטה). הסימון הזה של חלבון המטרה על ידי שרשרת של חלבוני יוביקוויטין הוא שאומר לתא שעליו לגייס בשלב השני של התהליך את ה''מגרסה'' שתפרק את החלבון. אותה ''נשיקת מוות'' – שרשרת היוביקוויטין – למה היא דומה? לנדונים למוות בארצות הברית המולבשים במדים כתומים, ובכך הם מסומנים כבר מראש. אלא מה, כמו לאותם נדונים למוות להם זכות ערעור, גם בטבע נוצרה אפשרות להצלת חלבון המטרה: אם החלבון רכש מחדש את תצורתו הטבעית, התקפל נכונה, ויימוכןיי להתחיל לתפקד מחדש, חלבונים מסירי יוביקוויטין יכולים לנתק את השרשרת ממנו, לפרקה לשיירי יוביקוויטין בודדים ולמחזרם לפעילות בתא בה ייצמדו לחלבונים אחרים המיועדים לפירוק, זאת בדומה לתהליך החנינה לנדונים למוות (ראה גם איור 5).
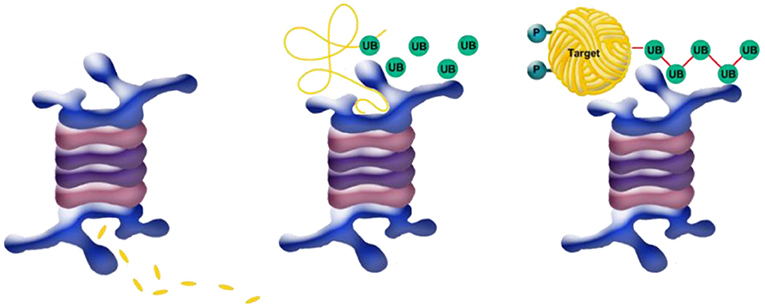
- איור 5 - פירוק חלבון מטרה המסומן על-ידי יוביקוויטין.
- פירוק חלבון המטרה מבוצע על-ידי 'בלנדר' – 'מגרסה' – זהו קומפלקס חלבוני בשם פרוטאזום (גוף כחול). מימין: חלבון המטרה (Target בצהוב) המיועד לפירוק והמסומן על-ידי שרשרת של חלבוני יוביקוויטין פעילים (UB, ציור 4 למעלה) נצמד באמצעות השרשרת הזו אל הפרוטאזום. באמצע: אנזימים נוספים פותחים את חלבון המטרה (סליל צהוב פתוח למעלה) ומזריקים אותו לתוך הפרוטאזום, כאשר במקביל חלבונים מסירי יוביקוויטין משחררים יוביקווטין חופשי וממחזרים אותו לשימוש חוזר. משמאל: קומפלקס הפרוטאזום מפרק את חלבון המטרה הפתוח למרכיבי הבסיס – שרשרות קצרות של חומצות אמינו (הקרויות פפטידים), שבהמשך מתפרקות לחומצות אמינו בודדות (מקטעים צהובים למטה).
לפני שהיוביקוויטין נצמד אל חלבון המטרה ו''מנשק'' אותו, הוא צריך לעבור שני שלבים של שפעול (אקטיבציה). ניתן לחשוב על השפעול הזה כמו על הפעלה של יישׂוּמוֹן בטלפון הנייד – אומנם היישומון תמיד מותקן על הטלפון הנייד, אבל עד שלא נכנסים אליו הוא לא פעיל (ואין צורך שיפעל כל הזמן). שפעול היוביקוויטין מתבצע על-ידי E1 – חלבון יחיד הידוע גם כאנזים משפעל היוביקוויטין (איור 4, מימין למעלה בירוק). לאחר ששופעל, נישא היוביקוויטין הפּעיל על גבי אחד מ-50 חלבוני E2 אל חלבון המטרה הצמוד לאחד ממאות החלבונים קושרי/מצמדי היוביקוויטין (E3). הוא מתחבר אל חלבון המטרה (איור 4, משמאל למטה) ואז מתחברות אליו מולקולות יוביקוויטין נוספות ליצירת שרשרת רב-יוביקוויטין המהווה את ''נשיקת המוות'' שמסמנת לתא שעליו לפרק את חלבון המטרה.
בשלב השני של התהליך, כעת, לאחר שחלבון המטרה מסומן בשרשרת של חלבוני יוביקוויטין, השרשרת הזו נקשרת אל אנזים (שגם הוא חלבון המורכב מ-34 תת יחידות שונות) שנקרא פרוטאזום (איור 5), שתפקידו לפרק את החלבון. אתם יכולים לחשוב על הפרוטאזום כבּלנדר (מערבל, מגרסה) שכותש ומפורר את החלבון למרכיבי היסוד שלו – החומצות האמיניות. בשלב הראשון, שרשרת היוביקוויטין משמשת כמו דבק שמצמיד את חלבון המטרה המיועד לפירוק אל החלבון ה'בלנדר' (איור 5 מימין). לאחר מכן, חלבון המטרה נפתח על-ידי אנזימים נוספים, הופך לשרשרת ארוכה (איור 5 אמצע), ומוזרק אל תוך הפרוטאזום. במעבר דרך הפרוטאזום הוא מפורק למרכיבי הבסיס (איור 5 משמאל), שאותם התא יכול למחזר ובאמצעותם לבנות חלבונים חדשים.
ראינו אם כן שכדי שחלבון יפורק בתא על-ידי מערכת היוביקוויטין נדרשים שני שלבים עיקריים: (א) יצירה של שרשרת יוביקוויטין הצמודה אל חלבון המטרה; (ב) היצמדות השרשרת לפרוטאזום ופירוק חלבון המטרה על ידו תוך מִחְזוּר הן של אבני היסוד, החומצות האמיניות – לבניית חלבונים חדשים, והן של שיירי היוביקוויטין המשתחררים תוך כדי הפירוק וייצמדו עתה לחלבונים אחרים המיועדים לפירוק. המופלא במערכת הוא שכל חלבון שכזה שצריך להתפרק הוא כמו מחט בערימת שחת – הוא מסתובב בין אלפי חלבונים אחרים שהם תקינים ושאותם הגוף אסור שהתא יפרק. זהו יופייה של המערכת הזו – היא יכולה לזהות את אותה מחט בערימת השחת ולבצע פירוק ממוקד של חלבונים שנידונו לכך בלבד, באמצעות סימונם על-ידי יוביקוויטין. הפעולה הממוקדת הזו מייחדת את מערכת היוביקוויטין מהרבה מערכות ביולוגיות אחרות שמפרקות גם הן חלבונים, ואשר פועלות ללא אבחנה. מערכות כאלה פשוט 'בולעות' את כל מה שנמצא בסביבה ומפרקות את החלבונים שנבלעו באופן אחיד, לא ספציפי. תהליך כזה מתרחש במערכת העיכול בו כל מזון שנכניס אליה ומכיל חלבונים (כמו רב המזונות - יקרים וטעימים ככל שיהיו), יפורקו מיידית למרכיביו הבסיסיים. גם בתאים בתוך הגוף מתרחשים תהליכים דומים. לתהליכים אלו יש מטרה – למשל אספקת חומרי בניין ואנרגיה בעת רָעָב. בזמן דַּחַק שכזה לא משנה אלה חלבונים יפורקו, הגוף זקוק ללבנים לבנייה וליצירת אנרגיה, וכל חלבון שמפורק טוב למטרה זו. מערכת היוביקוויטין תפקידה שונה – היא יודעת לזהות ולהוביל לפירוק רק את החלבונים שצריך לפרק, ולא מפרקת את שאר החלבונים הקריטיים למרבית תפקודינו. החכם באדם, מחבּרו של ספר קהלת, כבר אמר: ''לכל זמן ועת לכל-חפץ תחת השמים; עת ללדת ועת למות; עת לטעת, ועת לעקור נטוע: עת להרוג ועת לרפוא; עת לפרוץ ועת לבנות; עת לבכות ועת לשחוק, עת ספוד ועת רקוד'' (קהלת, ג', א'-ד').
תרופות שפותחו על סמך מערכת היוביקוויטין
עם התפתחות הבנת מנגנוני הפעולה של מערכת היוביקוויטין וההבנה שהפרעה בהם גורמת למחלות, או שניתן לווסת את המערכת כך שהפחתת אן הגברת פעולתה תשפר מצבי מחלה מסוימים, הגיעה העת לפיתוח של יישומים רפואיים שונים המבוססים עליה. כפי שראיתם, חלבונים מבצעים הרבה מהפעולות החשובות בגוף האדם, ופעולתם התקינה מתבססת, בין השאר, על תפקוד תקין של מערכת היוביקוויטין. אולם ישנם מקרים שבהם מערכת היוביקוויטין לא מתפקדת בצורה טובה, למשל כאשר מופעל עליה עומס גדול מדי (כשיותר מדי חלבונים צריכים להיות מפורקים בזמן מסוים), או במקרה שבו מתרחשת פגיעה בייצור של אחד ממרכיביה, למשל מוּטציה באחד מאנזימי ה-E2 (אחד מהחלבונים נשאי היוביקוויטין), או ה-E3 (אחד מהחלבונים מצמדי היוביקוויטין, איור 4). כשמערכת היוביקוויטין מתפקדת בצורה לא מיטבית, חלבונים יכולים להיות מפורקים בעודף (יותר מדי) או בחוסר (פחות מדי), ואז עלולה להתפתח מחלה. דוגמה חשובה היא המקרה של מחלת הסרטן. לתאים השונים בגופנו קצב חלוקה שונה. חלקם מתחלקים אחת לכמה ימים (תאי ציפוי מערכת העיכול ותאי מח העצם – בית החרושת של הדם). אחרים אינם מתחלקים כלל (כמו תאי המוח, השריר ורקמת השומן), ואחרים מתחלקים באיטיות (כמו תאי עצם וסחוס). במצב של מחלת הסרטן, התאים מתחלקים בקצב מהיר ובאופן בלתי נשלט. אחת הסיבות האפשריות להתפתחות של מחלת הסרטן היא פעולה בלתי תקינה של מערכת היוביקוויטין – כאשר המערכת מפרקת בעודף חלבונים שמדכאים חלוקה תאית, או שאינה מפרקת במידה מספקת חלבונים שמעודדים חלוקה תאית, התאים עלולים להגביר את קצב החלוקה ללא בקרה ולהפוך ממאירים. לא בהכרח מדובר בכישלון המערכת. מחלת הסרטן שהיא ''ערמומית'' יוצרת ב''מכוון'' חלבונים מאיצי התחלקות תאית שמערכת היוביקוויטין אינה מכירה ואינה מזהה כמי שנועדים לפירוק, והם אלו שמתניעים את התהליך הסרטני.
נמצאות היום בשימוש שתי קבוצות חשובות של תרופות שמשמשות בעיקר לטיפול בסרטני הדם, במיוחד סרטן של הלימפוציטים – תאי המערכת החיסונית היוצרים נוגדנים (Multiple Myeloma). קבוצה אחת היא של מעכבי פרוטאזום. הם מעכבים פירוק של נוגדנים שנוצרו בתא והיו מיועדים לפירוק כי חלה איזו טעות בייצור שלהם. העיכוב של הפרוטאזום מונע את פירוקם, הם מצטברים ויוצרים עָקָה תאית שממיתה את התא. מעניין שהמנגנון הזה איננו מנגנון של הפעולה הרגילה של נוגדי סרטן – תרופות כמוטרפויטיות, ולכן אפשר להוסיפן להגבּרת היעילות כי מנגנון פעולתן שונה. הקבוצה השנייה היא של מולקולות שמדביקות ב''כוח'' את החלבונים גורמי הסרטן לקושרן יוביקוויטין (E3) שבאופן נורמלי לא היה קושר אותם. ההדבקה הזו, השידוך הכוחני הזה, גורם לקושרן לְצַמֵּד יוביקוויטין לחלבון גורם הסרטן, דבר שמביא לפירוקו על-ידי הפרוטאזום. שני סוגי התרופות הללו משמשות היום יחד לטיפול במחלה, דבר שהביא לשינוי דרמטי בסיכויי ההחלמה ממנה. ממחלה שהחולים בה נפטרו בסבל בתוך כשנתיים ממועד אבחנתה, היא הפכה למחלה שאצל חלק מן החולים היא ברת-ריפוי, ואחרים זוכים לשיפור ניכר באורך ובאיכות חייהם. פיתוח תרופות יימשדכותיי/ יימדביקותיי אלו יהיה מן הסתם גם הפתרון לקבוצת המחלות החשובה - המחלות הניווניות של המוח (אלצהיימר, פרקינסון ואחרות) כי תרופות אלו יגרמו לפירוקם ה''כפוי'' של החלבונים הקורמים להן. לכן הבנת מערכת היוביקוויטין תרמה, ממשיכה ותמשיך לתרום לפיתוחן של תרופות שמצילות חיי אדם.
הנה סיפור אישי מחיי הנוגע להצלת חיי אדם וגם לקריירה שלי שהחליפה כיוון במהלכה – מרפואה למחקר: כשהגענו לקבל את פרס הנובל בשוודיה, בדצמבר 2004, השגריר הישראלי ערך לנו מסיבה עם מנהיגי הקהילה היהודית – מסיבה בה חגגנו את הפרס ואת חג החנוכה שחל באותה עת. הוא הכין לנו 'מתנה'. המתנה הזו לא הייתה קופסה עטופת נייר וסרט צבעוני, אלא אדם – שבדי מן השורה. עד כמה שבועות קודם לכן, אותו אדם שכב על ערש דווי בבית חולים בשטוקהולם כשהוא סובל מסרטן דם מסוג Multiple Myeloma. המוצא האחרון לניסיון להצלתו היה שימוש בתרופה שהייתה ניסיונית אז, מעכב הפרוטאזום בשם ולקייד (Velcade), שפותח בארצות הברית בהתבסס על אופן פעולת מערכת היוביקוויטין שגילינו. באיור 6 אתם יכולים לראות דוגמה למצב מח העצם (רקמה המהווה ''בית חרושת'' לייצור כל תאי הדם ואשר מצוייה בעיקר בליבת החוליות ובעצמות הארוכות הקרובות לגוף - עצמות הירך והזרוע) של מטופל לפני שימוש בתרופת הוולקייד (בצד שמאל) ולאחר שימוש בה (בצד ימין).
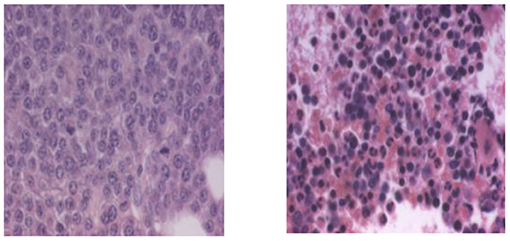
- איור 6 - מח עצם של חולה במיאלומה נפוצה לפני טיפול באמצעות תרופת ולקייד ולאחר הטיפול בה.
- במחלת סרטן מסוג מיאלומה נפוצה, תאי פלזמה עוברים שינוי ומתחילים להתרבות באופן בלתי מבוקר בתוך רקמת מח העצם, שהיא ''בית החרושת'' לייצור כל תאי הדם. משמאל: מח העצם של החולה לפני הטיפול בתרופת ולקייד, תרופה שעוצרת את הפרוטאזום, כשהוא מוצף בתאי פלסמה שהתרבו ללא בקרה. הוא מכיל 41% תאי פלזמה סרטניים. מימין: מח העצם של אותו החולה אחרי הטיפול בתרופת ולקייד. הוא מכיל עתה רק 1% של תאי פלזמה סרטניים. התמונה ניתנה לפרופ' אהרן צ'חנובר באדיבות חברת Millennium.
כמה ימים לאחר שהתרופה הוזרקה לוורידיו של החולה, הוא קם על רגליו וחזר לתפקד. הרגע הזה, שבו ניגש אלינו אדם, נופל על צווארנו כשדמעות ממלאות את עיניו ומודה לנו על שהצלנו את חייו (אומנם לא ישירות), היה רגע מרגש ביותר עבורי, רגע של סגירת מעגל: אומנם לא המשכתי במסלול כרופא – מסלול בו התחלתי את דרכי המקצועית, ומקצוע בו הרופא מטפל בחולים אחד אחד, אינדיווידואלית, אך דרך המחקר הובילה אותי להשפיע על חיי אנשים רבים, מיליונים בעולם כולו, באופן משמעותי אולי יותר מאשר אילו הייתי עוסק ברפואה, והסיפוק על כך גדול.
המלצות לקוראים הצעירים
אם אתם מתלבטים במה לבחור כשתגדלו, אני ממליץ לכם לפעול ככה: תלכו אחרי מה שאתם מרגישים שאתם ממש טובים בו ושאתם אוהבים לעשות. הרבה פעמים זה בא יחד. אם אתם ממש אוהבים לעשות משהו, ''מתים'' עליו, זה התחביב הכי גדול שלכם – אתם גם תהיו טובים בו. אתם תשקיעו בו ותלמדו אותו, וגם תדעו להתמודד עם מכשולים בדרך. כי אם אתם באמת אוהבים משהו, אתם תבינו שאין כישלונות אלא יש רק הפקת לקחים מאי הצלחה והתקדמות אל ההצלחה שבוא תבוא.
כששואלים אותי מה סוד ההצלחה שלי אני אומר שידעתי לזהות שאני לא מספיק טוב ובעיקר לא מספיק אוהב את המקצוע הראשון שלי (רפואה), והבנתי שאני צריך לעבור לעיסוק אחר. מלכתחילה גם ידעתי שאני לא טוב במתמטיקה, ולכן כלל לא פניתי למקצועות שבהם נדרשת ידיעה מעמיקה של מקצוע זה. רפואה דווקא מצאה חן בעיני, אך עמוק בתוך המקצוע הבנתי שבמהלך השנים הארוכות שאבלה במקצוע (שהוא מרתק) אני עתיד לחזור על עצמי שוב ושוב, לאבחן שוב את אותן מחלות ולטפל בהן. ככל שהדבר חשוב ומעניין, חשבתי שאני בנוי יותר לחדשנות. בחרתי במחקר ומיד ידעתי כי זה התחביב שלי, זה מה שאני אוהב לעשות. ידעתי גם לבחור מנחה צעיר ולא מנוסה, שיצא לו שם מצוין – אברהם הרשקו, שאיתו גם עשיתי כברת דרך ארוכה (ויחד זכינו בפרס נובל). הוא רק חזר מהשתלמות פוסט דוקטורלית (שלב חשוב בקריירה אחרי עבודת הדוקטורט), ובחרתי בו במתכוון כי מה שהוא הציע לי היה מסלול די הרפתקני אל הלא נודע. הייתה לו השׁערה, הייתה לו איזושהי התחלה בכיוון שונה מהמקובל. כמובן, צריך גם מזל. וכששואלים אותי ''למה החלטת לעבוד על יוביקוויטין?'' אני עונה שלא החלטתי לעבוד על יוביקוויטין אלא החלטתי לעבוד על שאלה ביולוגית: ''איך חלבונים מתפרקים?''. העבודה על השאלה הביולוגית הזו בשיטות ביוכימיות היא שחשפה בפנינו את היוביקוויטין וייעולמויי. בהמשך, שיטות לריצוף הגנום האנושי גילו את ההיקף הנרחב של מערכת היוביקוויטין ואת תפקידיה החשובים בבקרת תהליכים רבים בגוף. לבסוף התגלתה גם חשיבותה בפיתוח תרופות מצילות חיים המבוססות על מנגנוניה, אך אפילו כעת אנו רק בתחילתה של הדרך-גילינו רק את קצה הקרחון.
אני כבר קרוב לחמישה עשורי שנים בתחום, אבל כל יום הוא בבחינת היום הראשון עבורי. מוקף באנשים צעירים ויצירתיים המפרים אותי ברעיונותיהם החדשניים, ואני עוזר להם מניסיוני. הפגישה בין החדשנות לניסיון היא מרתקת ומצמיחה רעיונות חדשים שרובם נכונים. בעיניי האהבה למקצוע לא שונה מכל אהבה אחרת: אהבה להורים, אהבה לחברים טובים, אהבה לבני זוג. אז אני מאחל לכם שתמצאו את האהבה המקצועית, וזו תביא אתכם אל ההצלחה. האהבה לא חייבת להיות במדע, היא יכולה להיות בכל שטח: אומנות, מוזיקה, הנדסה, רפואה, משפטים, ארכיטקטורה – העיקר, תרגישו כי מה שאתם עושים תפור עליכם ככפפה ליד ואולי גם תורם לחברה שסביבכם. זה יבטיח לכם שתצליחו, שתתרמו לאחרים, ויחזיק אתכם מסוקרנים שנים ארוכות.
למי מכם שיבחר לעסוק במדע כמקצוע, יש לי המלצה נוספת: תייצרו סיפור. אם אתם רוצים שתהיה לכם השפעה, אתם צריכים להיות עקביים ולבנות סיפור. ברגע שמצאתם משהו מעניין, התחלה של סיפור שיש לו פוטנציאל, תמשיכו, תפתחו אותו, אל תקפצו כל הזמן מנושא אחד למשנהו. זה כמו להיות כל יום במקום אחר – אז אנשים לא יכירו אתכם ולא יזהו אתכם עם הסיפור המיוחד לכם. פרופ' הרשקו ואני מזוהים כל אחד בתור ''מר יוביקוויטין''. זה הסיפור שלי וזה מה שאפשר לי ליצור השפעה שבסופו של דבר גם הובילה להצלת חיי אדם. אם הייתי עוזב את הסיפור אחרי המאמר הראשון, זה לא היה מתאפשר. זיכרו להיות סבלניים, וזיכרו גם שהמטרה שלנו במדע היא לא להיות פרופסורים ובעיקר לא לקבל פרסים, אלה יבואו באם תצליחו. המטרה שלנו היא לגלות את סודות הטבע ואולי גם להשתמש בהם לתועלת האדם. המבחן האמיתי של המדע הוא שמישהו יחזור על הניסוי שלך בבואנוס איירס, בניו-יורק או בפריז בלי שאת או אתה בכלל תדעו על כך, ומישהו אחר יעשה את הניסיון הבא, והבא אחריו, וכך באיטיות ייפרשׂ סיפור שלם של חדשנות לנגד עינינו. היום עוסקים בעולם אלפים רבים במערכת שהחלה דרכה בתחילת שנות ה-80 של המאה שעברה במעבדה קטנה בטכניון בחיפה. חברות תרופות גדולות מייצרות תרופות מצילות חיים, ומיליוני אנשים נהנו ועוד ייהנו מהן כשחייהם יינצלו ואיכות חייהם תשתפר. זו התמורה המהנה ביותר שתוכלו לחלום עליה.
חומרים נוספים
- דפנה מנדלר - מאורע היסטורי במדינת ישראל – פרס נובל בכימיה
- חלבונים ומפרקים - חדווה גונן ואהרן צ'חנובר בכתב העת גליליאו
- The Nobel Prize in Chemistry 2004—Aaron Ciechanover
מילון מונחים
חלבון (Protein): ↑ מולקולה אורגנית שנמצאת בכל אורגניזם, כולל בווירוסים. החלבון הוא שרשרת שיכולה להיות מורכבת מ-20 אבני בניין שונות שנקראות חומצות אמינו. לשרשרת מבנה ראשוני (סדר חומצות האמינו), שניוני (סידור של החומצות בסלילים ומשטחים) שלישוני (קיפול במרחב) ורביעוני (תת יחידות שונות החוברות למבנה אחד). החלבונים מהווים מרכיב מרכזי בתפקודים רבים של הגוף ובהם: פירוק מזון, הפקת אנרגיה, מבנה (עצמות), תנועה (שרירים), חלוקת תאים, חישׁה וראייה והגנה מפני פולשים זרים (נוגדנים). חלבונים רגישים מאוד לתנאים סביבתיים כמו למשל לטמפרטורה ולחמצן, ותפקודם נפגע כל העת, לכן הם מצויים בתחלופה מתמדת של הרס ובנייה.
מערכת החיסון (Immune system): ↑ מערכת ההגנה שהגוף משתמש בה כדי לשמור עלינו מפּולשים שעלולים לפגוע בנו, כמו למשל וירוסים וחיידקים.
נוגדן (Antibody): ↑ חלבון (ראו לעיל) במערכת החיסון (ראו לעיל) שתפקידו לסייע בנטרולם של גורמים מזיקים.
דנטורציה של חלבון (denaturation) של חלבון: ↑ תהליך שבו משתנה המבנה המרחבי של החלבון, למשל כתוצאה מטמפרטורה גבוהה. דנטורציה מובילה לפגיעה בתפקוד התקין של החלבון.
יוביקוויטין (Ubiquitin): ↑ חלבון (ראו לעיל) שמסמן חלבונים אחרים המיועדים לפירוק.
שפעול (אקטיבציה – Activation) של חלבון: ↑ הפעלה של החלבון, כלומר העברתו ממצב שבו אינו יכול לבצע פעולה מסוימת (ואז הוא נקרא 'רדום') למצב שבו הוא מסוגל לבצע את אותה הפעולה (ואז הוא נקרא 'פעיל').
אנזים (Enzyme): ↑ חלבון (ראו לעיל) בגוף שתפקידו לזרז תגובות כימיות על-ידי הפחתת כמות האנרגיה שנדרשת לביצוע התגובה.
הצהרת ניגוד אינטרסים
המחבר מצהיר כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
ברצוני להודות לנועה שגב, בוגרת התוכנית לאנרגיה ע''ש ננסי וסטיבן גרנד (GTEP), טכניון, ישראל, על עריכת הראיון שהיווה את הבסיס למאמר זה, ועל כתיבה משותפת של המאמר. תודה גם לפרופ' מיכאל ברנדייס על העזרה במענה לשאלות הסוקרים הצעירים.
מקורות
[1] ↑ Hershko, A., and Ciechanover, A. 1992. The ubiquitin system for protein degradation. Annu. Rev. Biochem. 61:761–807. doi: 10.1146/annurev.bi.61.070192.003553
