ملخص
يستند هذا المقال إلى مقابلة أُجريت بين المؤلفَين.جسم الإنسان مثل الغابة، حيث تجري العديد من الأحداث المبهرة بداخله كل ثانية، وأغلب هذه الأحداث تقع دون أن ندركها. في هذه المقالة، سنسلط الضوء على جزء مثير للاهتمام من هذه الأنشطة الدائرة في جسم الإنسان، وهو الجهاز المناعي الذي يحمي الجسم من الكائنات المتطفلة عن طريق خبراء الفنون القتالية لديه، وهي الخلايا التائية القاتلة. وهذه الخلايا مسؤولة عن القضاء على الخلايا المصابة بالفيروس حتى لا يتمكن من التكاثر والانتشار في جميع أنحاء الجسم. انضم إليّ في رحلة مليئة بالمغامرات داخل الجهاز المناعي حيث نكتشف كيف تعرف الخلايا التائية القاتلة أي الخلايا يجب مهاجمتها وأي الخلايا يجب تركها في حال سبيلها.
فاز البروفيسور Peter Doherty بجائزة نوبل في علم وظائف الأعضاء أو الطب في عام 1996، مشاركةً مع البروفيسور رولف تسينكرناغل بفضل اكتشافاتهما المتعلقة بالطبيعة الخاصة للدفاع المناعي الخلوي.
الخلايا الحارسة للجسم
يُعدّ الجهاز المناعي من أهم أجهزة الجسم. ويتكون من خلايا الدم البيضاء والمواد التي تنتجها. والجهاز المناعي مسؤول عن الحفاظ على صحتنا من خلال محاربة العدوى بنجاح (لمعرفة المزيد عن الجهاز المناعي، انظر قسم مواد إضافية). تُعدّ الفيروسات أحد أنواع الكائنات المتطفلة التي يمكنها غزو الجسم وإصابة الناس بالمرض، وهي جسيمات صغيرة تصيب خلايا كائن حيّ يُسمى المضيف. تخدع الفيروسات الخلايا المضيفة وتجعلها تنتج المزيد من نُسخ الفيروس. تموت الخلايا المصابة في العادة، وتطلق العديد من الفيروسات الجديدة التي يمكنها الانتشار في جميع أنحاء الجسم وإصابة المزيد من الخلايا (لمعرفة المزيد حول الفيروسات، يمكنك الاطلاع على مقالة Collection Nobel هذه).
يستخدم الجهاز المناعي طريقتين رئيسيتين للتعامل مع العدوى الفيروسية. تتضمّن إحداهما إنتاج الأجسام المضادة [1]. وبعض الخلايا اللمفاوية، واسمها الخلايا البائية، مسؤولة عن إنتاج الأجسام المضادة. تلتصق الأجسام المضادة بالفيروسات وتوقف نشاطها قبل أن تتمكن من إصابة خلايا أخرى (الشكل 1A). يمكنك تخيّل الأجسام المضادة مثل مجموعة لاعبي كرة قدم يعترضون سبيل المنافس الراكض (الفيروس) لمنعه من التقدم بالكرة.
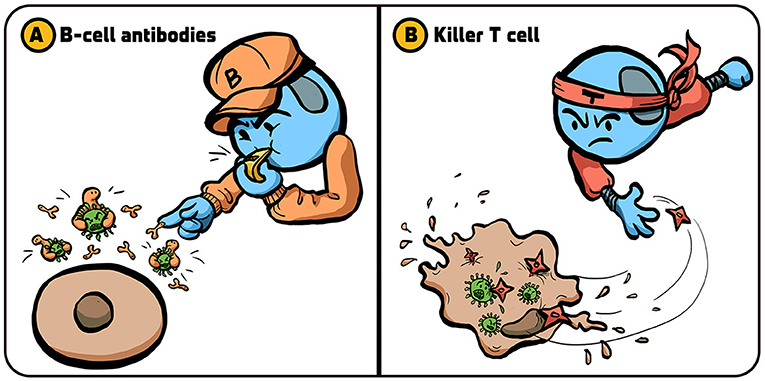
- شكل 1 - الاستراتيجيات التي يستخدمها الجهاز المناعي لمكافحة الفيروسات: يطبق الجهاز المناعي عدة استراتيجيات للتعامل مع العدوى الفيروسية.
- (A) تطلق الخلايا البائية بروتينات تُسمى الأجسام المضادة (كماشات صغيرة) تلتصق بالفيروسات (الموضحة باللون الأخضر) وتمنعها من اختراق خلايا الجسم. (B) تقضي الخلايا التائية القاتلة على الخلايا المصابة بالفيروسات، ما يمنع إنتاج فيروسات جديدة يمكن أن تصيب خلايا أخرى. تم تقديم الرسم التوضيحي من إيريس غات.
في الاستراتيجية الأخرى، يقتل الجهاز المناعي أيضًا الخلايا المصابة بالفيروسات (الشكل 1B). ويمنع هذا الخلايا المصابة من إنتاج نُسخ أخرى من الفيروس. والخلايا اللمفاوية التي تقضي على الخلايا المصابة بالفيروس تُسمّى الخلايا اللمفاوية التائية السامة، أو الخلايا التائية القاتلة اختصارًا [2]. عندما تواجه الخلايا التائية القاتلة خلية مصابة بفيروس، تقتلها من خلال صنع قنوات في الغشاء الخلوي ودفع الخلية المصابة إلى تدمير نفسها، من خلال عملية اسمها موت الخلية المبرمج (لمعرفة المزيد حول موت الخلية المبرمج، اقرأ هذه المقالة.).
هل هي خلايا قريبة أم غريبة؟
يستخدم الجهاز المناعي إجراءات متطرفة مثل قتل الخلايا للتعامل مع المخاطر المحتملة. كيف يعرف الجهاز المناعي البِنى التي يجب صنع أجسام مضادة لها أو الخلايا التي يجب قتلها؟ بمعنى آخر، كيف يقضي على العدوى بدون إيذاء الجسم نفسه؟ أثبتت الأبحاث أن هناك خيطًا رفيعًا يفصل هذه المسألة ويستلزم الإجابة عن سؤال رئيسي: ما الخلايا القريبة (خلايا جسمي وجزيئاته نفسها) وما الخلايا الغريبة (المتطفلة)؟ من المهم للغاية أن يجيب الجهاز المناعي عن هذا السؤال بشكل صحيح. فمن جانب، إذا لم يتعرف الجهاز المناعي على الكائنات المتطفلة بشكل جيد بما فيه الكفاية، فسيبقى المضيف بدون حماية من تلك التهديدات. على الجانب الآخر، إذا أخطأ الجهاز المناعي وحدّد أن خلايا الجسم نفسه متطفلة، فقد يهاجم الجسم ويتسبب في تلف خطير. والأمراض الناجمة عن مهاجمة الجسم من الجهاز المناعي المضلل تُسمى أمراض المناعة الذاتية، ولا تتوفر علاجات فعالة للكثير منها (يتحقق الباحثون حاليًا من احتمالية أن فيروس SARS-CoV-2 المسبب لكورونا يؤدي إلى شكل نادر من المناعة الذاتية لدى المصابين. وهذه المناعة الذاتية قد تكون سببًا محتملاً لأعراض كورونا طويلة الأمد التي نشهدها).
مستقبِلان مقابل مستقبِل واحد
عندما بدأت العمل على الخلايا التائية القاتلة في أوائل السبعينيات، لم يكن العلماء يعرفون بعد كيف تميّز الخلايا اللمفاوية بين الخلايا القريبة والغريبة. وبعد اكتشافنا أن الخلايا التائية القاتلة تستهدف بطريقة ما الجزيئات القريبة (بروتينات عمليات الزرع التي تم اكتشافها في حالات رفض الأعضاء المزروعة)، اعتقد أغلب العلماء أن الخلايا التائية القاتلة تشتمل على نوعين مختلفين من المستقبِلات (البروتينات التي تتعرف على جزيئات محددة) على أسطحها: نوع من المستقبِلات يمكنه التعرف على الجزيء القريب ونوع آخر يمكنه التعرف على الجزيئات الأجنبية (الفيروسية) الغريبة (الشكل 2A). اعتقد العلماء أن الجزيئات القريبة والغريبة هما نوعان مختلفان من أجزاء الجسم ويتطلبان نوعين مختلفين من المستقبِلات ليتم التعرف عليهما.
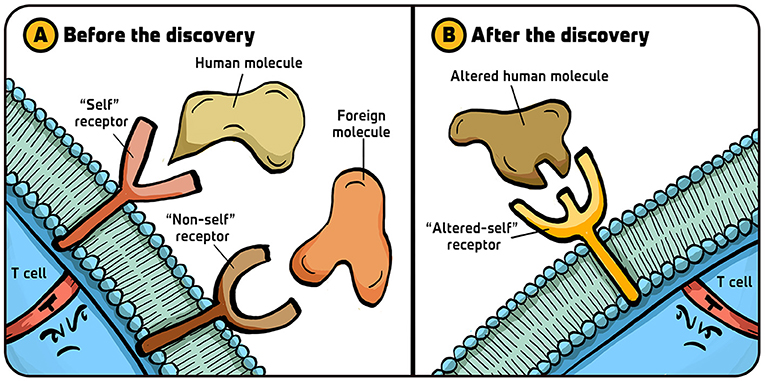
- شكل 2 - فرضيات مستقبل الخلية التائية القاتلة: (A) قبل اكتشافنا الحائز على جائزة نوبل والذي ربط التعرف على الخلايا التائية القاتلة بالخلايا القريبة، كانت وجهة النظر المسيطرة على الباحثين العاملين على الخلايا التائية المساعدة CD4+ أن هذه الخلايا اللمفاوية تشتمل على نوعين من المستقبِلات على أسطحها: نوع يتعرف على جزيئات الجسم (القريبة) وآخر يتعرف على الجزيئات الأجنبية (الغريبة).
- (B) وبعد اكتشافنا، اتضح في النهاية أن كل الخلايا التائية تحتوي على مستقبِل محدد مناعيًا يتعرف على التغيرات في جزيئات الجسم (القريبة المتغيرة). تم تقديم الرسم التوضيحي من إيريس غات.
اعترضت أنا وزميلي رولف تسينكرناغل على ذلك، فهناك بالفعل نوع واحد من المستقبِلات في الخلايا التائية القاتلة يتعرف على تغيرات الجزيئات القريبة (الشكل 2B). وفّرت هذه الفكرة تفسيرًا مختلفًا للمناعة والذي ثبتت صحته مع تحسّن النهج التقنية المستخدمة للإجابة عن السؤال. وقبل أن أخبرك كيف يتم التعرف على الكائنات المتطفلة الخطيرة باستخدام مستقبِل واحد فقط، دعني أحدثك حول بعض الإنجازات التي قادتنا إلى هذا الاستنتاج.
رحلتي الشخصية من إطعام العالم إلى فك شفرات المناعة
عندما كان عمري 17 عامًا، قررت دراسة الطب البيطري. وكان القرار غريبًا لأنني تربيت في مدينة حضرية في كوينزلاند في أستراليا. ولكنني ظننت أن تعلم الطب البيطري سيكون مغامرة رائعة وأنه يمكنني المساهمة في إطعام العالم من خلال تحسين إنتاج الحيوانات. واليوم بسبب تغير المناخ، نعلم أننا سنكون في حال أفضل (على الأقل في الدول المتقدمة) عند التركيز على المنتجات النباتية، ولكن كانت لدينا أفكار مختلفة آنذاك. خلال دراسات الدكتوراه الخاصة بي، زاد اهتمامي للغاية بالطريقة التي تسبب بها العدوى الأمراض. ولذلك انطلقت في دراسة العدوى بين الأغنام والماشية.
وتوصلت إلى أحد اكتشافاتي الأولية عندما كنت أدرس عدوى فيروسية لأدمغة الأغنام. في ذلك الوقت، كان العلماء قد بدأوا للتو فهم دور الخلايا اللمفاوية، ولكن لم يدركوا بعد الآليات المحددة التي تعمل بها تلك الخلايا. وفي إدنبرة، أثبتّ أنا وهيو ريد أن الخلايا البائية المنتجة للأجسام المضادة كانت موجودة في أدمغة الأغنام المصابة بالفيروس، وأن تلك الخلايا كانت تنتج أجسامًا مضادة لمكافحة الفيروس [3]. وكان هذا هو الدليل المباشر الأول على أن الخلايا المنتجة للأجسام المضادة يمكن أن توجد في نسيج مصاب. ألهمني هذا الاكتشاف كثيرًا وأردت معرفة المزيد حول الدور الذي كانت الخلايا المناعية تقوم به في الأنسجة.
في أثناء دراستي للأغنام في إدنبرة، أدركت حاجتي إلى معرفة المزيد حول الخلايا التائية ورتبت لقضاء بضع سنين في الجامعة الوطنية الأسترالية في كانبرا حيث كانت تعمل مجموعة باحثين في غاية النشاط، واخترت عدوى التهاب السحايا والمشيميات اللمفاوي بين الفئران كنظام تجريبي. اعتمدت تقنية من دراسات سابقة للوصول إلى حجرة السائل الدماغي الشوكي التي تغمر الدماغ للحصول على خلايا الدم البيضاء الالتهابية، والتي كانت في الغالب عبارة عن خلايا تائية تغزو الدماغ وأغشيته المحيطة (السحايا) عقب عدوى التهاب السحايا والمشيميات اللمفاوي. وعندئذ انضم إلى المختبر خريج من كلية الطب في جامعة بازل، واسمه رولف تسينكرناغل.
أجرينا معًا التجارب التي فازت بعد 20 عامًا تقريبًا بجائزة نوبل في علم وظائف الأعضاء أو الطب.
مستقبِل واحد يتعرف على الخلايا القريبة المتغيرة
أجريت أنا ورولف التجربة التالية: أصبنا فئران المختبر بعدوى التهاب السحايا والمشيميات اللمفاوي، وبعد أسبوع (في ذروة الاستجابة المناعية)، جمعنا الخلايا التائية القاتلة لدى الفئران والتي تم إنتاجها لمكافحة العدوى (الشكل 3). ووضعنا هذه الخلايا التائية القاتلة في أنابيب صغيرة تحتوي على خلايا فئران مصابة بالعدوى نفسها. أخذنا الخلايا التائية القاتلة من سلالات الفئران المصابة بعدوى التهاب السحايا والمشيميات اللمفاوي والتي كانت تشتمل أو لا تشتمل على نفس جزيئات الزرع (واسمها H2 في الفئران وHLA في البشر) التي تحتوي عليها الخلايا المستهدفة المصابة بالعدوى. ووجدنا أن الخلايا التائية المتطابقة مع H2 والمضادة للعدوى أحسنت في قتل الأهداف المتطابقة مع H2، في حين أن الخلايا القاتلة المختلفة عن H2 تجاهلتها تمامًا. وبناءً على هذه النتائج، افترضنا أن الخلية التائية القاتلة بها مستقبِل واحد يتعرف على الخلايا القريبة المتغيرة (المصابة) ووضعنا نظرية جديدة حول مناعة الخلايا التائية تدور حول ذلك.
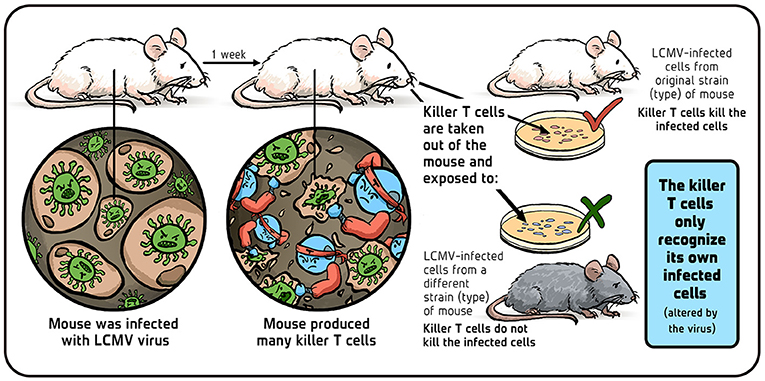
- شكل 3 - هل تهاجم الخلايا التائية القاتلة الخلايا المأخوذة من سلالات فئران مختلفة؟ تم تقديم الرسم التوضيحي من إيريس غات.
بمعنى آخر، افترضنا أن الفيروس يغيّر أحد الجزيئات الطبيعية القريبة (جزيئات الخلايا غير المصابة) والتي تتشابه بين الفئران المتطابقة جينيًا وتختلف بين الفئران المختلفة جينيًا. وتوجد هذه الجزيئات القريبة دومًا على سطح الخلايا المضيفة، وتوصلنا إلى أن الخلايا التائية القاتلة تنظر إلى هذا التغير الناتج عن الفيروس كإشارة للعدوى وتستجيب بالقضاء على الخلية المصابة [4].
في ذلك الوقت، لم تكن لدينا التقنيات التجريبية اللازمة لإثبات صحة فرضيتنا. ولكن التطورات التقنية التي حدثت في العقدين التاليين سمحت لآخرين بإثبات صحتها [5–8]. وباستخدام هذه التقنيات الجديدة، تم العثور على جزيئات قريبة تُسمى جزيئات معقد التوافق النسيجي الكبير على سطح الخلايا. وعندما يغزو فيروس خلية، تتقطع البروتينات الفيروسية، وتظهر أجزاء فيروسية صغيرة على سطح الخلية تحملها جزيئات معقد التوافق النسيجي الكبير (الشكل 4).
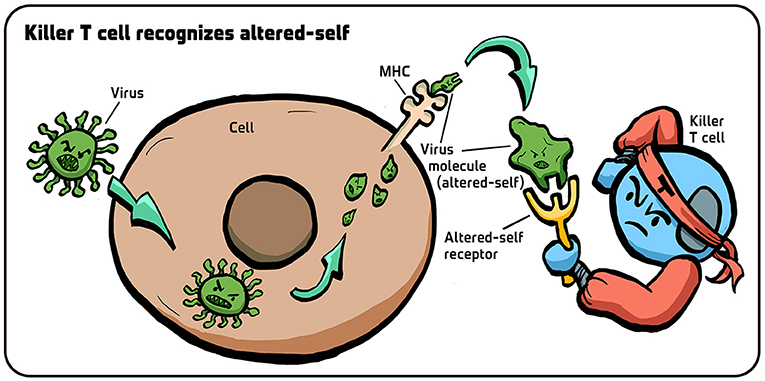
- شكل 4 - كيف تتعرف الخلايا التائية القاتلة على الخلايا القريبة المتغيرة؟ عندما يصيب فيروس خلية، تتقطع بروتيناتها.
- وتنتقل أجزاء صغيرة من الفيروس (وحدات خضراء صغيرة) إلى سطح الخلية وتحملها جزيئات معقد التوافق النسيجي الكبير. ويؤدي وجود هذه الأجزاء الفيروسية على جزيئات معقد التوافق النسيجي الكبير إلى تغير بنية هذه الجزيئات، فتتعرف المستقبِلات بالخلايا التائية القاتلة على هذا التغير في الشكل (للخلايا القريبة المتغيرة)، وتدرك بالتالي أن الخلية مصابة. تم تقديم الرسم التوضيحي من إيريس غات.
وحمل هذه الأجزاء الفيروسية يغير شكل جزيئات معقد التوافق النسيجي الكبير، وهذا التغير في الشكل هو ما تراه الخلايا التائية القاتلة وتتفاعل معه [9]. بمعنى آخر، تتعرف الخلايا التائية على أي خلية قريبة متغيرة مصابة من خلال التغيّر في بنية جزيئات معقد التوافق النسيجي الكبير الخاصة بها. عندما ثبتت صحة نظريتنا، أحدثت طفرة في فهمنا لطريقة عمل الخلايا التائية التي تُعد أحد أهم أجزاء الجهاز المناعي.
هل يمكن أن تساعد نتائجنا في تحسين صحة البشر؟
يمكن أن يفيد فهمنا للخلايا التائية القاتلة في العديد من المجالات الطبية. أولاً، يمكن أن تساعد هذه المعلومات في تحسين اللقاحات. فبما أننا نعرف الآن أن الجهاز المناعي يتعرف على أجزاء الفيروسات التي تحملها جزيئات معقد التوافق النسيجي الكبير، آمل أن نتمكن من صنع لقاحات أفضل تشمل أجزاءً واسعة النطاق وكبيرة التنوع من الفيروس. وكلما اختلفت الأجزاء التي يحتويها اللقاح، كان من السهل إثارة استجابة قوية من الخلايا التائية القاتلة. تحتوي لقاحات كورونا، مثلاً، على أجزاء بروتين واحد (اسمه بروتين سبايك) في حين يحمل الفيروس أكثر من 20 بروتينًا مختلفًا يمكنها إثارة استجابات من الخلايا التائية القاتلة.
ركزت أيضًا الكثير من جهدي على فهم طبيعة خلايا الذاكرة التائية الواقية الساكنة والتي يتم استدعاؤها لتصبح خلايا تائية قاتلة عند الإصابة بالعدوى من جديد. عمل باحثون آخرون على كيفية إيقاظ الخلايا التائية القاتلة التي تم وضعها للتصدي للسرطانات، ولكنها خمدت على ما يبدو (هذه هي الطريقة التي تعمل بها بعض العلاجات المكافحة للسرطان والتي يمكنك هنا التعرف على المزيد حولها [10]). ويمكن أن تشمل الاستخدامات المحتملة الأخرى لهذا الاكتشاف علاجات جديدة لأمراض المناعة الذاتية، وقد نجد فيها طرقًا لإعادة التوازن إلى الخلايا البائية والتائية التي ضلت طريقها وأخذت تهاجم خلايا الجسم نفسه.
نصائح للعلماء الصغار
أعتقد أنه من المهم للغاية الحصول على تدريب علمي، حتى لو لم تصبح عالمًا نشطًا في نهاية المطاف. والسبب أنك تتعرف بصفتك عالمًا متدربًا على كيفية التفكير المطوّل في حل المسائل (الشكل 5)، وكيفية التعامل مع البيانات، وكيفية صياغة الحجج، وكيفية كتابة وايصال أفكارك بوضوح. وهذه مهارات مهمة يمكن أن تفيد في العديد من المواقف الحياتية.

- شكل 5 - نصائح للعلماء الصغار: (A) التفكير المطوّل في حلّ مسألة.
- (B) العلم عبارة عن ملعب كبير للغاية. (C) إذا وجدت شيئًا يبهرك، فاسع من أجله. تم تقديم الرسم التوضيحي من إيريس غات.
إذا كنت تريد حقًا أن تصبح عالمًا وبالتحديد عالم أحياء، فلديّ أخبار سارة لك. أولاً، ما زال أمامنا الكثير والكثير لاكتشافه في هذا المجال. ثانيًا، يوفر علم الأحياء، ولا سيما الأبحاث الطبية الحيوية، فرصًا هائلة للعديد من الأشخاص مختلفي المهارات والمناهج. قد يتمتع بعضهم بمهارات في الكمبيوتر ويريدون إعداد أنظمة تحلل البيانات وتربطها. على الجانب الآخر، قد يحب آخرون القيام بتجارب فكرية وصياغة أفكار ونظريات جديدة. أما الأشخاص الذين يحظون بمهارات إدارة أو تطوير منتجات جيدة، فيمكنهم التفوق في البحوث الطبية الحيوية أيضًا. فهذا ملعب كبير للغاية يتسع للعديد من المجالات، وأرى أن الصغار أمثالك الذين يستمتعون بحل الألغاز بطريقة ما ستعجبهم على الأخص المهن العلمية.
آخر شيء أود إخبارك به هو: إذا وجدت شيئًا يبهرك، فاسع من أجله. انغمس فيه إلى أقصى درجة وابذل قصارى جهدك لمتابعته. لن تعرف أبدًا إلى أين ستقودك اهتماماتك. وخلال رحلة الاستكشاف هذه، ستكتسب طرقًا فريدة للتفكير ستفيدك بصرف النظر عن المسيرة المهنية التي تختارها في النهاية. إذًا، بدلاً من أن تشعر بالإحباط من الشكوك التي تجلبها الحياة، ثِق في مهاراتك وفي أنك ستحظى بفرصة لاستخدامها بطرق مثيرة للاهتمام.
مواد إضافية
- How the Innate Immune System Fights for Your Health
- The Immune System, in Sickness & in Health—Part 1: Microbes and Vaccines
- Types of immune responses: Innate and adaptive, humoral vs. cell-mediated | NCLEX-RN | Khan Academy
- .Doherty, P. (2006). The Beginner’s Guide to Winning the Nobel Prize: Advice for Young Scientists. Columbia University Press
مسرد للمصطلحات
الجهاز المناعي (Immune System): ↑ جهاز الدفاع بالجسم الذي يحمينا من العدوى وبعض الأمراض.
خلايا الدم البيضاء (White Blood Cells): ↑ الأجزاء الرئيسية في الجهاز المناعي التي تساعد الجسم على مكافحة العدوى.
الأجسام المضادة (Antibodies): ↑ البروتينات التي تلتصق بالفيروسات وتوقف نشاطها.
الخلايا اللمفاوية (Lymphocytes): ↑ خلايا الدم البيضاء المسؤولة عن إنتاج الأجسام المضادة وقتل الخلايا المصابة. ومن أمثلتها الخلايا البائية والخلايا التائية.
الخلايا اللمفاوية التائية السامة (Cytotoxic T Lymphocytes): ↑ تُسمّى أيضًا الخلايا التائية القاتلة، وهي خلايا دم بيضاء تقضي على الخلايا المصابة بالفيروسات.
موت الخلية المبرمج (Apoptosis): ↑ عملية انتحار للخلايا يتم فيها التخلص من الخلايا التالفة أو المصابة.
أمراض المناعة الذاتية (Autoimmune Diseases): ↑ أمراض يتعرض فيها الجسم للهجوم من جهازه المناعي نفسه.
المستقبِل (Receptor): ↑ بروتين على سطح خلية يلتصق بجزيء محدد يطابقه في الشكل، مما يؤدي إلى استجابة خلوية.
علم المناعة (Immunology): ↑ دراسة وظائف الجهاز المناعي.
معقد التوافق النسيجي الكبير (Major Histocompatibility Complex (MHC)): ↑ الجزيئات القريبة الموجودة على سطح الخلايا.
إقرار تضارب المصالح
تقرّ المؤلفة NS بأنها كانت تعمل في Frontiers في وقت كتابة المقالة. ولم يؤثر ذلك إطلاقًا على عملية مراجعة الأقران ولا على القرار النهائي.
ويعلن المؤلف الآخر أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
شكر وتقدير
نود شكر البروفيسور ستيفن جونغ على تعليقاته القيّمة على المقالة، وإيريس غات على توفير الأشكال، وسوزان ديباد على تحرير المقال.
المراجع
[1] ↑ Johnson, A., Lewis, J., Raff, M., Roberts, K., and Walter, P. 2002. Molecular Biology of the Cell. New York, NY: Garland Science p. 4.
[2] ↑ Andersen, M. H., Schrama, D., thor Straten, P., and Becker, J. C. 2006. Cytotoxic T cells. J. Investig. Dermatol. 126:32–41. doi: 10.1038/sj.jid.5700001
[3] ↑ Doherty, P. C. 1970. Studies in the experimental pathology of louping-ill encephalitis (Doctoral dissertation). Edinburgh: University of Edinburgh.
[4] ↑ Zinkernagel, R. M., and Doherty, P. C. 1979. MHC-restricted cytotoxic T cells: studies on the biological role of polymorphic major transplantation antigens determining T-cell restriction-specificity, function, and responsiveness. Adv. Immunol. 27:51–177. doi: 10.1016/S0065-2776(08)60262-X
[5] ↑ Townsend, A. R. M., Rothbard, J., Gotch, F. M., Bahadur, G., Wraith, D., and McMichael, A. J. 1986. The epitopes of influenza nucleoprotein recognized by cytotoxic T lymphocytes can be defined with short synthetic peptides. Cell 44:959–68. doi: 10.1016/0092-8674(86)90019-X
[6] ↑ Brown, J. H., Jardetzky, T., Saper, M. A., Samraoui, B., Bjorkman, P. J., and Wiley, D. C. 1988. A hypothetical model of the foreign antigen binding site of class II histocompatibility molecules. Nature 332:845–50. doi: 10.1038/332845a0
[7] ↑ Garcia, K. C., Degano, M., Stanfield, R. L., Brunmark, A., Jackson, M. R., Peterson, P. A., et al. 1996. An αβ T cell receptor structure at 2.5 Å and its orientation in the TCR-MHC complex. Science 274:209–19. doi: 10.1126/science.274.5285.209
[8] ↑ Garboczi, D. N., Ghosh, P., Utz, U., Fan, Q. R., Biddison, W. E., and Wiley, D. C. 1996. Structure of the complex between human T-cell receptor, viral peptide and HLA-A2. Nature 384:134–41. doi: 10.1038/384134a0
[9] ↑ Wieczorek, M., Abualrous, E. T., Sticht, J., Álvaro-Benito, M., Stolzenberg, S., Noé, F., et al. 2017. Major histocompatibility complex (MHC) class I and MHC class II proteins: conformational plasticity in antigen presentation. Front. Immunol. 8:292. doi: 10.3389/fimmu.2017.00292
[10] ↑ Leach, D. R., Krummel, M. F., and Allison, J. P. 1996. Enhancement of antitumor immunity by CTLA-4 blockade. Science 271:1734–6. doi: 10.1126/science.271.5256.1734
