תַקצִיר
הלב הוא משאבה שמביאה דם לכל חלקי הגוף. סידן משחק תפקיד חשוב בפעילות החשמלית ובתפקודי הפעימה של הלב. חלקיקי סידן נכנסים אל תאי שריר הלב במהלך כל פעימת לב ותורמים לאות החשמלי שמתאם את תפקוד הלב. חלקיקי סידן גם נקשרים למנגנונים בתוך התא שמסייעים לתא להימחץ יחד (“להתכווץ”), מה שגורם ללב להזרים דם. במחלות מסוימות הדלתות ששולטות בתנועת הסידן לא מתפקדות כראוי מה שמוביל לאותות חשמליים אבנורמליים, אשר עלולים לגרום לקבוצה של מחלות לב שנקראות הפרעות בקצב הלב. נוסף על כך ויסות אבנורמלי של סידן עלול לפגוע באופן ישיר בתפקוד הפעימה או ההרפיה של הלב. מדענים זיהו שלקויות בטיפול בסידן משחקות תפקיד מרכזי בהרבה מחלות של הפרעות בקצב הלב. אולם למרות הפיתוחים בטכנולוגיות (ביו)רפואיות עדיין נותרו כמה שאלות חשובות על המנגנונים והטיפולים בבעיות שקשורות לסידן.
מדוע סידן חשוב כל כך ללב?
סידן נוכח במרבית המזונות כולל מוצרי חלב כמו חלב וגבינה, ולעיתים קרובות דגים קטנים וחלק מהירקות. במשך זמן רב ידוע שסידן תורם לחוזק של העצמות שלנו. כמו כן מדענים גילו שסידן משחק תפקיד חשוב בלב (איור 1). הלב פועם יותר מ-2 מיליארד פעמים בממוצע לאורך החיים כדי להזרים את הדם, אשר נדרש לסיפוק אנרגיה לכל האזורים בגוף. הלב מכיל, בין השאר, 3 מיליארד תאי שריר שנמחצים יחד (“מתכווצים”) במהלך כל פעימת לב ואחראיים על תפקוד הפעימה של הלב. כדי לוודא שכל תא מתכווץ ברגע הנכון, הלב משתמש באות חשמלי שזז מתא אל תא, ממש כמו גל של אוהדים באיצטדיון שָׁם פעילות של אדם אחד מפעילה את השכן. מחקרים שנערכו במהלך העשורים האחרונים גילו שחלקיקי סידן אחראיים על הקישור בין הפעלה חשמלית וכיווץ מכני (איור 1). חלקיקי סידן, שיש להם מטען חשמלי, נכנסים אל תאי שריר הלב במהלך כל פעימה ותורמים לאות החשמלי. נוסף על כך חלקיקי הסידן האלה מאתחלים את הכיווץ באמצעות היקשרות למנגנון מיוחד בתוך התא. כאשר הסידן נקשר המנגנון מתחיל לזוז ולגרום לתא להימחץ. מצד אחר כשחלקיקי הסידן מוסרים מתאי הלב זה מעורר הרפיה, מה שמאפשר ללב להתמלא מחדש עם דם לפני שמתחילה הפעימה הבאה. לכן, ללא סידן הלב היה מפסיק לפעום מיד, דבר שהודגם בניסוי על-ידי ד“ר סידני רינגר בשנות 1880 המוקדמות.
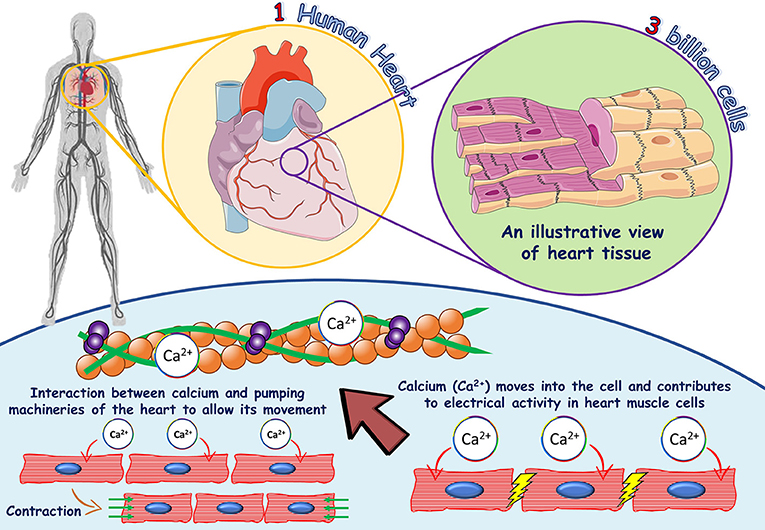
- איור 1 - תפקיד הסידן בתאי שריר הלב.
- לב אנושי אחד מכיל יותר משלושה מיליארד תאי שריר וכל תא מכיל את המנגנון שלו שתורם להתכוצות ולהרפייה של שריר הלב. האזור בכחול באיור מראה את התפקיד החשוב של סידן בתאי שריר הלב. סידן נקשר לקומפלקס הטרופונין (מסומן על ידי החץ האדום הגדול), אשר גורם לתאים להימחץ זה אל זה, תהליך שנקרא צימוד עירור-כיווץ (מוצג על ידי החיצים הירוקים בצד שמאל של האזור הכחול). נוסף על כך סידן תורם לאות החשמלי שנע מתא לתא ומייצר את הכיווץ האחיד (מוצג בצד ימין של האזור הכחול).
תא שריר הלב: בית עם הרבה דלתות וחדרים
תא שריר לב הוא כמו בית גדול עם הרבה דלתות וחללים (איור 2). חלקיקי סידן יכולים לזרום אל תוך התא ומחוץ לו באמצעות מבנים דמויי שַׁעַר שנקראים תעלות יונים [1]. תעלות היונים האלה מסייעות לתא לשלוט על כמות הסידן שבתוכו. נוסף על אספקת סידן מחוץ לתא ישנוֹ חלל גדול בתוך התא שנקרא רשתית סרקופלזמטית (SR – Sarcoplasmic reticulum), אשר מאחסן את מרבית הסידן שנדרש לכיווץ הלב. חלל הרשתית הסרקופלזמטית גם מכיל דלתות כניסה ויציאה עבור סידן. דלתות הכניסה נקראות SERCA ודלתות היציאה נקראות קולטני ריאנודין. הסידן שנכנס לתא הלב דרך תעלת יוני סידן מפעיל את קולטני הריאנודין כדי לשחרר מספיק סידן ל-SR ולאתחל את כיווץ שריר הלב. זה מתבצע באמצעות קשירת מבנה אחר, שנקרא טרופונין, בתוך תא שריר הלב. במהלך ההרפיה סידן מנותק מטרופונין ומסולק מחוץ לתא או מאוחסן בתוך ה-SR.
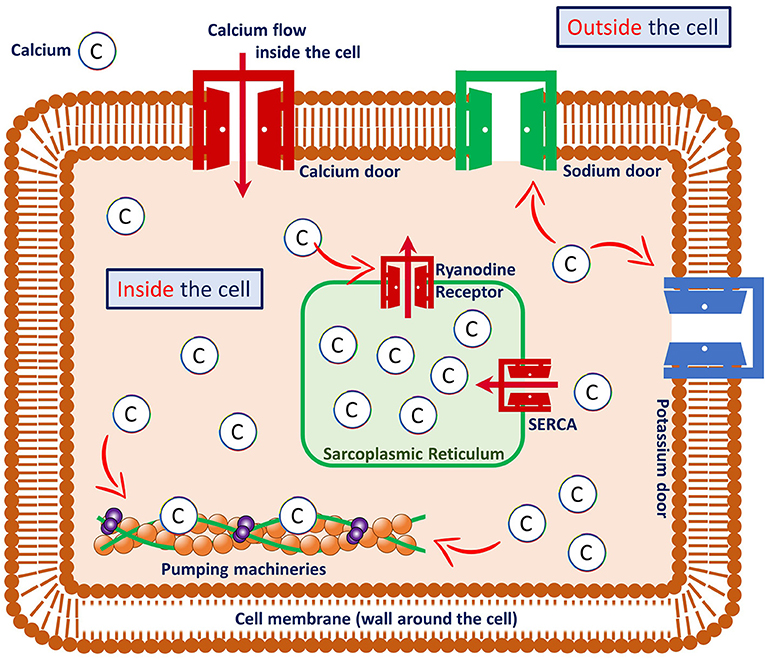
- איור 2 - תא שריר הלב ורכיביו.
- סידן נכנס לתא דרך ”דלתות“ שנקראות תעלות ומתקשר עם רכיבים שונים בתא. לדוגמה, סידן מווסת את הפתיחה והסגירה של דלתות של נתרן ואת קולטני הריאנודין, והוא קושר את קומפלקס הטרופונין כדי לגרום לתא הלב להימחץ (”להתכווץ“), מה שמייצר את תפקוד הפעימה של הלב. בתאי שריר הלב מרבית הסידן מאוחסן בתוך חלל שנקרא רשתית סרקופלזמטית SR–Sarcoplasmic) (reticulum הסידן ב-SR משוחרר במהלך התכווצות שריר הלב ומוסע חזרה לתוך ה-SR במהלך ההרפיה. חיצים אדומים מצביעים על תנועה/ זרימה של סידן מאזור אחד לאחר.
נוסף על דלתות הסידן, תאי שריר הלב מצוידים בדלתות אחרות שאחראיות על תנועות של חלקיקים אחרים אל תוך התא ומחוץ לו כמו למשל נתרן, זרחן וכלור. לאחרונה מדענים גילו שסידן יכול לווסת את הפעילות של הדלתות הנוספות האלה והוא גורם להן להיות קלות או קשות יותר לפתיחה, מה שמדגיש את האחריות הגדולה של סידן בתוך תאי שריר הלב [2].
מה קורה כשסידן יוצא משליטה?
בחלק מהמקרים הדלתות ששולטות בתנועה של סידן לא מתפקדות טוב, מה שגורם לכמות גדולה מדי או קטנה מדי של סידן להיכנס לתא. לעיתים, חוסר התפקוד הזה נגרם על-ידי קידום הגיל או מחלות אחרות. לחלופין, שינויים/ וריאציות בגנים שלנו (שנקראים מוטציות גנטיות) יכולים לשנות את הצורה של תעלת היונים, ובמקרים קיצוניים עלולים למנוע את הפתיחה או הסגירה התקינה של התעלה. זה יכול להוביל לאותות חשמליים אבנורמליים, שעשויים לגרום לקבוצה של מחלות לב שנקראות הפרעות בקצב הלב.
מחלות של הפרעות בקצב הלב מתרחשות כשהתקשורת החשמלית בין תאים הופכת לבלתי מתואמת או כשקבוצות של תאים מייצרות באופן ספונטני אותות חשמליים נוספים. כפי שציינו קודם, תקשורת חשמלית בלב דומה לגל של אוהדים באיצטדיון כדורגל, שגם נשען על תקשורת ברורה. אם האורות כבויים והצופים לא יכולים לראות זה את זה, התקשורת לא תתרחש ולא יתאפשר ליצור גל יפה. הגל גם עובד באופן תקין אם אנשים זזים רק כשהגל מגיע למושב שלהם. תנועה חשמלית כאוטית ובלתי מתואמת של הלב נקראת פרפור. פרפור גורם ללב להזרים דם באופן לא יעיל, מה שמוביל לאספקת אנרגיה נמוכה יותר לאיבריו של האדם.
כמו כן תנועה אבנורמלית של סידן עשויה לשבש באופן ישיר את הכיווץ או את ההרפיה של הלב, מה שימנע תפקוד פעימה תקין. תחת התנאים האלה, תאי הלב יכולים בסופו של דבר ”להתעייף“ ולהיכשל. אי ספיקת לב יכולה לגרום למגוון רחב של בעיות, החל מבעיות קלות (שיעול או עייפות) וכלה בבעיות חמורות (קוצר נשימה והתנפחות איברים). זה, כמובן, יפחית את היצרנות של האדם. לאחרונה מדענים מצאו שסידן קשור בחוזקה עם קידום של אי ספיקת לב. אי ספיקת לב גם מעלה את הסיכון לחלות במחלות קטלניות של הפרעות בקצב הלב [3].
מה מדענים עשו עד כה כדי להבין טוב יותר את תפקוד הסידן בלב?
בהינתן ההשפעה של מחלות לב אנו עשויים לתהות מה מדענים יכולים לעשות כדי להפסיק את התרחשות המחלות האלה. במשך כמה עשורים מדענים חקרו את תפקיד הסידן בתאי שריר הלב. הם יודעים כיום שבחלק ממחלות הלב כמו למשל פרפור ואי ספיקת לב, לקויות בוויסות הסידן משחקות תפקיד חשוב [2]. כיום מדענים יכולים לחקור תנועות של סידן על ידי לקיחת תא שריר אחד מחיות או ממטופלים וחקירת התאים הבודדים האלה באמצעות שיטה מתוחכמת שנקראת Patch clamp, אשר מאפשרת למדוד אותות חשמליים שעוברים דרך תעלות יונים מסוימות. זה מתבצע על-ידי חיבור מחט זכוכית קטנה מאוד (קטנה יותר מפי 20 משערה בודדת) לפני השטח של התא. מדענים גם יכולים למדוד את המספר של תעלות בתוך תא לב ואת מיקומן על-ידי חיבור סמנים שפולטים אור לתעלות, אשר אפשר לראות במיקרוסקופ. לאחרונה מדענים התחילו להשתמש במודלים ממוחשבים כדי לחבר את הנתונים האלה ולסייע להם לחזות את השפעת השינויים בוויסות הסידן על תאי הלב [4].
ההבנה המשופרת של הפרעות בקצב הלב סייעה לחזות אלה מטופלים יהיו בעלי סיכון גבוה לחוות את הבעיות האלה, והובילה לטיפולים טובים יותר [5]. לדוגמה, אפשר להשתמש בתרופות כדי לחסום את תעלות היונים כך שהדלתות יישארו סגורות וכמות הסידן בתא תהיה נשלטת. לחלופין, רופאים מומחים יכולים לשים מכשיר קטן בתוך הלב, דרך הוורידים, כדי להוציא את תאי הדם שמייצרים אותות בלתי רצויים כך שהם לא יגרמו יותר לפרפור (איור 3). למרות הפיתוחים המרשימים בטכנולוגיה ה(ביו)רפואית, עדיין נותרו כמה שאלות חשובות בנוגע למנגנונים ולטיפול בבעיות שקשורות בסידן בתוך תאי שריר הלב. כמה קבוצות מחקר ברחבי העולם עובדות קשה כדי לענות על השאלות האלה.
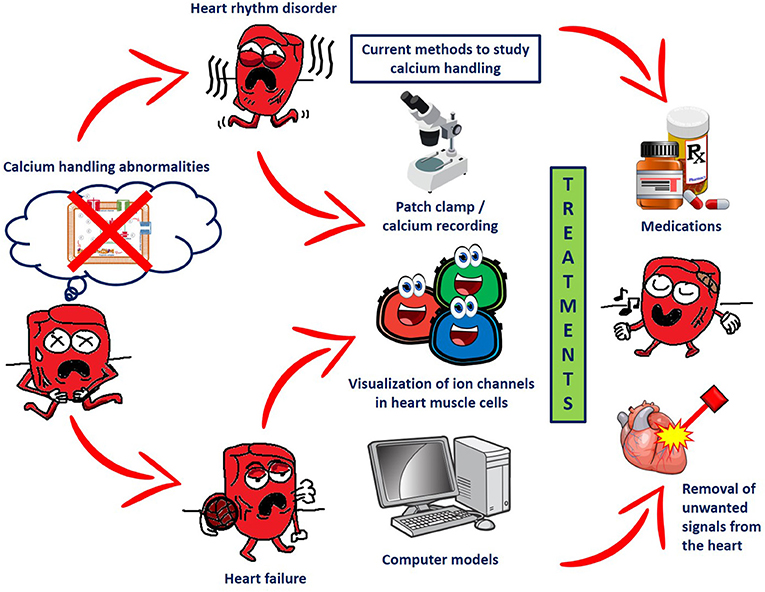
- איור 3 - השפעות של לקויות בטיפול בסידן בלב והשיטות העכשוויות לאתר בעיות אלה ולטפל בהן.
- בעיות בטיפול בסידן בתאי שריר הלב (מוצגות מצד שמאל) עשויות לגרום למחלות של הפרעות בקצב הלב או לאי ספיקת לב (חץ ראשון אדום). כמה שיטות זמינות כיום לחקירת תפקיד הסידן במחלות האלה כולל רישום סידן (recording calcium), סימון / צביעת חלבונים (staining/coloring protein) וניתוחים באמצעות מודלים ממוחשבים (מוצגים בטור השלישי). באמצעות השיטות האלה מפתחים טיפולים חדשים למחלות הלב האלה כולל תרופות שחוסמות את תעלות היונים ושיטות להסרת תאים בלב שמייצרים אותות חשמליים בלתי נשלטים (מוצגים מימין).
מילון מונחים
כיווץ (Contraction): ↑ מחיצה של תאי שריר הלב יחד, אשר גורמת ללב להזרים דם.
תעלת יונים (Ion channel): ↑ מבנים דמויי שַׁעַר בתאי שריר הלב שמאפשרים לחלקיקים טעונים להיכנס או לצאת מהתא.
קולטני ריאנודין (Ryanodine Receptor): ↑ שער סידן חשוב שממוקם בתוך תאי שריר הלב על המאגרים הבין-תאיים של סידן ב-sarcoplasmic reticulum.
מוטציה גנטית (Genetic mutation): ↑ וריאציה בגן שעשויה לשנות את תפקוד החלבון שמיוצר ממנו.
הפרעות בקצב הלב (Heart Rhythm Disorder): ↑ פעילות חשמלית לא תקינה בלב.
פרפור (Fibrillation): ↑ הפרעה מסוכנת בקצב הלב עם תנועה לא רגילה, מהירה מאוד של תאי שריר הלב.
אי ספיקת לב (Heart failure): ↑ מצב שבו הלב לא מסוגל להזרים מספיק דם לגוף.
Patch-Clamp: ↑ שיטה למדידת הפעילות של תעלות יוניות בתאי שריר הלב.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Bartos, D. C., Grandi, E., and Ripplinger, C. M. 2015. Ion channels in the heart. Compr. Physiol. 5:1423–64. doi: 10.1002/cphy.c140069
[2] ↑ Heijman, J., Schirmer, I., and Dobrev, D. 2016. The multiple proarrhythmic roles of cardiac calcium-handling abnormalities: triggered activity, conduction abnormalities, beat-to-beat variability, and adverse remodelling. Europace. 18:1452–4. doi: 10.1093/europace/euv417
[3] ↑ Johnson, D. M., and Antoons, G. 2018. Arrhythmogenic mechanisms in heart failure: linking beta-adrenergic stimulation, stretch, and calcium. Front. Physiol. 9:1453. doi: 10.3389/fphys.2018.01453
[4] ↑ Sutanto, H., van Sloun, B., Schonleitner, P., van Zandvoort, M., Antoons, G., and Heijman, J. 2018. The subcellular distribution of ryanodine receptors and L-type Ca2+ channels modulates Ca2+-transient properties and spontaneous Ca2+-release events in atrial cardiomyocytes. Front. Physiol. 9:1108. doi: 10.3389/fphys.2018.01108
[5] ↑ Heijman, J., Ghezelbash, S., and Dobrev, D. 2017. Investigational antiarrhythmic agents: promising drugs in early clinical development. Expert Opin. Invest. Drugs. 26:897–907. doi: 10.1080/13543784.2017.1353601
