תַקצִיר
האם ידעתם שניתן לקרוא את הדנ''א שלכם? אנו יודעים כי דנ''א הוא מקום אחסון מידע אשר הופך אותנו למי שאנו. כדי להבין מידע זה באמת, תחילה עלֵינו ללמוד לקרוא אותו. גֶּנִים הם מקטעי דנ''א הפועלים יחד כמו מדריך הפעלה השולט בתאי הגוף, בדיוק כפי שקודים מורים למחשב מה לבצע. במשך שנים רבות, לא היו בידינו הכלים לקריאת הקודים הגנטיים הללו. בשנות של המאה הקודמת, טכנולוגיה בשם 'ריצוף גנטי' אפשרה לקרוא את הקוד הגנטי של הדנ''א, ולפענחו. באמצעות הריצוף הגנטי, מדענים יכלו לקרוא מידע גנטי, להבינו ולהשוות בין מקטעי מידע שונים. זו הייתה פריצת דרך משמעותית בהבנתנו את תחום הביולוגיה. כיום, טכנולוגיות ריצוף ממלאות תפקיד חשוב בתחומים רבים, הָחֵל מטיפול במחלות, וכָלֶה בחקלאות. ריצוף גנטי היה גורם מכריע בזמן מגפת נגיף הקורונה שסייע לנו לחקור את הנגיף ולפתח עבורו חיסון במהירות.
גילוי ATCG
חומצה דֶאוֹקְסִירִיבּוֹנוּקְלֵאִית (דנ''א), החומר הגנטי של כל אורגניזם חי, התגלתה ב-1869 על ידי החוקר השוויצרי פרידריך מִישֶׁר. במקור ניסה מישֶׁר לחקור תאי דם לבנים, ובמהלך המחקר בודד מגרעין התא (ששמו הלטיני 'נוּקְלֶאוּס'), מולקולה חדשה, אשר לה הוא קרא נוּקְלֵאִין. בשנת 1953 המבנה של מולקולת הדנ''א זוהה על ידי הגנטיקאי האמריקאי ג'יימס ווטסון בשיתוף עם הביולוג והביופיזיקאי האנגלי פרנסיס קריק, בעזרת מידע משמעותי שתרמה רוזלינד פרנקלין, מדענית יהודייה אנגליה [1]. מבנהו של הדנ''א דומה לסולם מפותל (איור 1). ה'מוטות' הצידיים התומכים בכל שלב, מורכבים מקבוצת פוֹסְפָט [זַרְחָה, (PO-)] וממולקולת סוכר הנקראת פֶּנְטוֹז, אשר לה חמישה אטומי פחמן. השלבים עצמם עשויים ארבעה רכיבים הנקראים בסיסים חנקניים: אַדֶנִין (A); צִיטוֹזִין (C); גוּאַנִין (G) ותִימִין (T). חוק צָ'רְגָף (על שם הביוכימאי היהודי אמריקאי ארווין צ'רגף) מסביר כי בסיסים אלה מסתדרים בזוגות באופן זה: A הוא תמיד בן הזוג של T, ו-G הוא תמיד בן הזוג של C. יחד, מולקולת פוספט, סוכר פנטוז ובסיס חנקן יוצרים מבנה בשם נוּקְלֵאוֹטִיד. סידור הבסיסים בדנ''א חשוב מאוד, משום שֶׁרֶצֶף זה מייצג את הקוד הגנטי, בדיוק כשם שארגון נכון של אותיות האָלף-בֵּית מייצר מילים בעלוֹת משמעות. ה'מילים', או 'אבני הבניין' הללו, המכילות מידע, הן הגֶּנִים. הגנים מספקים הוראות ליצירת מאפיינים שונים, החל מצבע העיניים, וכלה בסוג הדם. המונח לתיאור אוסף כל הגנים הנמצאים בגוף הוא גֶּנוֹם. לכל בני ובנות זן מסוים יש גנום דומה, אך לא זהה. תכונותיו של הגנום האנושי ייחודיות לבני האנוש, אך שינויים קטנים בגנים יוצרים הבדלים בין אדם אחד למשנהו.
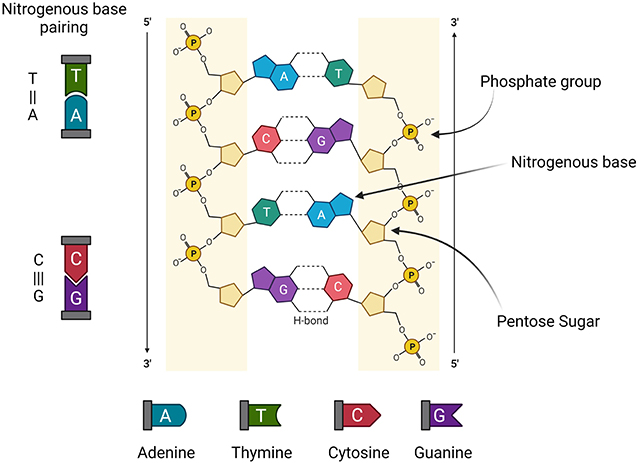
- איור 1 - הסליל הכפול – מבנה הדנ''א דמוי-הסולם, לפי המודל של ווטסון וקריק.
- צִדֵּי הסולם עשויים סוכרי פנטוז (Pentose Sugar, בעלי 5 פחמנים), וקבוצות פוספט (Phosphate group). שלבי הסולם הם ארבעת הבסיסים החנקניים (Nitrogenous bases). הבסיסים מסתדרים בזוגות קבועים: אַדֶנִין (Adenine, A) ותִימִין (T, Thymine); צִיטוֹזִין (C, Cytosine) וגוּאַנִין (G, Guanine) – באמצעות חיבור מולקולרי שנקרא 'קשר מימן' (H-bond). (האיור נוצר בעזרת https://biorender.com/).
ניסיונות ראשונים לפיצוח הקוד: שיטת סַנְגֶר לריצוף
לאחר ההצלחה אשר לה זכו ממצאיהם של ווטסון וקריק, מדענים הבינו באופן ברור את מבנה מולקולת הדנ''א ובסיסיה השונים. כעת הגיע תורהּ של השאלה: מה קובע את הסדר, או הרצף, שבו מופיעים הבסיסים לאורך הדנ''א? תהליך זה נקרא רִיצוּף גֶּנֶטִי.
בשנת 1975, הביוכימאי האנגלי פְרֶדֶרִיק סַנְגֶר ביצע פריצת דרך עצומה בתחום הריצוף הגנטי, כאשר פיתח שיטה בשם 'תחימת מקטעים' (מניעת המשך התארכות שרשרת ה-דנ''א) [2]. דנ''א משתכפל בתאי הגוף האנושי כדי לייצר עותקים זהים של עצמו, בעזרת שימוש בנוּקְלֵאוֹטִידִים (A, T, G, C) כאבני בניין. שיטת הריצוף של סַנְגֶר התבססה על 'השתלטות' על התהליך הטבעי של שכפול הדנ''א. לנוקלאוטידים הרגילים, הוא הוסיף נוקלאוטידים שאותם שינה בתהליך כימי, כל אחד מהם בעל סימון רדיואקטיבי (מאוחר יותר, את הַסַּמָּנִים הרדיואקטיביים החליפו סמנים פְלוּאוֹרֶסְצֶנְטִיים, שהם פחות מסוכנים). הנוקלאוטידים הללו ששונו כימית, קטעוּ את שכפול הדנ''א בנקודות אקראיות כאשר שילבו אותם בגְּדִיל הדנ''א המשתכפל. השכפול נקטע באופן אקראי ויצר כמה מקטעי דנ''א באורכים שונים, שכל אחד מהם מסתיים בנוקלאוטיד שעבר שינוי כימי, בעל סימון רדיואקטיבי (או צבעוני). כאשר סַנְגֶר בחן את כל המקטעים הללו, הוא הצליח לפענח את ריצוף גדיל הדנ''א המקורי על ידי ארגון המקטעים בסדר הנכון והרכבתם יחד – מהקטן ביותר לַגדול ביותר, כדי לְדַמּוֹת את רצף הדנ''א השלם. לדוגמה, המקטע הקטן ביותר, באורך נוקלאוטיד אחד בלבד, הוא גרסה ששונתה כימית של A, T, C או G. דבר זה הצביע על הבסיס הראשון של הדנ''א המקורי שרֻצַּף (איור 2). השיטה של סנגר סללה את הדרך לפרויקטים של ריצוף גנטי בקנה מידה גדול, כמו פרויקט הַגֶּנוֹם האנושי.
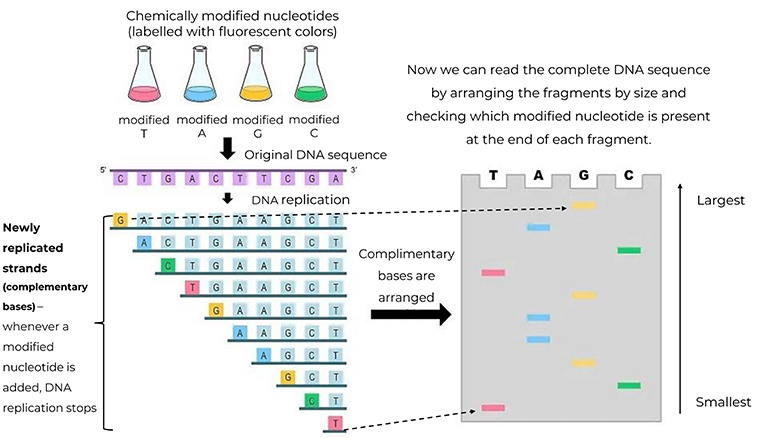
- איור 2 - הוספה של נוקלאוטידים שעברו שינוי כימי (A, T, G ו-C) המסומנים בצבעים פלוּאוֹרסצנטיים, לתערובת השכפול הגנטי (DNA replication mixture).
- כאשר מוסיפים נוקלאוטידים שעברו שינוי כימי לסליל הדנ''א, תהליך השכפול נפסק. דבר זה מייצר מקטעי דנ''א תואמים באורכים שונים, שניתן לארגן כדי לקבוע את הרצף המקורי של הדנ''א, על ידי חוק התאמת זוגות הבסיסים (A נקשר ל-T ו-G נקשר ל-C). זהו תהליך מורכב שיש בו מקום רב לטעויות. מקרא (מלמעלה למטה, ובעקבות החיצים): נוקלאוטידים שעברו שינוי כימי (מסומנים בצבעים פלואורסצנטיים) ← רצף הדנ''א המקורי ← תהליך שכפול דנ''א ← גדילים חדשים ששוכפלו (בסיסים תואמים) – כאשר מוסיפים נוקלאוטידים ששונו כימית לגדיל הדנ''א, תהליך השכפול נפסק ← ארגון הבסיסים התואמים (מהקטן לגדול) ← עכשיו ביכולתנו לקרוא את רצף הדנ''א השלם על ידי ארגון המקטעים לפי הגודל, ובדיקה איזה נוקלאוטיד שעבר שינוי כימי נמצא בקצה כל מקטע.
פרויקט הגנום האנושי
פרויקט הגנום האנושי (HGP) היה מיזם בינלאומי עצום, שבו לקחו חלק מדענים מכל רחבי העולם. הם החלו את המחקר ועבדו בקדחתנות במשך 13 שנים במטרה להבין את הגנום האנושי. המדענים שקידמו את המחקר השלימו את ריצוף הגנום האנושי העצום (אשר מכיל 3.2 מיליארד זוגות בסיסים) בשנת 2003 – ועדיין הצליחו להקדים את לוח הזמנים! פרויקט זה היווה ציון דרך משמעותי. לראשונה, למדענים הייתה היכולת לקרוא את כל 'תוכניות ההפעלה' הגנטיות של בני האדם, שפתחו דלתות לתגליות חדשות ומרגשות. ריצוף הגנום האנושי השלם היה צעד אדיר בשיפור בריאות האדם [3].
עם זה חשוב לדעת כי טכניקות הריצוף הגנטי שבהן השתמשו להשׂגת תוצאות אלה צרכו זמן רב, ולא היו יעילוֹת. למרות התוצאות פורצות הדרך של פרויקט הגנום האנושי, לידתן של טכנולוגיות מתקדמות יותר כגון ריצוף הדור הבא (NGS), תרמה באופן ניכר למזעור הטעויות בריצוף הגנטי, ושיפרה את מידת הדיוק שלו. ריצוף הדור הבא שינה את פני תעשיית שירותי הבריאות בכך שהפחית את עלויות הריצוף ואת הזמן הדרוש לאבחון. נכון לזמן כתיבת מאמר זה, ניתן לרצף את כל הגנום האנושי בתוך שש שעות בלבד!
מהו ריצוף גנטי של הדור הבא?
ב-2006, חֶבְרָה אמריקאית בשם אִילוּמִינָה (Illumina) הודיעה על פיתוח משמעותי בתחום הריצוף הגנטי. חוקריה הצליחו לרצף בו בזמן מספר גדול של גדילי דנ''א. מהירות גבוהה זו אפשרה ריצוף גנטי של כל הגנום האנושי בתוך פחות מיום אחד. ההבדל בין שיטה זו לשיטות ריצוף קודמות הוא שהשיטה החדשה אינה מסתמכת על תחימת מקטעים. במקום זאת, בשיטה החדשה, כאשר מוסיפים בסיס חדש לגדיל הדנ''א המשתכפל, נפלט אות פלואורסצנטי תואם, המזוהה בזמן אמת (איור 3).
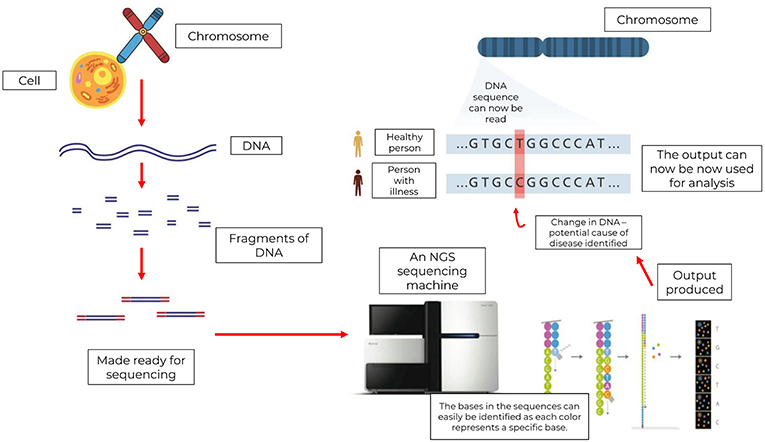
- איור 3 - בתהליך ריצוף הדור הבא, מסירים מהתאים גדילי דנ''א רבים, וחותכים אותם למקטעים קטנים יותר.
- לאחר מכן מכינים את המקטעים הללו לריצוף על ידי הַנָּחָתָם בצלחת המכונה 'תא זרימה' (Flow cell), המכילה את תערובת התגובה (Reaction mixture). הַמְּרַצֵּף מְבצע כמה תגובות כימיות וקורא את הרצפים, בכך שהוא מזהה את הצבעים הפלואורסצנטיים המשתחררים מתא הזרימה בכל פעם שבסיס חדש מתווסף. ניתן לפענח את הסימנים הללו באמצעות תוכנה, אשר בונה עותק דיגיטלי של הרצף המקורי של הדנ''א. כעת, מדענים יכולים להשתמש במידע זה כדי לחפש שינויים בגנים שעשויים לגרום למחלות, כמו סרטן.
מקרא (מלמעלה למטה, ובעקבות החיצים): כרומוזום← תא ← דנ''א ← מקטעי דנ''א ← מוכנים לריצוף ← מכונת ריצוף מהדור הבא ← ניתן לזהות בקלות את הבסיסים ברצפים, כאשר כל צבע מייצג בסיס מסוים ← תוצר ← כעת ניתן להשתמש בתוצר עבור ניתוח נתונים ← ניתן לקרוא את רצף הדנ''א ← אדם בריא. או לחלופין: תוצר ← שינוי בדנ''א – זוהה גורם אפשרי למחלה ← כעת ניתן להשתמש בתוצר עבור ניתוח נתונים ← ניתן לקרוא את רצף הדנ''א ← אדם המתמודד עם מחלה.
ריצוף גנטי – שימושים עכשוויים
טיפול בסרטן
מחלת הסרטן תמיד אתגרה את עולם הרפואה, כיוון שישנם סוגי סרטן שונים, ואפילו אותו סוג סרטן עשוי להתנהג בצורה שונה בקֶרֶב חולים שונים. סרטן עלול להיגרם עקב טעויות ייחודיות בדנ''א, שאותן אפשר לזהות על ידי ריצוף גנטי. כיום, מדענים משתמשים בריצוף בטכניקת הדור הבא כדי לנתח את נתוני הגנום של חולה פרטני, ולזהות את הטעויות בדנ''א הייחודיות לכל אדם. הדבר עוזר לרופאים לגבש תוכנית טיפול המותאמת אישית לצרכיו של כל חולה. לדוגמה, שני חולים המתמודדים עם סוג זהה של סרטן עשויים להגיב לאותה תרופה באופן שונה. כך, טיפול שירפא חולה אחד, לא יהיה יעיל עבור החולה האחר. ניתן לזהות שינויים קלים בגנום של שני אנשים פרטניים, וזה יכול לסייע לרופאים להבין איך להתאים טיפול לבני אדם שונים, בהתבסס על ההבדלים הגנטיים בין בני האדם [4]. טיפול מסוג זה נקרא 'רפואה מותאמת אישית'.
אבוֹלוּציה
החיים על פני כדור הארץ החלו מאורגניזמים בעלי תא יחיד, אשר הפכו מורכבים יותר ויותר. חיות הן צורות החיים המורכבות ביותר בכדור הארץ. כיום, עושים שימוש בריצוף הדור הבא כדי להשוות את הגנום האנושי לגנום של חיות אחרות. הדבר עשוי לספּק לנו פרטים מדהימים על אודות מידת הדמיון או השוני בינינו לבין חיות אחרות. נוסף על כך למוּטַצְיוֹת (תמורות בדנ''א) קטנות, הקיימות באורגניזמים בני אותו זן, תפקיד חשוב באבולוציה, כיוון שכל מוטציה עשויה לשנות לעד חלק מהגנום של אותו הזן. ריצוף בטכניקת הדור הבא מאפשר למדענים לחקור כיצד מוטציות הצטברו לאורך תהליך האבולוציה.
חיסונים
מתהליך ההתחקות אַחַר מוצאו של נגיף סַארְס-קוֹב-2 הגורם למחלת קוֹבִיד-19, ועד לפיתוח המהיר של החיסונים, ריצוף גנטי הציע סיוע עצום במהלך מגפת הקורונה. החיסונים מלמדים את המערכת החיסונית לזהות איומים ולחסלם. ריצוף הדור הבא סייע למדענים לְרַצֵּף את נגיף סַארְס-קוֹב-2, וכך ללמוד עוד על המאפיינים הגנטיים של הנגיף אשר מציבים אִיּוּם בפני מערכת החיסון, כמו זִיזֵי החלבון (המכונים 'ספּייקים'). ריצוף הדור הבא היה שימושי אף במעקב אחר וַרְיאַַנְטִים חדשים של הנגיף, כלומר גרסאות שונות שלו – גם נגיפים מתפתחים!
אלרגיות
ודאי שמעתם על אודות אלרגיה לגְלוּטֶן, או על רגישוּת ללַקְטוֹז. ריצוף הדור הבא מסייע למדענים לזהות אם אדם עשוי להיות אלרגי לגלוטן או רגיש ללקטוז, על ידי ניתוח נתוני הגנום של אותו אדם. רִצְפֵי דנ''א מסוימים עלולים לגרום לאדם להיות מוּעד יותר לפיתוח אלרגיות.
מיקרואורגניזמים מועילים
לא כל המיקרואורגניזמים החיים בתוך גוף האדם מזיקים. מיקרואורגניזמים 'טובים' מסייעים לנו להילחם בזיהומים. המִיקְרוֹבִּיוֹטָה של מערכת העיכול היא קהילה של מיקרואורגניזמים החיים במערכת העיכול של בני האדם. אפשר לחשוב על מיקרואורגניזמים אלה כעל ה'גנום השני' שלנו, מאחר שהם משפיעים על מערכת החיסון ועל בריאותנו הכללית [5]. לא קל לחקור את המיקרוביוטה של מערכת העיכול במעבדה, אך אפשר להיעזר בריצוף הדור הבא כדי לנתח את נתוני הגנום של האורגניזמים הללו, וכך להבין כיצד הם מְתפקדים. 'פרויקט מערכת העיכול האמריקני'1 היה יוזמַת המדע האזרחית הגדולה ביותר בעולם, ועָסַק בניתוח נתוני המיקרואורגניזמים שחיים בתוך המעיים של כ-11,000 אנשים. דבר זה התאפשר הודות לריצוף הדור הבא.
סיכום
לסיום, ניתן לומר כי ריצוף דנ''א חולל מהפכה במחקר מדעי החיים, וסלל את הדרך למַתַּן שירותי בריאות מדויקים ויעילים יותר. ריצוף הדור הבא הפך את הטכניקה הזו מהירה יותר ובהישג יד בהיבט עלותהּ. בשנים האחרונות פותחו טכניקות מתקדמות יותר של ריצוף דנ''א, דוגמת ה'אוקספורד נָנוֹפּוֹר' (Oxford Nanopore). שיטות אלה מהירות ומדויקות אפילו יותר! עם זה על אף שאנו יכולים לְרַצֵּף דנ''א, עדיין לא פותחה שיטה לריצוף חלבונים. זֶהוּ אחד הפיתוחים שאנו מצפים להם יותר מכל בתחום הביולוגיה. אנו מקווים כי אחת או אחד מכם, קוראינו הצעירים, יצליחו להגיע להישג הגדול הזה!
הערת שוליים
למידע נוסף על אודות המיזם, ראו עמוד הפייסבוק של הפרויקט, בכתובת: https://www.facebook.com/AmericanGut.
מילון מונחים
בסיסים חנקניים (Nitrogenous Bases): ↑ מולקולות המכילות חנקן. מהוות רכיבים חשובים של הדנ''א.
נוּקְלֵאוֹטִיד (Nucleotide): ↑ רכיב בדנ''א אשר מכיל מולקולת פוספט, מולקולת סוכר ובסיס חנקני.
גֶּן (Gene): ↑ חלק מרצף דנ''א המכיל את הקוד לייצור חלבון.
גֶּנוֹם (Genome): ↑ מכלול הגֶנים של יצור חי.
רִיצוּף גֶּנֶטִי (DNA Sequencing): ↑ תהליך קביעת רצף הבסיסים החנקניים במקטע דנ''א.
פרויקט הגנום האנושי (Human Genome Project): ↑ מיזם מחקר בינלאומי שמטרתו הייתה קביעת רצף כל הגנים בגוף האנושי.
ריצוף גנטי מהדור הבא (Next-generation Sequencing, NGS): ↑ שיטה חדשנית ומהירה של ריצוף גנטי, המסוגלת לקרוא נפחים גדולים של מקטעי דנ''א בו בזמן.
מוּטַצְיָה (Mutation): ↑ כל שינוי ברצף הדנ”א העשוי להשפיע על תפקוד הגֶּן, או שלא להשפיע עליו.
הצהרת ניגוד אינטרסים
המחברים מצהירים כל המחקר נערך בהעדר כי קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Watson, J., and Crick, F. 1953. Molecular structure of nucleic acids: a structure for deoxyribose nucleic acid. Nature 171:737–38. doi: 10.1038/171737a0
[2] ↑ Heather, J. M., and Chain, B. 2016. The sequence of sequencers: the history of sequencing DNA. Genomics 107:1–8. doi: 10.1016/j.ygeno.2015.11.003
[3] ↑ Green, E. D., Watson, J. D., and Collins, F. S. 2015. Human genome project: twenty-five years of big biology. Nature 526:29–31. doi: 10.1038/526029a
[4] ↑ Gupta, A. K., and Gupta, U. D. 2014. “Next generation sequencing and its applications,” in Animal Biotechnology (Elsevier). p. 345–67. doi: 10.1016/b978-0-12-416002-6.00019-5
[5] ↑ Cao, Y., Fanning, S., Pross, S., Jordan, K., and Srikumar, S. 2017. A review on the applications of next generation sequencing technologies as applied to food-related microbiome studies. Front. Microbiol. 8:1829. doi: 10.3389/fmicb.2017.01829
