摘要
全球有数千名患者急需器官移植来救命, 但器官短缺是一大难题。经过基因编辑的动物器官——尤其是猪器官——或许将成为破局关键。借助基因编辑技术, 科学家能够修改猪器官的 DNA: 通过敲除引发人体排异反应的基因并去除危险病毒基因, 使这些器官更安全、更适配人体。目前, 该技术已进入临床试验阶段, 移植到患者体内的猪肾脏和心脏为后续改良提供了宝贵数据。科学家还在研究如何通过移植猪细胞来治疗糖尿病、帕金森病等疾病。尽管存在挑战与伦理争议, 这项技术每年有望挽救数千人的生命。随着研究的深入, 基因编辑器官将为需要移植的患者带来重获新生的希望。
器官移植需求居高不下
设想一下: 你身患重病, 必需移植心脏或肾脏才能存活, 却被告知可能要等上好几年, 还不一定能获得合适的器官。这正是数千名需要器官移植的患者面临的真实困境。虽然这项技术已拯救了数百万患者的生命, 但器官需求始终远超供给。每个移植案例背后都有一名危在旦夕的患者——许多人需要依靠仪器维持生命, 在等待中煎熬。对很多家庭而言, 每一天都是在与死神赛跑。
器官移植完全依赖捐献者, 即供体——这些人要么在离世后捐献器官, 要么在生前捐献单侧肾脏或部分肝脏等活体器官。接受移植的患者被称为受体。肾脏、心脏、肝脏和肺脏都是常见移植器官, 但等待名单始终很长: 在美国, 有超过 10 万人正在等待器官移植, 而今年能完成的移植手术仅有约 3 万例。有些患者可能要等待好多年, 遗憾的是, 许多人等不了那么久。
即便找到匹配的器官, 还面临一项重大挑战: 排异反应。保护人体的免疫系统会将移植器官视为陌生入侵者并发起攻击, 就像对抗病毒或细菌那样。为预防排异反应, 患者需要服用抑制免疫系统的药物, 但这些药物会产生副作用, 且在阻止排异反应方面并非总是有效。
为解决器官短缺难题, 科学家们决定另辟蹊径: 动物——特别是猪(图 1)。一个名为“异种移植”的新领域正在研究如何用动物器官挽救人类生命。不过, 既然人体连同类器官都会排斥, 又怎么可能接受来自其他物种的器官呢?
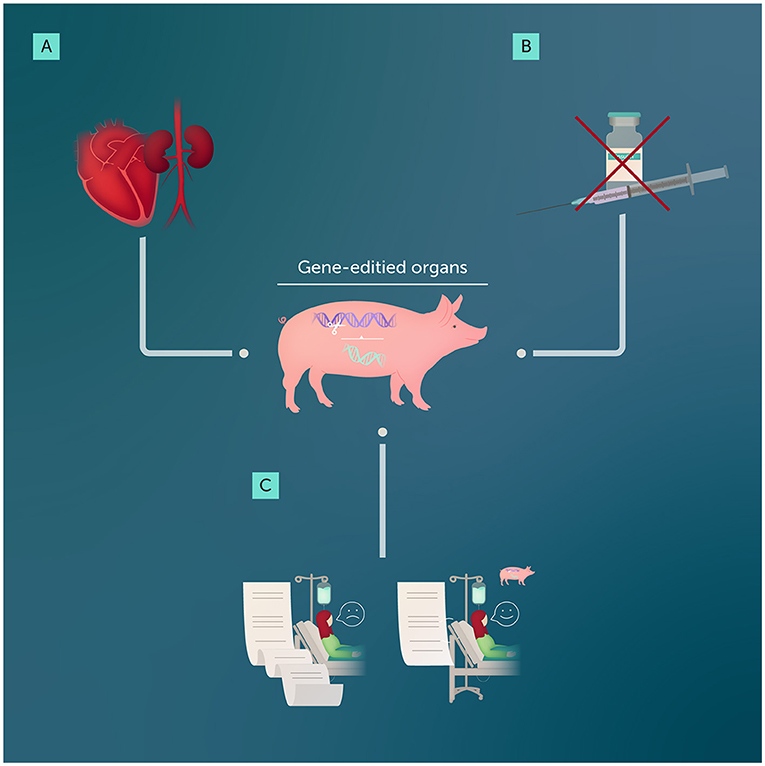
- 图 1 - 基因编辑技术可使动物器官适合人体移植: (A) 早期将猪心和猪肾移植至人体的案例为科学家和医生提供了宝贵数据, 有助于提升异种移植的安全性并降低排异风险; (B) 经基因编辑的猪胰腺细胞可减少糖尿病患者对胰岛素注射的依赖; (C) 总体而言, 成功的基因编辑器官异种移植可缩短患者等待名单, 每年拯救成千上万的生命。
新兴技术: 基因编辑器官
为使动物器官适合人体移植, 科学家借助一种名为基因编辑的强大工具。该技术能精确修改动物 DNA ——即控制细胞生长与功能的指令。目前最常用的基因编辑工具之一是 CRISPR-Cas9。
这项技术就像一把“分子剪刀”, 能够在特定 DNA 位点进行精准的剪切与粘贴操作。
在异种移植中, 基因编辑主要解决两大难题: 首先是免疫排异问题。人类免疫系统会自动将猪器官视为威胁并发起攻击。为此, 科学家在猪胚胎阶段就对其 DNA 进行编辑, 关闭某些会触发人类免疫反应的猪基因, 同时添加人类基因以增强器官与人体的相容性。这些猪器官在生长发育过程中始终带有编辑痕迹, 待发育成熟后即可用于移植。其次是生物安全性问题。与人类和其他动物类似, 猪的 DNA 中也存在祖先感染病毒后残留的病毒基因片段, 如同古老的“遗传伤疤”。这些病毒基因通常处于休眠状态, 但移植后仍有微小概率在人体内被激活并引发疾病。借助基因编辑技术, 科学家可精准移除这些潜在风险基因, 显著提升移植器官的安全性。
借助基因编辑技术, 科学家可改造猪心或猪肾等器官, 使其在人体内正常运转, 不造成伤害(图 1)。在某些案例中, 为确保移植器官的安全性和有效性, 科学家需要对猪 DNA 进行多重编辑, 通常涉及大约 10 处修改, 有时甚至高达 69 处 [1]。
通过新技术拯救生命
基因编辑器官已展现出巨大的医疗潜力。2024 年, 一只基因编辑猪肾被成功移植至人类患者体内 [2]。这项突破性手术验证了异种移植的可行性, 为后续研究铺平了道路。尽管患者在术后两个月离世, 但其死因与移植器官无关。还有多位人类患者接受了基因编辑猪心移植 [3, 4]。虽然他们未能长期存活, 但这些早期案例为改良这项技术、提升其安全性提供了宝贵数据。
基因编辑猪器官还有望治疗糖尿病等疾病。当分泌胰岛素的胰腺功能失常时, 就会引发糖尿病。作为一种关键激素, 胰岛素能促使血糖进入细胞并转化为能量。1 型糖尿病患者通常需要每日注射胰岛素来维持血糖稳定。科学家正在探索如何将基因编辑猪胰腺中的胰岛细胞(即负责生产胰岛素的细胞)移植至糖尿病患者体内(图 1)。这些细胞可能帮助胰腺恢复功能, 减少甚至消除患者对每日胰岛素注射的依赖。
除糖尿病外, 基因编辑猪细胞还可能治疗其他疾病。帕金森病是一种影响运动和协调功能的脑部疾病, 或许可通过移植猪脑细胞来替代患者受损的脑细胞, 从而减轻症状并提升生活质量。科学家还在研究如何利用基因编辑猪细胞修复其他受损组织, 或治疗肝衰竭等疾病。
重大挑战与更大机遇
尽管前路依然漫长, 基因编辑器官在异种移植领域的应用为化解器官短缺危机带来了希望之光。当前仍需攻克的首要障碍是排异风险。即便经过基因编辑, 医生仍需密切监测患者情况, 并使用特殊药物帮助他们的身体接受移植器官。科学家正在努力优化基因编辑流程, 以增强猪器官与人体的相容性。
安全性是另一项重要考量。正如前文所述, 猪的 DNA 中天然存在的病毒基因可能在移植过程中对人类构成威胁。虽然基因编辑技术能有效剔除这些病毒基因, 但仍需通过更多试验来确保移植器官绝对安全。
伦理问题同样值得深思: 如何在拯救人类生命的同时保障动物福祉?这些关键议题将直接影响异种移植技术的未来发展与应用方向。
随着基因编辑技术的持续突破, 异种移植有望每年挽救成千上万的生命。想象这样一个世界: 不再有人为等待救命器官而煎熬数年, 也不再为移植排异反应而忧心忡忡。科学家、医生与政策制定者正携手推动这一愿景成为现实, 为全球患者及其家庭带来重生希望。
术语表
器官移植 (Organ Transplants): ↑ 一种医疗手术, 将来自人或动物的健康器官植入受体体内, 以替代受损或衰竭器官。
供体 (Donor): ↑ 去世后(或在某些情况下生前)捐献器官用于移植的人或动物。
受体 (Recipient): ↑ 接受器官移植的人。
排异反应 (Rejection): ↑ 受体免疫系统将移植器官视为威胁并发起攻击, 导致器官受损。
免疫系统 (Immune System): ↑ 人体抵抗病菌和感染的防御体系, 有时会误将移植器官识别为危险入侵物而发起攻击。
异种移植 (Xenotransplantation): ↑ 将某个物种(如猪)的器官或细胞移植到另一个物种(如人类)体内。
基因编辑 (Gene Editing): ↑ 一种修改 DNA(细胞运行指令)的技术, 能够使动植物更适合特定用途, 例如培育与人体相容的器官。
利益冲突声明
作者声明本研究不涉及任何潜在商业或财务关系。
致謝
由 SJD Consulting, LLC. 科学撰稿人/编辑、毕业于美国马萨诸塞大学陈氏医学院晨兴生物医学研究生院的 Susan Debad 博士参与撰写和编辑。图表制作方为Somersault18:24。
AI 人工智能工具使用声明
本文中所有图表附带的替代文本(alt text)均由 Frontiers 出版社在人工智能支持下生成。我们已采取合理措施确保其准确性,包括在可行情况下经由作者审核。如发现任何问题,请随时联系我们。
原文
↑ Cooper, D. K.、Cozzi, E.、Ling, G. 和 Meyerson, B. 2024. ”Genomics for transplants. Gene-editing organs for transplantation advancements”, 2024 年十大新兴技术报告, 世界经济论坛, 链接: https://www.weforum.org/publications/top-10-emerging-technologies-2024/
参考文献
[1] ↑ Anand, R. P., Layer, J. V., Heja, D., Hirose, T., Lassiter, G., Firl, D. J., et al. 2023. Design and testing of a humanized porcine donor for xenotransplantation. Nature 622:393–401. doi: 10.1038/s41586-023-06594-4
[2] ↑ Mallapaty, S., and Kozlov, M. 2024. First pig kidney transplant in a person: what it means for the future. Nature 628:13–4. doi: 10.1038/d41586-024-00879-y
[3] ↑ Griffith, B. P., Goerlich, C. E., Singh, A. K., Rothblatt, M., Lau, C. L., Shah, A., et al. 2022. Genetically-modified porcine-to-human cardiac xenotransplantation. N. Engl. J. Med. 387:35–44. doi: 10.1056/NEJMoa2201422
[4] ↑ Cooper, D. K. C., and Cozzi, E. 2024. Clinical pig heart xenotransplantation - where do we go from here? Transpl. Int. 37:12592. doi: 10.3389/ti.2024.12592
