摘要
我们的生活体验由感官塑造,我们通过视觉、 听觉、 嗅觉、 触觉与味觉感知周遭事物,并以此认识世界。 我的研究聚焦于受体,它们是位于细胞膜上的微型感知结构, 能够对环境或体内的刺激做出反应。 本文介绍的受体对疼痛与热量敏感, 既能感知高温也能响应辣椒等辛辣物质。 我们认为, 通过解析这些受体的结构并深入了解其运作机制, 便能开发出更高效安全的慢性疼痛治疗药物。 阅读本文, 了解辣椒如何为我们揭开疼痛感的神秘面纱, 为未来的疼痛治疗指明新方向。
David Julius 教授与 Ardem Patapoutian 教授因发现温度与触觉受体, 共同获得 2021 年诺贝尔生理学或医学奖。
我们为什么会感到疼痛?
对所有动物 (包括人类) 而言, 疼痛是一种至关重要的感觉。 它提示我们身体受伤需要护理, 或者应当停止或避免进行可能有害的活动。 根据科学定义, 疼痛属于躯体感觉 ——即感知触觉、 温度、 疼痛及肢体空间位置和运动的能力。 遍布全身、 名为 受体的微型感知结构负责执行此功能:神经细胞膜上的受体响应环境刺激 (如杯中热水) 后, 躯体感觉神经细胞会向相关脑区发送信号予以处理解析 (图 1)。
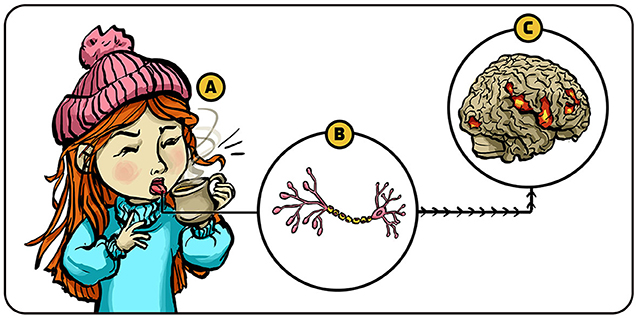
- 图 1 - 躯体感觉: (A) 以舌部为例, 特殊神经细胞膜表面的受体结构感知到温度、 疼痛等刺激; (B) 此时受体在神经细胞中产生电信号并传至大脑; (C) 大脑特定区域解析这些信号 —— 让女孩发觉喝到的水很烫。
本文将聚焦离子通道受体。 这类受体通过细胞膜上类似小“隧道”或“闸门”的离子通道响应环境刺激, 产生电信号 (关于离子通道的详细介绍, 请参阅这篇诺贝尔奖合辑文章)。 作为感知内外环境的核心, 离子通道受体是十分复杂精妙的信号传导系统。 近年来, 科学家已开发出研究其结构与功能的先进工具:例如, 冷冻电镜技术可通过电子穿透冷冻样本获取受体高清图像, 并构建三维模型;膜片钳技术则可测量流经离子通道的电荷, 以便研究受体的电生理特性。
这些方法帮助我们解答关于疼痛感知的基础科学问题, 进而推动新型镇痛药物的研发。 正常运转的疼痛敏感离子通道受体能保护人体免受生理伤害, 不过这种保护机制偶尔会失效或失控, 此时人体可能产生慢性疼痛, 即持续存在、 难以发挥保护效果的疼痛。 传统镇痛药 (又叫止痛剂, 如阿司匹林) 虽能有效缓解急性疼痛, 但对慢性疼痛疗效有限。 此外, 吗啡等常见镇痛药 (止痛剂) 具有成瘾性, 还有头晕、 恶心、 呕吐等副作用 [1] 。
成瘾性镇痛药滥用已引发“阿片危机”, 导致许多人因药物成瘾而健康受损。 我们希望深入了解疼痛受体、 特别是离子通道疼痛受体, 从而开发出针对慢性疼痛更有效的新型镇痛药, 助力解决阿片危机。 在探讨可能从疼痛受体研究中诞生的新药之前, 让我们先来简单了解我和同事发现的疼痛受体家族。
辣椒与疼痛受体
我一直对感官的运行机制, 还有某些化学物质 (特别是天然物质) 影响身心的方式很感兴趣。 在研究工作中, 我将这两种兴趣结合, 探索躯体感觉的工作原理, 尤其想弄清楚人类如何通过伤害性感知检测潜在有害刺激。
20 世纪 70 年代, 科学家发现辣椒素 (辣椒中引发灼烧感的成分) 能激活特定感觉神经末梢的伤害性感受器, 从而在大鼠眼部引发疼痛感 [2] 。 十年后, 研究发现辣椒素可促使钙离子等流入伤害性感觉神经元来引发疼痛 [3] 。 这些发现为我和学生提供了解密的关键线索: 感觉神经细胞中是否存在辣椒素特异性受体? 如果存在, 其结构如何? 在疼痛感知中发挥什么作用?
为解答这些问题, 我们决定寻找编码辣椒素受体特异性蛋白的基因。 由于不了解该受体及其基因的特征, 我们仅能依靠有限的线索去搜寻。 根据分子生物学中心法则, 任何蛋白质、 包括疼痛受体的合成都涉及 mRNA ——这种分子携带 DNA 中产生蛋白质的指令。 我们的做法是:提取疼痛响应神经细胞 (图 2A), 分离出编码疼痛受体的 mRNA (图 2B), 再将其逆转录为对应的 DNA 基因 (图 2C) [4] 。 (关于 mRNA 的详细介绍, 请参阅 这篇诺贝尔奖合辑文章; 关于将 mRNA 逆转录为 DNA 的详细介绍, 请参阅 这篇诺贝尔奖合辑文章)。
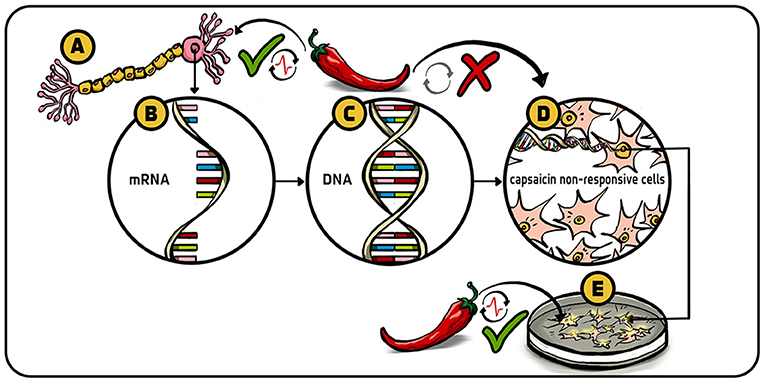
- 图 2 - 寻找辣椒素受体基因: (A) 伤害性感觉神经元响应辣椒素并向大脑传递疼痛信息; (B) 从这些细胞中提取可能编码辣椒素受体的 mRNA; (C) 将筛选的 mRNA 逆转录为原始 DNA (基因) , 构建包含一条或多条辣椒素响应蛋白编码序列的 DNA 文库; (D) 将 DNA 片段导入原本对辣椒素无反应的细胞; (E) 导入 DNA 后能够响应辣椒素的细胞即含有辣椒素基因的细胞。 经过大量筛查, 最终锁定单个辣椒素受体基因。
为此, 我们创建了包含数百万 DNA 片段的基因库, 这些基因均来自能响应疼痛、 热量与触觉的感觉神经元。 为了找出特异性基因, 我们必须筛选由来自痛觉神经细胞的多种 mRNA 生成的数十万条 DNA 片段。 这一筛选工作非常费力, 需要通过精密的分组方法将海量 DNA 片段不断细分, 最终锁定目标基因。
为了验证结果, 我们将疑似编码疼痛受体的 DNA 片段导入原本对辣椒素无反应的细胞 (图 2D), 随后运用已故诺奖得主钱永健发明的方法进行检测:每当有钙离子流入, 细胞便会发出可见荧光 (图 2E)。 接着, 采用膜片钳技术记录这些荧光细胞的膜电流, 最终确认细胞通过离子内流响应辣椒素 ——我们成功了!
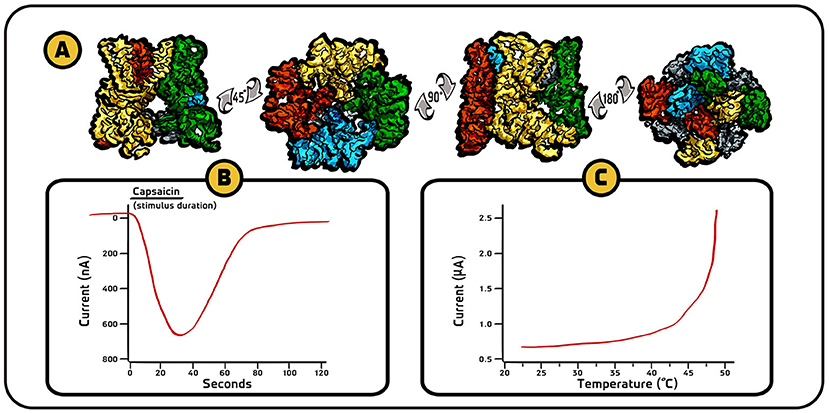
我们的研究证实辣椒素受体确实存在, 而且是一条离子通道。 我们将它命名为 “TRPV1 受体” (图 3A), 属于瞬时受体电位 (TRP) 通道家族。 后来, 我们又发现该受体不仅响应辣椒素 (图 3B), 也会对有害高温产生反应 ——在 43°C 以上被激活 (图 3C) [4] 。
发现 TRPV1 受体后, 我们相对容易地发现了更多 TR P家族成员: 如响应薄荷醇与低温的 TRPM8 [6] , 以及对芥末、 大蒜中的辛辣物质及炎症因子等多种刺激产生反应的 TRPA1 (又称芥末受体) [7] 。 TRP 通道广泛存在于眼、 舌、 皮肤等感觉组织中, 多数负责检测外部感官信号, 部分则负责感知体内信号 (如内脏产生的信号)。 尽管我们对其结构与功能的探索已取得很大进展, 但仍有不少未解之谜。
疼痛研究的未来方向
我们仍在努力破解的核心谜题之一是冷热如何激活 TRP 受体。 目前尚不清楚 TRP 受体如何“感知”温度。 我们猜测, 与辣椒素等化学物质不同, 温度可能并非作用于受体的某个特定部位, 而是同时作用于多个区域。 为此, 我们正尝试在受体响应高低温时, 通过冷冻电镜技术拍摄其结构图像, 以解析温度对受体的作用机制。
为开发出效果更佳的急慢性疼痛治疗药物 (这或许是解决阿片危机的突破口), 我认为必须深入了解各类疼痛的差异, 包括其中涉及的关键分子、 细胞类型与信号通路 (例如皮肤疼痛与内脏疼痛就完全不一样)。 我们无法用单一方案解决各类疼痛, 而需要为不同类型的疼痛专门定制对策。 同时, 我们应设计更精准的疼痛测量方法, 因为每个人的痛感都不一样, 精确测量能帮助我们更好地评估新药疗效。
我还想深入探索 TRP 受体的原子结构, 由此进一步认识其运行机制。 深入了解 TRP 受体的工作原理有助于我们开发仅针对特定部位或机制的新型药物。 现有许多镇痛药会完全阻断疼痛受体, 这反而削弱了受体原本的伤害警示功能。 例如, 某些 TRPV1 靶向药物会降低人体对有害高温的感知力, 导致患者可能无意中被高温物体或液体烫伤 [8] 。
能否开发出不完全抑制 TRP 受体而只改变受体与特定刺激相互作用方式的药物呢? 对于 TRPV1 受体, 我们正寻找新的方案, 既能阻止致炎物质增强受体敏感性, 同时保留受体的正常温度感知能力。 这是一项极具挑战性的艰巨任务, 但其为众多慢性疼痛患者带来希望的巨大潜力让一切努力都变得值得。
给年轻人的建议
科学与任何创造性事业一样 ——你既拥有追随好奇心的自由, 也注定会遭遇诸多不可预知的挑战。 你可以开辟出自己的道路, 从工作中获得巨大的乐趣, 但也难免经历挫败与焦虑的时刻, 比如实验结果难以理解或不知下一步该如何推进。 如果选择科研这条路, 你必须以好奇与热情为动力, 享受探索事物运行规律的过程, 并拥有攻克难关的闯劲。 很多时候, 你需要做的只是脚踏实地, 专注当下, 走进实验室, 享受研究过程。
我经常告诉学生, 坚持终有回报。 你必须找到持续向科学目标迈进的方法, 这个目标应当让你感到振奋、 有趣并且有意义。 在我的科学生涯中, 我始终聚焦那些悬而未决的重大问题, 它们不仅本身极具解决价值, 更能为我的研究领域开辟新的可能性。 当研究陷入困境时, 我会努力寻找原因并探索新路径。 只要还能想到新的尝试方向, 我就有动力重返实验室, 以不同视角审视问题。 这条路充满挑战, 但坚持不懈最终让我有所收获。
最后, 我想强调科学的另一个非凡之处:科学无国界 (图 4)。 我结识了来自世界各地的同行, 经常与他们交流互访。 这种独特的跨国界特质极大地拓展了我的视野, 让我的人生更加有趣。

- 图 4 - 科学无国界。 身为科学家的一大优势便是能成为全球科学界的一员。
- 与世界各地科学家的交流不断丰富我的认知, 让我的人生更加有趣。
术语表
躯体感觉 (Somatosensation): ↑ 感知触觉、 温度、 疼痛以及身体在空间中的位置与运动的能力。
受体 (Receptors): ↑ 细胞膜上的微型感知单元 (通常为蛋白质), 能响应特定化学物质或温度等刺激。
离子通道受体 (Ion Channel Receptors): ↑ 通过使离子 (带电粒子) 在神经细胞内外流动, 响应刺激并产生电信号的受体。
慢性疼痛 (Chronic Pain): ↑ 持续时间超过 12 周的长期疼痛, 不会随着病因消除而消退。 例如, 慢性腹痛与关节痛。
镇痛药 (Analgesics): ↑ 专用于缓解疼痛的药物 (止痛剂)。
急性疼痛 (Acute Pain): ↑ 突发性短期疼痛, 会随着病因消除而消退 (例如割伤手指时的疼痛)。
伤害性感知 (Nociception): ↑ 感觉系统中检测有害刺激的生理过程。
辣椒素 (Capsaicin): ↑ 辣椒中引发灼烧感的辛辣物质。
利益冲突声明
作者声明本研究不涉及任何潜在商业或财务关系。
致谢
感谢 Noa Segev 为本研究进行访谈并参与撰文, Iris Gat 提供所有插图, 以及 Susan Debad 完成编校工作。
AI 人工智能工具使用声明
本文中所有图表附带的替代文本 (alt text) 均由 Frontiers 出版社在人工智能支持下生成。 我们已采取合理措施确保其准确性,包括在可行情况下经由作者审核。 如发现任何问题,请随时联系我们。
参考文献
[1] ↑ Benyamin, R., Trescot, A. M., Datta, S., Buenaventura, R. M., Adlaka, R., Sehgal, N., et al. 2008. Opioid complications and side effects. Pain Phys. 11:S105. doi: 10.36076/ppj.2008/11/S105
[2] ↑ Szolcsányi, J., and Jancso-Gabor, A. 1975. Sensory effects of capsaicin congeners I. Relationship between chemical structure and pain-producing potency of pungent agents. Arzneimittel Forschung. 25:1877–81.
[3] ↑ Wood, J. N., Winter, J., James, I. F., Rang, H., Yeats, J., and Bevan, S. 1988. Capsaicin-induced ion fluxes in dorsal root ganglion cells in culture. J. Neurosci. 8:3208–20. doi: 10.1523/JNEUROSCI.08-09-03208.1988
[4] ↑ Caterina, M. J., Schumacher, M. A., Tominaga, M., Rosen, T. A., Levine, J. D., and Julius, D. 1997. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature. 389:816–24. doi: 10.1038/39807
[5] ↑ Liao, M., Cao, E., Julius, D., and Cheng, Y. 2013. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504:107–12. doi: 10.1038/nature12822
[6] ↑ Bautista, D. M., Siemens, J., Glazer, J. M., Tsuruda, P. R., Basbaum, A. I., Stucky, C. L., et al. (2007). The menthol receptor TRPM8 is the principal detector of environmental cold. Nature. 448:204–8. doi: 10.1038/nature05910
[7] ↑ Bautista, D. M., Jordt, S. E., Nikai, T., Tsuruda, P. R., Read, A. J., Poblete, J., et al. 2006. TRPA1 mediates the inflammatory actions of environmental irritants and proalgesic agents. Cell. 124:1269–82. doi: 10.1016/j.cell.2006.02.023
[8] ↑ Moran, M. M., and Szallasi, A. 2018. Targeting nociceptive transient receptor potential channels to treat chronic pain: current state of the field. Br. J. Pharmacol. 175:2185–203. doi: 10.1111/bph.14044
