摘要
本文基于塞格夫对亨德森的采访撰写而成。结构生物学是观察构成生命的各种分子的结构, 这些分子存在于人类和其他动物中, 也存在于微生物和植物之中。为了解析这些结构, 结构生物学家使用越来越精确的成像技术, 从而“看见”或确定更小更多样的分子的结构。冷冻电子显微镜是一种非常先进和强大的成像技术: 电子被发送到冷冻样品中, 以确定单个分子的结构, 其放大倍数足以看见原子。这些图像使我们更深入地理解生命的基本结构和功能。在本文中, 我们将描述冷冻电子显微镜掀起的这场 “分辨率革命” 的发展过程。受访者亨德森博士因为这方面的贡献最终获得 2017 年的诺贝尔化学奖。
理查德 ⋅ 亨德森 (Richard Henderson) 博士, 与雅克 ⋅ 杜博歇 (Jacques Dubochet) 教授、约阿希姆 ⋅ 弗兰克 (Joachim Frank) 教授因 “开发冷冻电子显微镜, 用于溶液中生物分子结构的高分辨率测定”, 获得了 2017 年诺贝尔化学奖。
眼见为实: 看见微观的生命分子
生物体包含许多重要的结构, 并进行着多种活动。在人体内, 我们有很多器官, 它们由细胞构成, 而细胞内又有很多细胞器和分子执行维持生命所必需的功能, 例如能量代谢、排出废物、物质运输和抵抗有害因子等 (图 1)。为了了解生物体的工作原理并最终造福人类, 我们需要密切观察这些微观分子的结构, 以及这些结构执行的活动。结构生物学 的使命便是观察这些生物组分的结构。过去, 科学家们会从生命体内正在发生的特定活动着手, 例如能量的代谢、转换和存储, 再寻找参与其中的分子, 通常是蛋白质和酶, 然后才能去解析这些分子的结构。
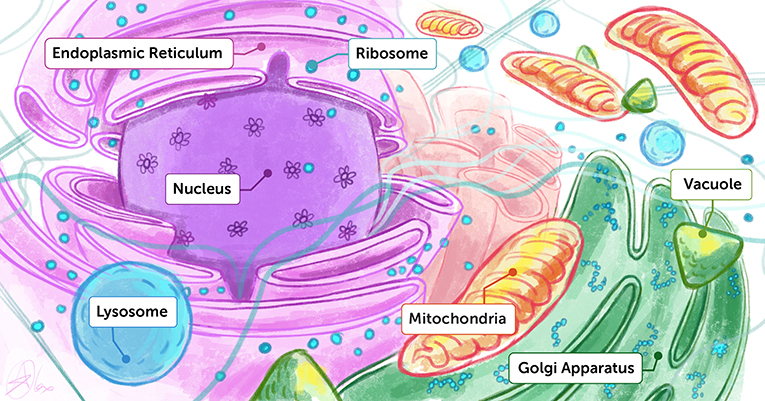
- 图 1 - 细胞内部的艺术效果图。
- 您可以将细胞内部想象成一个密集的游乐场, 其中包含许多不同的分子和细胞器, 每个分子和细胞器都执行其独特的功能。要了解生命的运作方式, 我们需要了解这些生命分子的结构和功能。
在 2000 年, 这一从功能到结构的研究思路发生了变化。因为这一年, 通过人类基因组计划, 科学家首次整理出完整的人类遗传信息的 “指令集” (DNA 碱基序列), 这些遗传信息, 甚至有约 80% 是之前不知道的。从那时起, 通过基因信息, 科学家可以在不必事先了解其功能的情况下先确定相关分子的结构。这开辟了结构生物学的全新路径。那么, 科学家又是如何确定这些分子的结构呢?答案是: 电子!
电子和显微镜
电子是存在于原子中的微小带电粒子, 它的流动产生了电力。电子也是光和其他形式的电磁辐射——如 X 射线——的来源。你能相信吗, 直到 1895 年, 人类才发现了电子。在那一年, 电子首次被英国剑桥大学物理系的科学家约瑟夫 • 汤姆孙 (J. J. Thomson) 识别并命名。40 年后的 1935 年, J. J. 汤普森的儿子乔治 • 汤姆孙 (G. P. Thomson) 证明了电子作为一种粒子, 也同时表现出波的性质: 它具有频率和波长, 就像其他波一样。汤姆孙父子都获得了诺贝尔奖: 父亲是因为电子作为粒子的发现, 儿子是因为电子作为波的发现。
不久之后, 科学家意识到, 如果电子表现得像波一样, 从某种意义上说, 它们一定也表现得像光一样, 因为光也是一种波。因此, 科学家想到也许可以用电子照亮他们想要观察的微小样品, 就像我们基于可见光用眼睛、相机或普通显微镜来观察物体一样, 这就是电子显微镜的起源。电子的波长很短, 大约是可见光波长的十万分之一。而波长越小, 样品放大的倍数越大。这意味着用电子拍摄的照片能显示出更多的细节, 也就是说电子显微镜具有很高的分辨率。由于它的高分辨率, 电子显微镜可以解析以前不可能看清楚的微小分子的结构。
电子显微镜如何工作?
电子显微镜中装有能够发射高能电子束的装置, 能够穿过待研究的样品 (如图 2A 所示)。当电子穿过样品时, 它们与样品中的原子相互作用而偏离原来的行进路径——称为衍射, 偏离方式决定于样品中原子排列的方式。因此, 电子通过样品时 “拾取” 了其结构信息。电子随后通过特别设计的电磁场进行聚焦, 这种电磁场称为电磁透镜, 类似于相机内的镜头, 然后被电子探测器记录下来。在这个阶段, 科学家得到了从样品中衍射的电子的图像, 然后将其转换为样品本身的图像。这种转换基于简单的物理学, 其描述了被测物体与所成图像之间的关系。这一转换取决于许多因素, 包括电子的波长和所使用的透镜, 但这都由显微镜专家来处理。

- 图 2 - 电子显微镜。
- (A) 在电子显微镜中, 电子源释放出一束热的高能电子, 穿过被置于真空环境的样本。当电子与样品相互作用时, 它们会发生衍射 (散射), 随后被特殊透镜收集和聚焦, 然后被电子检测器检测。(B) 剑桥大学的电子显微镜, 它允许科学家对冷冻生物样本进行成像。图片来源: 剑桥大学。
电子显微镜的挑战
尽管电子可以帮助我们获得非凡的分子图像, 但仍需克服重大挑战。首先, 正如量子物理学告诉我们的那样, 单个电子的活动具有不确定性。当你问电子遇到特定分子时会发生什么时, 他们不会给出明确的答案。相反, 他们有一定的概率 (可能性) 参与每个可能的结果。在电子世界中, 所有可能发生的事情都确实发生了, 每个选项都有确定的概率。这意味着科学家必须从许多电子中收集答案, 并开动头脑, 将这些信息组合起来。为实现这一目标, 我们用数百万个电子照射样本, 并使用它们的总体平均值来获得合理的答案。
其次, 电子的能量非常高, 在成像过程中必须要穿过样品, 而这会对样品造成损坏。这些超高能电子和任何其他类型的高能辐射一样, 可以将样品分子中的电子打出来。这会改变样品分子的形状和特性, 因为生物分子相对脆弱。因此, 科学家很难在单个生物分子被破坏之前获得足够的结构信息。应对这一挑战的一种方法是, 拍摄许多独立的、相同的分子的图像: 至少 500 个, 并对图像进行平均以获得分子典型的结构。另一种方法是以特殊方式冷却样品, 使其更能抵抗电子损伤——这将在下一节中介绍。
另一个挑战在于, 电子一旦靠近任何原子就会发生衍射。这意味着电子源和样品之间必须畅通无阻, 这样电子才能到达目标分子, 而不会因其他分子 (如空气中的氧气和氮气) 挡道而散射。换句话说, 科学家必须在电子显微镜的样本周围创造一个真空。然而由于生物分子总是处在含水溶液中 (想一想血液中的分子), 水分子难免会蒸发到真空之中, 此外水分的蒸发还会使样本过于干燥, 这又通常会损坏样本中的生物分子。面对这些问题, 结构生物学家发挥他们的创造力, 利用水的独特性质来应对这一挑战。
水在极低温度下能保持液态吗?
为了解水的独特性质, 您可以尝试下面这个实验 (图 3)。拿一个带盖的空罐子, 装满水, 在水下拧紧盖子从而避免罐子里混入气体, 然后将其放置于冰箱的冷冻层。一天之后, 罐子里的水温将下降至 –10 °C 或 –20 °C (通常情况下水会在 0 °C 时结冰)。第二天, 把罐子从冰箱里拿出来看看——水是变成了固态冰, 还是保持液态?
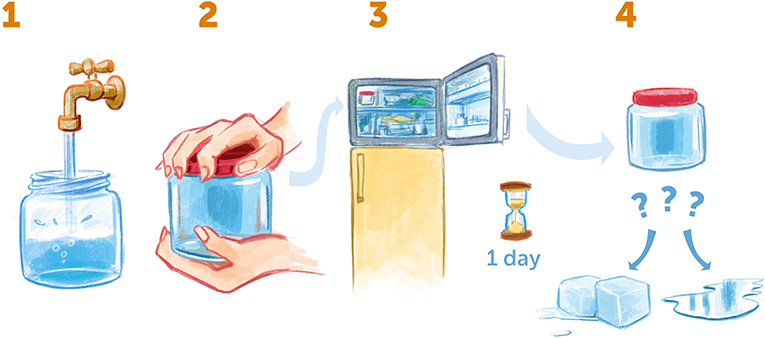
- 图 3 - 家里的过冷水。
- (1) 取一个空罐子, 装满水, 确保里面没有气泡。(2) 将罐子密封好 (3) 放入冰箱冷冻一天。(4) 然后, 取出罐子。水是结冰的还是液态的?如果它仍然是液体, 你就制得了过冷水!
大多数情况下, 您会发现水仍然是液态, 尽管它已经冷却到低于其冰点 (0 °C) 的温度——这是过冷现象。在我们的实验中, 我们希望将水进一步冷却到 –170 °C 以下, 因为在这个温度下它变得平静又稳定。我们还希望避免产生冰晶, 因为它们会干扰我们的测量。为此, 我们必须使用雅克 • 杜博歇实验室开发的特殊冷却方法, 他与我 (理查德 • 亨德森)、约阿希姆 • 弗兰克于 2017 年共同获得了诺贝尔化学奖。在这种方法中, 我们要用到非常冷的液体乙烷或丙烷 (天然气中的成分, 组成原子只有碳和氢), 将乙烷/丙烷液体冷却至 –185 °C, 然后我们将一层非常薄的水膜浸入其中, 这层水膜在极端时间内——约千分之一秒——迅速冷却, 以至于没有时间形成有组织的冰晶, 而是保持无序的液态形式 [1], 我们称之为无定形冰。这样, 我们就得到了过冷水。
热电子和冷样品的神奇组合
事实证明, 过冷水的薄膜非常适合我们想要用电子显微镜成像的生物分子悬浮在其中。当我们将这个冷却步骤添加到成像过程中时, 就是所谓的冷冻电子显微镜技术。冷冻电子显微镜技术使我们能够应对前文提到的两个挑战: 一方面它使标本稳定, 从而更能抵抗高能电子的破坏, 另外, 它允许生物分子处于自然的水环境中, 避免水蒸发到真空之中。它还有一个更重要的优势: 与大多数其他液体不同, 水在冷却到 4 °C 以下时会膨胀, 这一特性有助于生物分子在过冷水中保持完好。想象一下, 如果水在冷却时收缩, 它就会挤压甚至破坏要成像的分子。
这种相当简单但高效的冷冻电子显微镜成像方法使我们大大提高了生物分子成像的分辨率。这就是它有时被称为 “分辨率革命” 的原因。
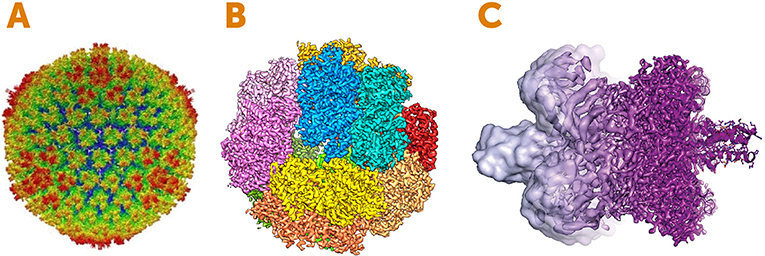
图 4 展示了使用电子冷冻显微镜获得的一些精美图像的例子。我们在处理非常微小的尺度-纳米级别, 这比人类头发的宽度的 1/1000 还要小!希望你已经开始感受到冷冻电子显微镜的神奇了。
冷冻电子显微镜的未来
电子是对生物分子成像的最佳粒子。为了让您了解它们有多好, 我们把它们与另外两种常用粒子进行比较: X 射线光子 (类似于光子, 但波长较短) 和中子 (一种来自原子核的粒子)。我们可以计算出成像时所获得的结构信息量与该粒子在样本中造成的损害的比值, 以此来衡量该粒子的成像效果。根据该标准, 电子比 X 射线好 1000 倍, 比中子好 3 倍!这就是我和我的同事多年前开始使用电子而不是其他粒子的原因。如今, 冷冻电子显微镜已经获得非常成功的应用, 使用它的结构生物学家的数量已经很多了, 但还在迅速增加。
冷冻电子显微镜仍有很大的改进空间。一是改进电子探测器, 它们仍然不够大或效率不够高, 使我们实际所用的电子比理论上应使用的电子要多得多。此外, 当电子束接触样品时 (包括水分子和生物分子), 如果能进一步减少样品的运动将会改善成像效果 [4, 5]。我们相信, 在大约 5 年的时间里, 应对这些挑战将会取得重大进展。届时我们将拥有更强大的工具, 让我们更好地理解许多生物学问题, 例如生命如何运作以及如何繁殖。我们获得的信息可能有助于我们维护人、动物和植物的健康。我们可以期待冷冻电子显微镜的光明前景!
给小读者的建议
我, 理查德, 想分享一些我在整个职业生涯中遵循的实用建议。这些建议来自 1960 年诺贝尔生理学或医学奖得主彼得 • 梅达沃 (Peter Medawar) 的著作。获得诺贝尔奖后, 彼得 • 梅达沃出版了 《可解的艺术》 (The Art of the Soluble) 和 《寄语青年科学工作者》 (Advice to a Young Scientist) 两本书。他在书中说, 科学和生活中有很多有趣的东西, 我们应该对一切事物保持好奇。但我们也应该选择一些我们特别感兴趣的东西来做。此外, 他说科学家们应该致力于当前可以被回答的科学问题, 而不是 100 年后才能被解决的那一类遥远的问题, 因为那已经超出了科学家的一生。他认为科学是可解决的艺术, 得专注于可以解决的问题。科学家应该基于现在的技术回答当前可以被回答的问题。
我读大学的时候学的是物理, 当时, 我想知道物理学会走向何方, 我记得我列了一个清单, 列出了关于未来所有有趣的话题。有聚变研究, 涉及从氢聚变中产生无限的能量。然后是高能粒子物理学, 这一领域的研究促成了新粒子的发现, 包括希格斯玻色子等。还有固体物理学, 它推动了计算机工业和微芯片的发展。生物物理学、天体物理学、宇宙学、黑洞和中子星等都是其他有趣的话题 (图 5)。如果我选择其中的任何一个主题来研究, 它们都会同样有意思、令人兴奋。所以, 如果你决定从事科学, 你必须选择你感兴趣的东西, 这样你的研究和工作就是自发的, 而不是因为受到任何人的强迫。当你有兴趣和上进心时, 遇到困难也不太会困扰你——你只会把它当作一个挑战并继续前进。一旦你选择了一个有趣的主题, 在你真正朝着那个方向前进之前, 最好尽可能多地了解你为研究这个主题可以进行的各种活动。如果经过 6 个月或一年的努力, 结果证明你的想法不是很好, 请不要犹豫重新思考并寻找新的方向。

- 图 5 - 选择科学领域。
- 当我学习物理时,有很多有趣的课题可以选择。事后看来,这些课题对我来说都同样有趣。当你选择一个领域时,请选择你感兴趣,并且能让你长期保持动力的课题。
与过去相比, 今天的科学发展非常迅速。仅在 100 年前, 我们甚至不知道 X 射线和电子的存在, 而现在我们掌握了整个人类基因组的信息, 我们拥有处理 DNA 的复杂方法, 并且我们几乎可以弄清楚我们想要的任何东西。未来 100 年将是活着的好时机——也是成为科学家的好时机。享受你的生活, 把自己投资在你最感兴趣的事情上!
扩展阅读
冷冻电子显微镜——理查德 • 亨德森 (Serious Science)
术语表
结构生物学 (Structural Biology): ↑ 生物学的一个领域, 研究构成生物体的各个组成部分的结构。
蛋白质 (Protein): ↑ 微小的生物机器, 在身体中执行许多重要的功能。
酶 (Enzyme): ↑ 一种生物分子, 能加速体内的化学反应。
遗传信息 (Genetic Information (DNA)): ↑ 从父母传递给后代的信息, 这些信息决定了生物体的特性和行为。
频率 (Frequency): ↑ 波在一秒钟内重复自身的次数。
波长 (Wavelength): ↑ 波所重复的形状的距离。
电子显微镜 (Electron Microscopy): ↑ 一种使用电子对小型结构, 包括生物分子, 进行成像的技术。
衍射 (Diffraction): ↑ 波在传播途中遇见物体时分散开来。
过冷 (Supercooled): ↑ 液体虽然冷却到冰点以下, 但仍保持液体状态 (即没有结晶)。
冷冻电子显微镜 (Electron Cryomicroscopy): ↑ 一种使用电子对在水中迅速冷却到低温的生物分子进行成像的技术。
利益冲突声明
作者声明, 该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。
致谢
感谢 Alex Bernstein 提供插图、 Susan Debad 对手稿的编辑。感谢赛先生公众号及译者瞿立建对中文翻译的贡献。
参考文献
[1] ↑ Dubochet, J., Lepault, J., Freeman, R., Berriman, J. A., and Homo, J.-C. 1982. Electron microscopy of frozen water and aqueous solutions. J. Microscopy 128:219–37. doi: 10.1111/j.1365-2818.1982.tb04625.x
[2] ↑ Liu, H., Jin, L., Koh, S. B. S., Atanasov, I., Schein, S., Wu, L., et al. 2010. Atomic structure of human adenovirus by cryo-EM reveals interactions among protein networks. Science 329:1038–43. doi: 10.1126/science.1187433
[3] ↑ Allegretti, M., Mills, D. J., McMullan, G., Kühlbrandt, W., and Vonck, J. 2014. Atomic model of the F420-reducing [NiFe] hydrogenase by electron cryo-microscopy using a direct electron detector. Elife 3:e01963. doi: 10.7554/eLife.01963
[4] ↑ Vinothkumar, K. R., and Henderson, R. 2016. Single particle electron cryomicroscopy: Trends, issues and future perspective. Q. Rev. Biophys. 49:e13. doi: 10.1017/S0033583516000068
[5] ↑ Henderson, R. 2015. Overview and future of single particle electron cryomicroscopy. Archiv. Biochem. Biophys. 581:19–24. doi: 10.1016/j.abb.2015.02.036
