Résumé
Cet article est basé sur un entretien entre les deux auteurs.
La biologie structurale est un domaine de la biologie qui étudie la structure des molécules qui composent les êtres vivants — des molécules qui existent chez les humains et les autres animaux, en passant par les molécules présentes chez les micro-organismes, jusqu’aux molécules qui composent les plantes. Pour analyser ces structures, les biologistes structuraux utilisent des techniques d’imagerie sophistiquées et de plus en plus précises pour “voir” ou déterminer la structure de diverses molécules biologiques. La cryomicroscopie électronique est une technique d’imagerie très avancée et très puissante. Elle consiste à envoyer des électrons à travers des échantillons pour déterminer la structure de la molécule étudiée, à des grossissements suffisants pour voir les atomes. Ces images nous permettent d’avancer dans notre compréhension de la structure et de la fonction de ces molécules qui sont à la base de la vie. Dans cet article, nous te parlerons des développements qui ont conduit à ce que l’on appelle “la révolution de la résolution” en cryomicroscopie électronique, à laquelle le Dr. Henderson a participé et qui lui a permis de partager le prix Nobel de chimie en 2017.
Richard Henderson a reçu le prix Nobel de chimie en 2017, conjointement avec les professeurs Jacques Dubochet et Joachim Frank, pour avoir développé la cryomicroscopie électronique pour caractériser la structure des biomolécules en solution avec une haute résolution.
Quand l’apparence compte : découvrir les structures des molécules biologiques
Les êtres vivants contiennent de nombreuses structures qui sont engagées dans de nombreux processus. Dans le corps humain, par exemple, nous savons que les organes sont constitués de cellules et qu’à l’intérieur de ces cellules il y a des organites (des structures délimitées par une ou plusieurs membranes et assurant une fonction particulière dans la cellule) et de très nombreuses molécules (Figure 1) qui remplissent toutes les fonctions nécessaires au maintien de la vie, comme produire de l’énergie, éliminer les déchets, se déplacer et se défendre contre des éléments dangereux, comme des produits toxiques ou des agents pathogènes. Pour comprendre le fonctionnement des êtres vivants et éventuellement améliorer leur santé, nous devons identifier quelles structures sont présentes dans un système biologique et quelles activités ces structures accomplissent. La biologie structurale est le domaine qui cherche à observer les structures des molécules biologiques. Dans le passé, les scientifiques analysaient d’abord des activités spécifiques qui se déroulaient dans un système biologique, comme la conversion d’une source d’énergie en un autre type d’énergie stockable. Après avoir trouvé l’activité, ils identifiaient les molécules qui y participaient (généralement des protéines et des enzymes) ; ce n’est qu’ensuite qu’ils déterminaient la structure de ces molécules.
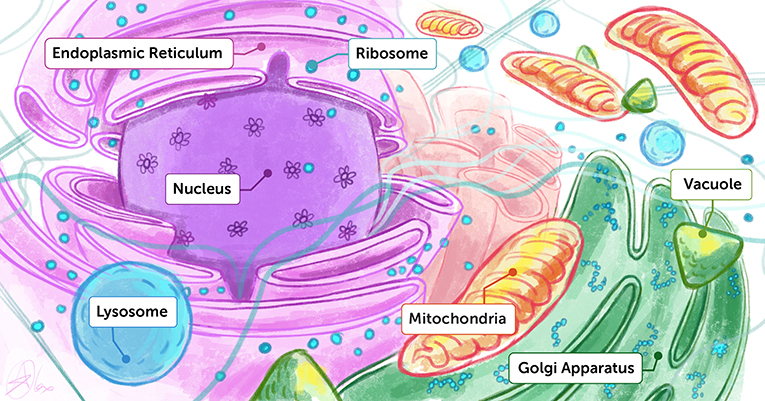
- Figure 1 - Interprétation artistique de l’intérieur d’une cellule.
- On peut considérer l’intérieur d’une cellule comme un terrain de jeu très encombré contenant de nombreuses molécules et organites différents, chacun remplissant une fonction précise. Pour comprendre le fonctionnement de la vie, nous devons connaître à la fois la structure et la fonction de chacun de ces éléments biologiques. Endoplasmic reticulum : réticulum endoplasmique. Nucleus : noyau. Mitochondria : mitochondrie. Golgi apparatus : appareil de Golgi.
En 2000 a eu lieu une révolution de nos connaissances concernant le support de l’information génétique (l’ADN), qui est stockée dans nos cellules et que nous héritons de nos parents. Les scientifiques ont assemblé pour la première fois le “jeu d’instructions” complet de l’ensemble de l’information génétique humaine (la séquence complète de l’ADN humain). Depuis, au lieu de chercher une activité, puis trouver la molécule responsable de cette activité, et enfin déterminer sa structure, les biologistes structuraux peuvent utiliser l’information génétique, qui les renseigne sur toutes les enzymes et les protéines de l’organisme. En 2000, lorsque le génome humain a été déterminé, environ 80 % des molécules codées dans l’ADN humain n’avaient même pas été découvertes ! Pour la biologie structurale, cela voulait dire que nous pouvions désormais analyser la structure de molécules sans avoir à connaître d’abord leurs fonctions.
Comment analyser les structures de ces molécules ? En utilisant de minuscules particules appelées électrons !
Électrons et microscopie électronique
Les électrons sont de minuscules particules ayant une charge électrique et sont présents dans chaque atome. Le courant électrique est produit par le mouvement des électrons dans un matériau conducteur (généralement un métal). Leur mouvement à l’intérieur d’un atome produit de la lumière et quand ils sont soumis à une forte accéleration, les électrons peuvent aussi être une source d’autres formes de rayonnements comme les rayons X par exemple. Jusqu’à la fin du 19ème siècle personne ne connaissait l’existence des électrons ! Ces particules ont été découvertes par JJ Thomson, un physicien de l’Université de Cambridge, au Royaume-Uni. En 1935, son fils, GP Thomson a montré que les électrons se comportent à la fois comme des particules et comme des ondes (des déformations qui se propagent dans le milieu) : ils ont une fréquence et une longueur d’onde, tout comme les autres ondes. JJ et GP Thomson ont tous deux reçu un prix Nobel : le premier en 1906 pour la découverte de l’électron en tant que particule et le second en 1937 pour la découverte de l’électron en tant qu’onde.
Peu après, les scientifiques ont réalisé que si les électrons se comportaient comme des particules et comme des ondes, ils ressemblaient, d’une certaine manière, à la lumière. Ils ont donc pensé qu’ils pourraient peut-être utiliser les électrons pour éclairer les minuscules échantillons qu’ils voulaient examiner, de la même manière que nous pouvons examiner un objet avec nos yeux, avec un appareil photo ou avec un microscope ordinaire, mais en utilisant des électrons au lieu de la lumière visible. C’est ainsi qu’est née la microscopie électronique. La microscopie électronique est une technique d’imagerie très puissante. Les électrons ont une longueur d’onde très courte, environ 100 000 fois plus courte que la longueur d’onde de la lumière visible. On peut considérer la longueur d’onde comme un paramètre de “zoom” (grossissement) : plus la longueur d’onde est petite, plus nous pouvons “agrandir” notre spécimen. Cela signifie que les images prises avec des électrons ont un niveau de détails très élevé, ce que l’on appelle une haute résolution. Grâce à sa haute résolution, la microscopie électronique peut être utilisée pour étudier la structure de molécules minuscules d’une manière qui n’était pas possible auparavant.
Comment fonctionne la microscopie électronique ?
En microscopie électronique, un faisceau d’électrons à haute énergie sort d’une source et traverse l’échantillon étudié (Figure 2A). Lorsque les électrons traversent l’échantillon, ils interagissent avec ses atomes et sont diffractés, c’est-à-dire déviés de leur trajectoire, d’une manière qui est spécifique à l’arrangement des atomes qu’ils rencontrent. De cette manière, les électrons “capturent” la structure du matériau qu’ils traversent. Après avoir été diffractés, les électrons sont recueillis et focalisés à l’aide de lentilles (un peu comme les lentilles d’un appareil photo), puis ils sont enregistrés par un détecteur d’électrons. À ce stade, les scientifiques disposent d’une image des électrons qui ont été diffractés par l’échantillon, et ils doivent la convertir en une image de l’échantillon lui-même. Cette conversion est basée sur un principe physique simple qui décrit la relation entre un objet mesuré et l’image qui en résulte. La conversion dépend de nombreux facteurs, notamment la longueur d’onde des électrons et des lentilles utilisées, mais tout cela est pris en charge par les experts en microscopie.

- Figure 2 - Microscopie électronique.
- (A) Dans un microscope électronique, une source d’électrons libère un faisceau d’électrons hautement énergétiques qui traverse l’échantillon situé dans une chambre à vide. Lorsque les électrons interagissent avec l’échantillon, ils sont diffractés (dispersés), puis recueillis et focalisés par des lentilles spéciales avant d’être détectés par un détecteur d’électrons. (B) Microscope électronique de l’Université de Cambridge (Royaume-Uni), qui permet aux scientifiques d’obtenir des images d’échantillons biologiques congelés (crédit d’image : Université de Cambridge).
Les défis de la microscopie électronique
Même si les électrons peuvent nous aider à obtenir des images remarquables des molécules, il y a des défis majeurs à relever lorsqu’on les utilise pour obtenir l’image de molécules biologiques.
Tout d’abord, comme nous le dit la physique quantique, les électrons individuels ne sont pas “logiques” : lorsque tu leur poses une question (par exemple, que se passe-t-il lorsqu’ils rencontrent une molécule particulière), ils ne donnent pas une réponse précise comme pourrait le faire un être humain. Au lieu de cela, ils ont une certaine probabilité (vraisemblance) de participer à chaque résultat possible. Dans le monde des électrons, tout ce qui peut arriver arrive vraiment, avec une certaine probabilité pour chaque option. Cela signifie que les scientifiques doivent recueillir les nombreuses réponses de nombreux électrons et combiner ces informations pour obtenir une réponse globale. Pour ce faire, nous éclairons le spécimen avec des millions d’électrons et utilisons la moyenne de leurs propriétés pour obtenir une réponse qui a un sens.
Les électrons peuvent endommager l’échantillon, car ils sont très énergétiques et doivent traverser tout l’échantillon avant d’arriver au détecteur. Leur température peut atteindre environ deux mille millions de degrés Celsius (à titre de comparaison, l’eau bout à 100 degrés Celsius !) Ces électrons, comme tout autre type de rayonnement énergétique, peuvent arracher des électrons aux molécules de l’échantillon. Cela modifie leur forme et leurs propriétés, car les molécules biologiques sont relativement fragiles. Il est donc difficile pour les scientifiques d’obtenir suffisamment d’informations sur la structure d’une seule molécule biologique avant qu’elle ne soit détruite. Une façon de relever ce défi est de prendre des images de nombreuses molécules distinctes et identiques (au moins 500, dans le cas de la microscopie électronique des molécules biologiques) et de faire la moyenne des images pour obtenir sa structure. Une autre façon de relever ce défi consiste à utiliser un procédé spécial pour refroidir l’échantillon, ce qui le rend plus résistant aux dommages causés par les électrons (cette méthode sera décrite dans la section suivante).
Un autre problème vient du fait que les électrons sont diffractés dès qu’ils se trouvent à proximité d’un atome. Cela signifie qu’il doit y avoir un chemin complètement dégagé entre la source d’électrons et l’échantillon, afin que les électrons atteignent les molécules que l’on souhaite étudier et ne soient pas dispersés par d’autres molécules, y compris l’oxygène et l’azote de l’air qui pourraient se trouver sur leur chemin. En d’autres termes, les scientifiques doivent créer un vide autour de l’échantillon dans le microscope électronique. Étant donné que les molécules biologiques sont toujours dans des solutions contenant de l’eau (pense, par exemple, aux molécules de ton sang), le problème est que, dans le vide, l’eau s’évapore et l’échantillon se dessèche. Cette dessiccation endommage souvent les molécules biologiques contenues dans l’échantillon. Pour relever ce défi, les biologistes structuraux ont dû faire preuve de créativité pour tirer parti des propriétés uniques de l’eau.
L’eau peut-elle rester liquide lorsqu’elle est très froide ?
Voici une expérience très intéressante que tu peux réaliser chez toi pour comprendre l’une des propriétés uniques de l’eau (Figure 3). Prends un bocal en plastique vide avec un couvercle et remplis-le d’eau. Assure-toi qu’il n’y a pas de bulles d’air dans le bocal en vissant le couvercle sous l’eau et mets-le au congélateur. Laisse le bocal dans le congélateur pendant une journée : la température de l’eau aura alors baissé jusqu’à-10°C ou-20°C (l’eau devient normalement de la glace à 0°C). Le lendemain, sors le bocal du congélateur sans le secouer et regarde : l’eau s’est-elle transformée en glace solide ou est-elle restée liquide ?
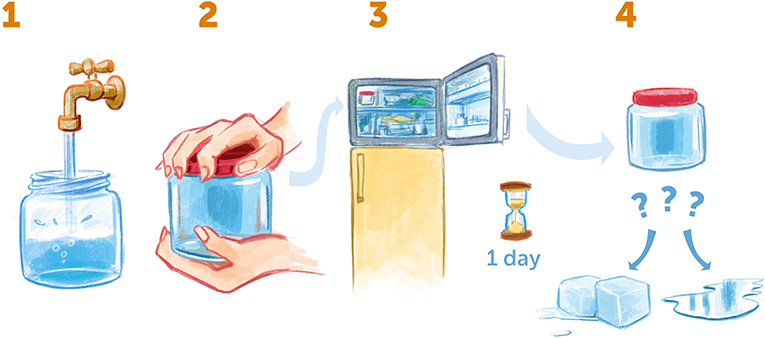
- Figure 3 - Obtenir de l’eau surfondue à la maison.
- (1) Prends un bocal en plastique vide, remplis-le complètement d’eau et assure-toi qu’il n’y a pas de bulles d’air à l’intérieur. (2) Ferme hermétiquement le bocal et (3) mets-le au congélateur pendant une journée. (4) Sors ensuite le bocal sans le secouer. L’eau est-elle gelée ou encore liquide ? Si elle est encore liquide, tu as fabriqué de l’eau surfondue !
Le plus souvent, tu constateras que l’eau est encore liquide : elle est en surfusion, c’est-à-dire qu’elle a été refroidie à une température inférieure à sa température de congélation (0°C), mais sans se transformer en glace. Dans nos expériences, nous voulons refroidir l’eau encore plus, en dessous de-170°C, car à cette température, elle est très calme et stable. Nous voulons également éviter de créer des cristaux de glace, car ils interfèrent avec les mesures. Pour cela, nous utilisons une méthode de refroidissement ultra-rapide développée dans le laboratoire de Jacques Dubochet, qui a partagé le prix Nobel de chimie avec moi, Richard Henderson, et Joachim Frank en 2017. Dans cette méthode, nous utilisons de l’éthane ou du propane liquide très froid (substances composées de carbone et d’hydrogène et présentes dans le gaz naturel), refroidi à-185°C. Nous plongeons ensuite une très fine pellicule d’eau dans le liquide éthane/propane refroidi, et elle se refroidit si rapidement (en environ 1/1 000ème de seconde) qu’elle n’a pas le temps de former des cristaux de glace organisés et reste sous la forme liquide non organisée [1] que nous appelons glace amorphe.
La formule magique des électrons chauds et des échantillons froids
Il s’avère que les films minces d’eau en surfusion sont parfaits pour mettre en suspension les molécules biologiques dont nous voulons recueillir les images avec des microscopes électroniques. Lorsque nous ajoutons cette étape de refroidissement au processus d’imagerie, on parle de cryomicroscopie électronique (“cryo” est l’abréviation de “cryogénique”, qui fait référence au refroidissement). La cryomicroscopie électronique nous permet de relever deux des défis mentionnés ci-dessus : elle stabilise l’échantillon, le rendant plus résistant aux dommages causés par les électrons à haute énergie, et elle permet aux molécules biologiques d’être dans leur environnement aqueux naturel, sans évaporation de l’eau due au vide. Il y a un autre avantage important : contrairement à la plupart des autres liquides, l’eau se dilate (elle prend plus de volume) lorsqu’elle est refroidie à moins de 4°C. Cette caractéristique permet aux molécules biologiques de ne pas être endommagées lorsqu’elles se trouvent dans de l’eau en surfusion. Si, au lieu de se dilater, l’eau se contractait en refroidissant, elle comprimerait les molécules et pourrait les briser.
Cette méthode de refroidissement, plutôt simple, rend l’imagerie par cryomicroscopie électronique très efficace : elle permet d’obtenir des images de molécules biologiques à une résolution jusqu’alors inaccessible. C’est pourquoi on parle parfois de “révolution de la résolution”.
La Figure 4 montre des exemples de belles images obtenues grâce à la cryomicroscopie électronique. Nous avons affaire à de toutes petites échelles : quelques dizaines de nanomètres, soit moins de 1/1 000ème de la largeur d’un cheveu humain ! Nous espérons que tu commences à apprécier les merveilles de la cryomicroscopie électronique.
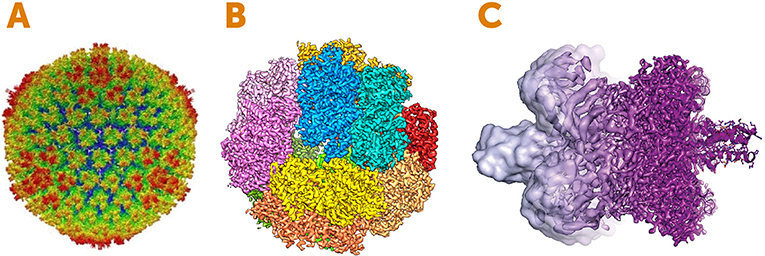
- Figure 4 - Images créées à l’aide de la cryomicroscopie électronique.
- (A) Structure d’un virus appelé Adénovirus. L’image montre la surface extérieure appelée capside, qui est l’enveloppe protéique dans laquelle est empaqueté le matériel génétique du virus. Les couleurs représentent la distance des différents éléments par rapport au centre de la sphère : le rouge est le plus éloigné du centre et le bleu est le plus proche. (B) Une enzyme impliquée dans la production d’énergie chez certains microbes. Les couleurs représentent les sous-unités individuelles de l’enzyme. (C) Exemple de l’amélioration de la résolution de la cryomicroscopie électronique entre 2013 (à gauche, violet clair) et 2017 (à droite, violet foncé). Crédits images : (A) adapté de [2]; (B) adapté de [3]; (C) Martin Högbom, Université de Stockholm, d’après une image de V. Falconieri.
Quel est l’avenir de la cryomicroscopie électronique ?
Les électrons sont les meilleures particules à utiliser pour l’imagerie de molécules biologiques. Pour te donner une idée de leur qualité, comparons-les à deux autres particules couramment utilisées : les photons des rayons X (semblables à des particules de lumière mais avec des longueurs d’onde courtes) et les neutrons (particules provenant du noyau des atomes). Lorsque nous calculons la quantité d’informations que nous recevons en utilisant une particule par rapport aux dommages que cette particule crée dans l’échantillon, nous obtenons une mesure de la qualité de la particule pour l’imagerie. Selon ce calcul, les électrons sont 1 000 fois meilleurs que les rayons X et trois fois meilleurs que les neutrons ! C’est pourquoi mes collègues et moi-même avons commencé à utiliser les électrons plutôt que d’autres particules il y a de nombreuses années. Aujourd’hui, la cryomicroscopie électronique connaît un tel succès que de très nombreux biologistes structuraux l’utilisent déjà et leur nombre augmente rapidement.
Des améliorations importantes doivent encore être apportées à la cryomicroscopie électronique. L’une d’elles est d’améliorer les détecteurs d’électrons, qui ne sont toujours pas assez grands ou efficaces et qui nous obligent à utiliser beaucoup plus d’électrons que ce qui est théoriquement nécessaire. Il serait également utile de minimiser le mouvement de l’échantillon (à la fois les molécules d’eau et les molécules biologiques) lorsqu’il entre en contact avec le faisceau d’électrons [4, 5]. Nous pensons que d’ici 5 ans environ, des progrès significatifs seront réalisés pour relever ces défis. Nous disposerons alors d’un outil encore plus puissant qui nous permettra de mieux comprendre comment fonctionne la vie. Les informations que nous obtiendrons pourraient nous aider à préserver la santé des personnes, des animaux et des plantes. La cryomicroscopie électronique a un bel avenir devant elle !
Recommandations pour les jeunes esprits
Moi, Richard, je souhaite partager quelques conseils pratiques que j’ai suivis tout au long de ma carrière. Ils sont tirés des ouvrages de Peter Medawar, lauréat du prix Nobel de physiologie ou de médecine en 1960. Après avoir reçu le prix Nobel, Peter Medawar a publié deux livres : “The Art of the Soluble” (L’art du soluble) et “Advice to a Young Scientist” (Conseils à un jeune scientifique). Dans ses livres, il dit qu’il y a beaucoup de choses intéressantes dans la science et dans la vie, et que nous devrions nous intéresser à tout. Mais nous devrions aussi choisir un sujet qui nous intéresse particulièrement. Il dit aussi que les scientifiques devraient travailler sur quelque chose qui produira de nouvelles connaissances bientôt, et non dans 100 ans, car cela dépasse la durée de vie humaine. Son idée est que la science est l’art du soluble, c’est-à-dire des problèmes qui peuvent être résolus. Les scientifiques doivent faire des expériences qui fonctionnent aujourd’hui, avec les techniques actuelles.
Lorsque j’étais un jeune étudiant en physique, je me demandais où allait la physique et je me souviens d’avoir dressé une liste de tous les sujets intéressants pour le futur. Il y avait la recherche sur la fusion, qui consiste à produire une énergie illimitée à partir de la fusion de l’hydrogène. Il y avait la physique des particules à haute énergie, qui a conduit à la découverte de nouvelles particules, y compris le boson de Higgs et d’autres. La physique du solide, qui a fait progresser l’industrie informatique et le développement des micropuces qui alimentent les ordinateurs. La biophysique, l’astrophysique, la cosmologie, les trous noirs et les étoiles à neutrons, pour n’en citer que quelques-uns, étaient d’autres sujets intéressants (Figure 5). Si j’avais choisi d’étudier n’importe lequel de ces sujets, tous auraient été passionnants. Donc si tu décides de te lancer dans la recherche scientifique, tu dois choisir quelque chose qui t’intéresse et que tu auras plaisir à étudier et approfondir sans que personne ne t’y oblige. Si tu es intéressé et motivé, rencontrer des difficultés ne te dérangera pas trop : tu les prendras simplement comme des défis et tu continueras. Une fois que tu as choisi un sujet intéressant, il est préférable, avant de te lancer dans cette direction, de te renseigner autant que possible sur les différentes activités que tu pourrais exercer pour l’étudier. Si, après 6 mois ou un an d’efforts, il s’avère que ton idée n’était finalement pas si bonne, n’hésite pas à réfléchir à nouveau et à trouver une nouvelle direction.

- Figure 5 - Choix d’un domaine scientifique.
- Lorsque j’étais étudiant en physique, j’avais le choix entre de nombreux sujets intéressants. Avec le recul, je me rends compte qu’ils auraient tous été aussi intéressants les uns que les autres. Lorsque tu choisis un domaine, assure-toi de choisir quelque chose que tu trouves intéressant et qui te motivera sur une longue période.
Aujourd’hui, la science évolue très rapidement. Il y a à peine plus de 100 ans, nous ne connaissions même pas l’existence des rayons X et des électrons. Aujourd’hui, nous disposons d’informations sur l’ensemble du génome humain, nous avons des méthodes sophistiquées pour travailler avec l’ADN et nous pouvons découvrir la structure de pratiquement tout ce que nous voulons. Les 100 prochaines années seront une très bonne période pour être un scientifique. Profite de ta vie et investis-toi dans ce qui t’intéresse le plus !
Matériel Supplémentaire
Richard Henderson Nobel Lecture 2017.
Electron Cryomicroscopy—Richard Henderson at Serious Science.
Explainer : What is cryo-electron microscopy (Chemistry World).
Contributions à La Version Française
TRADUCTEUR: Nicole Pasteur (Association Jeunes Francophones et la Science)
ÉDITEUR: Ula Hibner & Catherine Braun-Breton (Association Jeunes Francophones et la Science)
Glossaire
Biologie Structurale: ↑ Domaine de la biologie qui étudie les structures et l’organisation spatiale des molécules qui constituent les êtres vivants, principalement protéines et acides nucléiques.
Protéine: ↑ Petite machine biologique qui joue de nombreux rôles essentiels dans l’organisme.
Enzyme: ↑ Protéine qui accélère les réactions chimiques dans l’organisme.
Information Génétique (ADN): ↑ Information transmise de génération en génération, qui détermine les caractéristiques et le comportement d’un organisme. Le support de cette information est l’ADN (acide désoxyribonucléique).
Fréquence: ↑ Nombre de fois qu’une onde se répète en une seconde.
Longueur D’onde: ↑ Distance sur laquelle la forme d’une onde se répète.
Microscopie Électronique: ↑ Technique qui utilise les électrons pour obtenir des images de petites structures, y compris des molécules biologiques.
Diffraction: ↑ Déviation d’une onde par un objet ; par exemple, déviation d’électrons par un échantillon.
Surfusion: ↑ Refroidissement en dessous de la température de congélation tout en restant liquide (c’est-à-dire sans cristallisation).
Cryomicroscopie Électronique: ↑ Technique qui utilise des électrons pour obtenir des images de molécules biologiques qui sont dans l’eau et qui sont refroidies à de basses températures très rapidement.
Conflit d’intérêts
Les auteurs déclarent que les travaux de recherche ont été menés en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un potentiel conflit d’intérêts.
Remerciements
Nous remercions Alex Bernstein pour les figures et Susan Debad pour la révision du manuscrit.
Références
[1] ↑ Dubochet, J., Lepault, J., Freeman, R., Berriman, J. A., and Homo, J.-C. 1982. Electron microscopy of frozen water and aqueous solutions. J. Microscopy 128:219–37. doi: 10.1111/j.1365-2818.1982.tb04625.x
[2] ↑ Liu, H., Jin, L., Koh, S. B. S., Atanasov, I., Schein, S., Wu, L., et al. 2010. Atomic structure of human adenovirus by cryo-EM reveals interactions among protein networks. Science 329:1038–43. doi: 10.1126/science.1187433
[3] ↑ Allegretti, M., Mills, D. J., McMullan, G., Kühlbrandt, W., and Vonck, J. 2014. Atomic model of the F420-reducing [NiFe] hydrogenase by electron cryo-microscopy using a direct electron detector. Elife 3:e01963. doi: 10.7554/eLife.01963
[4] ↑ Vinothkumar, K. R., and Henderson, R. 2016. Single particle electron cryomicroscopy: Trends, issues and future perspective. Q. Rev. Biophys. 49:e13. doi: 10.1017/S0033583516000068
[5] ↑ Henderson, R. 2015. Overview and future of single particle electron cryomicroscopy. Archiv. Biochem. Biophys. 581:19–24. doi: 10.1016/j.abb.2015.02.036
