תַקצִיר
האם תהיתם כיצד מדעניות ומדענים חוקרים מחלות אנושיות ומפתחים טיפולים חדשניים לשיפור בריאותנו? במשך שנים רבות, הדרך המרכזית לעשות זאת הייתה לחקות מחלות אנושיות בבעלי חיים פשוטים, שחולקים מאפיינים משותפים עם בני האדם. על אף שניסויים אלה קידמו מאוד את מדע הרפואה, תוצאותיהם אינן מנבאות תמיד את המצב במטופלים אנושיים. מִסִּבָּה זו, מדעניות ומדענים החלו לחקור מחלות באמצעות סוג מיוחד של תאים אנושיים – תאי גזע עובריים. תאים אלה נמצאים בגופנו רק בשלבים המוקדמים של התפתחות העובר, וידועים ביכולתם ליצור את כל סוגי התאים והרקמות בגוף. כיצד ניתן להפיק תאי גזע מחולים במחלות שונות? כיצד אפשר לגרום לתאים אלה להתפתח לסוג התא שנפגע מהמחלה, ולבדוק תרופות חדשות במבחנה? במאמר נבחן את הדרכים שבהן תאי גזע תורמים למחקר מחלות אנושיות ולטיפול בהן.
מודלים מחקריים למחלות
במסגרת עבודתו כרופא כפרי, הבחין הרופא הבריטי אדוארד ג’נר בתופעה מעניינת: נערות שעבדו בחליבת פרות ונדבקו באבעבועות הבקר, מחלה קלה שאינה מסכנת חיים, נעשו חסינוֹת בפני מחלת האבעבועות השחורות – מגפה מסוכנת שהביאה למותם של מיליוני בני אדם. ב-14 במאי 1796, החליט ג’נר לבצע ניסוי: הוא הדביק את ג’יימס, בנו בן השמונה של גנן המשפחה, באבעבועות הבקר, ולאחר מכן הזריק לגופו נוזל נגוע באבעבועות שחורות. למרבה המזל, הילד לא חלה במחלה המסוכנת, וכך באה לעולם השיטה הטובה ביותר להתגונן בפני מחלות מידבקות: החיסון המודרני.
בימינו, ניסוי דומה לא יעלה על הדעת: ניסויים רפואיים בבני אדם כפופים להגבלות חמורות שנועדו להגן על המשתתפים מההשלכות של טיפולים חדשניים, שיעילותם ובטיחותם טרם נבדקו. שינוי משמעותי זה הציב אתגר בפני מדענים ומדעניות המבקשים לחקור מחלות אנושיות – כיצד יוכלו לבדוק את השערותיהם?
כדי להתגבר על האתגר, הציע מדע הרפואה רעיון מהפכני: לפתח מערכות ניסיוניות פשוטות שמדמוֹת מצב של מחלה אנושית, ומאפשרות לאסוף נתונים בנוגע לגורמי המחלה ולאפשרויות הטיפול בה. מערכות ניסיוניות מהסוג הזה מכונות גם “מודלים מחקריים למחלות” (איור 1).
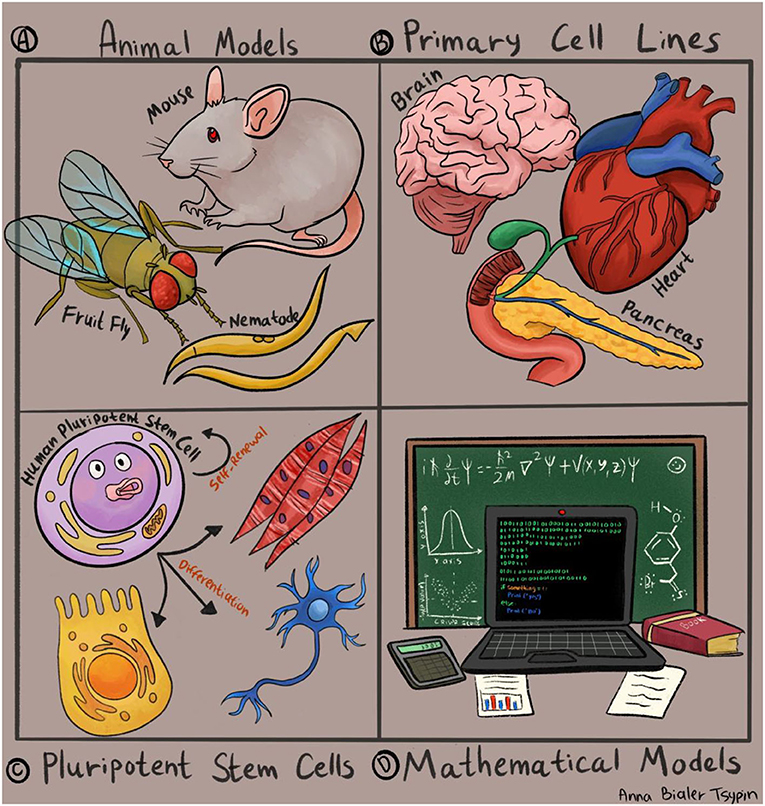
- איור 1 - פיתוח מודלים מחקריים למחלות אנושיות.
- מערכות ניסיוניות המשמשות מדענים כדי לחקור מצבי מחלה: (A) שחזור מחלות אנושיות בבעלי חיים כגון תולעים, זבובים ועכברים; (B) ניסויים במבחנה באמצעות תאים שבודדו ישירות מרקמות שונות בגוף כגון לב, מוח ולבלב; (C) מודלים למחלות אנושיות באמצעות תאי גזע פלוריפוטנטיים, המסוגלים להתמיין במבחנה לכל סוגי התאים בגוף; (D) ניסויים באמצעות מודלים מתמטיים ותוכנות מחשב. איור: אנה ביאלר-ציפין.
המודלים הראשונים והמבוססים ביותר למחלות אנושיות פותחו בבעלי חיים (איור 1A). לאורך השנים הושקעו מאמצים רבים בניסיון לחקות מחלות אנושיות בבעלי חיים פשוטים יותר כגון חולדות, עכברים, דגים ואפילו זבובים ותולעים. כיוון שבני אדם חולקים מגוון מאפיינים עם בעלי חיים אלה, מודלים בבעלי חיים לימדו אותנו רבות על אודות מחלות אנושיות, ואף הביאו לתגליות פורצות דרך ברפואה. דוגמה ידועה לכך היא חֵקֶר מחלת הסוכרת שנגרמת משיבוש במאזן הסוכרים בגוף, אשר נשלט על ידי הלבלב. כלבים שעברו ניתוח להסרת הלבלב שימשו כמודלים המוקדמים ביותר של המחלה, וניתן היה להראות באמצעותם את הקשר בין פעילות הלבלב להתפתחות מחלת הסוכרת, ואף לזהות טיפול מציל חיים עבור החולים: הורמון האינסולין.
עם זה במקרים רבים ההבדלים בין בני אדם לבעלי חיים מקשים על חיקוי מצבי מחלה במודל חיה. במקרים כאלה, תוצאות מניסויים בבעלי חיים לא ינבאו את התוצאות מאותם הניסויים לוּ היו נערכים בבני אדם. מסיבה זו, מדעניות ומדענים ניסו למצוא דרכים לחקור מחלות ישירות בתאים אנושיים. במחקרים רבים נאספו דגימות רקמה מחולים במחלות שונות, במטרה לגדלן במבחנה ולהשוותן לרקמות שנאספו מאנשים בריאים, כדי ללמוד על ההבדלים שבין הרקמה החולה לרקמה הבריאה (איור 1B). במצבים מסוימים, כמו במטופלים הסובלים מגידול סרטני, קל יחסית להשיג דגימה מתאימה, לבודד את תאי הסרטן במבחנה ולבצע ניסויים כדי ללמוד על תכונות התאים הסרטניים.
אולם מה בדבר מחלות שפוגעות בפעילות הלב, או בפעילות המוח? הגישה לאיברים אלה מסובכת ומוגבלת, וגם כשמצליחים להשיג דגימות באיכות טובה ובכמות מספקת, קשה לגדלן במבחנה לאורך זמן ולבצע באמצעותן ניסויים.
תאי גזע פְלוּרִיפּוֹטֶנְטִיים: מודל חדש למחלות אנושיות
בעשורים האחרונים התאפשר להתגבר על חלק מהמכשולים הללו בעזרתם של תאים מיוחדים הקרויים תאי גזע עובריים. תאים אלה נמצאים בגוף רק בשלב מוקדם מאוד בהתפתחותנו, כשבוע לאחר ההפריה. בשלב הזה העובר מורכב רק מקומץ קטנטן של תאים ייחודיים, בעלי שתי תכונות: ראשית, תאים אלה יכולים להתחלק ולהתרבּוֹת ללא כל הגבלה; שנית, הם ניחנים ביכולות התמיינוּת והתפתחות לכל סוגי התאים והרקמות בגוף. תכונה זו מכונה גם פְּלוּרִיפּוֹטֶנְטִיוּת (איור 1C).
כדי להשתמש בתאי גזע עובריים לצורכי מחקר, מדענים היו צריכים “לפצח” את תנאי הגידול המתאימים שמאפשרים את קיומם של תאים אלה במבחנה, ושומרים עליהם במצבם הפלוריפוטנטי. בד בבד מדענים חקרו כיצד ניתן לגרום לתאי הגזע להתמיין במבחנה לתאים מסוגים שונים: תאי מוח, תאי לב, תאי דם ועוד.
תאי גזע פלוריפוטנטיים התגלו כשימושיים במיוחד בחֵקֶר מחלות תורשתיות הנגרמות מפגיעה בגֶנים, שהם רִצְפֵי דנ“א אשר קובעים את תכונות גופנו. הדנ”א נמצא בכל תא בגופנו, ומכיל את ההוראות ליצירתם של חלבונים – אבני הבניין שבאמצעותן הגוף מתפקד. אנו יורשים את רצף הדנ“א באופן שווה משני ההורים, עותק מהאם ועותק מהאב, כך שמכל גֶּן יש לנו סך הכול שני עותקים. כאשר הורינו מורישים לנו רצפי דנ”א שבהם נפלו שגיאות, המכונות מוּטַצְיוֹת, ההוראות לבנייתו של אחד מחלבוני הגוף עשויות להשתבש, מה שיביא ליצירתו של חלבון פגום. כיום, מוכרות למדע מוטציות רבות הפוגעות בתפקודם של גנים חשובים, ואחראיות לבעיות רפואיות שונות.
בתחילה, הדרך היחידה לבודד תאי גזע פלוריפוטנטיים הייתה באמצעות תרומות עוברים זעירים מתהליכי הפריה חוץ-גופית, שאליהם מופנים זוגות שמתקשים להיכנס להיריון (איור 2A). במקרים שבהם בני הזוג נושאים מוטציות ידועות ברצף הדנ“א, בדיקות מיוחדות מאפשרות להפריד בין עוברים שירשו את העותק הפגום מההורים, לבין עוברים שקיבלו עותקי גנים תקינים. בעוד שעוברי מבחנה שאינם נושאים את הפגם הגנטי מאפשרים לזוג להביא לעולם ילדים בריאים, העוברים המוקדמים שירשו את הפגם הגנטי יכולים לשמש לצורכי מחקר.
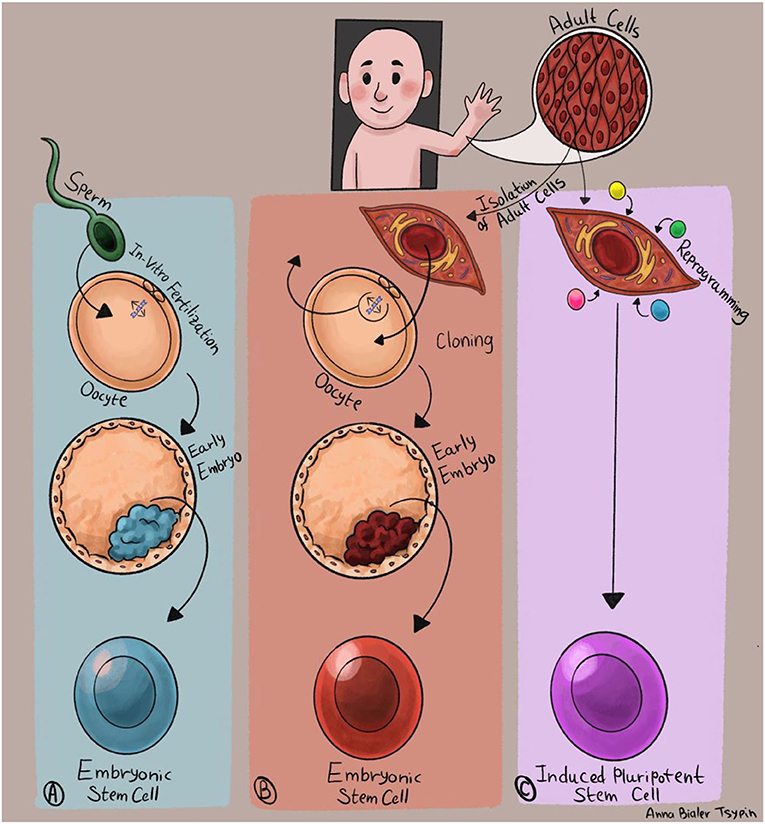
- איור 2 - דרכים להפקת תאי גזע פלוריפוטנטיים.
- (A) תאי גזע עובריים: מפגש בין תא זרע (ירוק) ותא ביצית (כתום) מביא ליצירת עובר זעיר במבחנה, שממנו ניתן להפיק תאי גזע עובריים. (B) שיבוט: חומר גנטי של תא בוגר מוחדר לתוך ביצית מרוקנת. המאפיינים הייחודיים של תא הביצית גורמים לחומר הגנטי הבוגר לחזור לצורתו העוברית, והביצית המשובטת מתפתחת לעובר שממנו ניתן להפיק תאי גזע פלוריפוטנטיים. (C) תכנות מחדש: מבודדים תאים בוגרים, מחדירים לתוכם שילוב של ארבעה גֶּנִים המתפקדים בשלב העוברי. החדרתם של הגנים העובריים גורמת לתאים הבוגרים לעבור ”תכנות מחדש“, ולרכוש את התכונות האופייניות לתאי גזע עובריים. תאים אלה מכונים תאי גזע פלוריפוטנטיים מושרים. איור: אנה ביאלר-ציפין.
השימוש בעוברים בני כשבוע מַעֲלֶה בעיות אתיות וטכניות מורכבות, לכן חוקרות וחוקרים עמלו כדי להפיק תאי גזע פלוריפוטנטיים בלי להשתמש בעוברים אמיתיים. שיטה אחת שמאפשרת יצירת תאי גזע פלוריפוטנטיים מִתאים בוגרים היא שׁיבּוּט [1]. בתהליך של שיבוט לוקחים תא ביצית, מרוקנים אותו מהדנ”א שלו, ומזריקים לתוכו חומר גנטי של תא בוגר (איור 2B). מרכיבי התא הייחודיים של הביצית גורמים לדנ“א הבוגר לחזור לצורתו העוברית, והביצית המלאה בדנ”א הבוגר מתחילה להתפתח לעובר זעיר, עד לשלב שבו ניתן להפיק תאי גזע עובריים. היתרון בשיבוט הוא שתהליך זה מאפשר ליצור עבור כל אדם תאי גזע עובריים, המכילים את רצף הדנ“א הייחודי שלו. החיסרון הוא שמדובר בתהליך מורכב, המצריך שימוש בביציות אנושיות.
בשנים האחרונות התחוללה בתחום פריצת דרך נוספת: המדען היפני שיניה יאמאנקה הראה כי ניתן לקחת תאים בוגרים לחלוטין ולהעבירם תהליך של ”תכנוּת מחדש“, הגורם לתאים לזנוח את ייעודם הבוגר ולרכוש מחדש את התכונות האופייניות לתאי גזע עובריים [2]. התאים המתקבלים בתהליך ידועים גם בכינוי ”תאי גזע פלוריפוטנטיים מֻשְׁרִים“ (איור 2C). התגלית של יאמאנאקה חוללה מהפכה בתחום חֵקֶר מחלות באמצעות תאי גזע: בעזרת ”תכנות מחדש“ ניתן להפיק תאי גזע פלוריפוטנטיים ישירות מחולים בכל מחלה שהיא, לגדלם במבחנה ולהפיק מהם את סוגי התאים שנפגעים באותה המחלה.
קבלת סוג התא המבוקש
נניח שהשתמשנו באחת השיטות שמָנִינוּ, והפקנו תאי גזע פלוריפוטנטיים הנושאים פגם גנטי אשר גורם למחלה שמעניינת אותנו. כיצד נוכל לנצל את תכונותיהם הייחודיות של התאים כדי ללמוד על הגורמים למחלה ועל אפשרויות הטיפול בה? (איור 3).
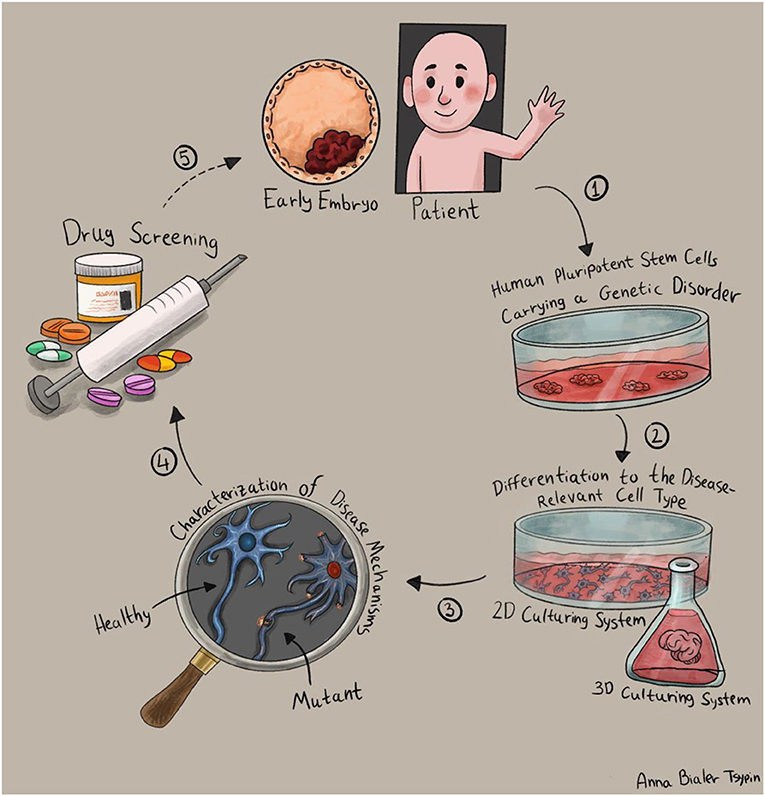
- איור 3 - חֵקֶר מחלות תורשתיות באמצעות תאי גזע פלוריפוטנטיים.
- דוגמה למחקר המתמקד במחלה תורשתית מסוימת. מלמעלה עם כיוון השעון: (1) מפיקים תאי גזע פלוריפוטנטיים הנושאים את הפגם הגנטי המבוקש, על ידי שימוש בעוברים זעירים (תאי גזע עובריים) או תכנות מחדש של תאים בוגרים מחולים (תאי גזע פלוריפוטנטיים מושרים). (2) התמיינות לסוג התא שנפגע במחלה: שיטות גידול דו-ממדיות אשר יוצרות כמות גדולה של תאים מהסוג שנפגע במחלה (איור עליון), או שיטות גידול תלת-ממדיות שיוצרות גרסה ממוזערת של האיבר האמיתי, המכונה ”אורגנואיד“ (איור תחתון) (3) אפיון השיבוש בתפקודם של התאים החולים, והגדרת יעדים טיפוליים – מה מבדיל בין תאי החולים לבין תאי הבריאים? (4) סריקה של תרופות וטיפולים אפשריים למחלה. (5) מעבר מניסויים במבחנה לניסויים רפואיים במטופלים. איור: אנה ביאלר-ציפין.
ראשית, עלינו למיין את תאי הגזע לסוג התא שנפגע באותה המחלה. פגם גנטי המתבטא בפיגור שכלי, לדוגמה, עדיף לחקור ישירות בתאי מוח. הפרעות לבביות לעומת זאת, נרצה לחקור בתאי לב. כדי להפוך את תאי הגזע לסוג התא המבוקש, עלינו להתאים את תנאי הגידול של התאים ולחשוף אותם לחומרי מזון ולאותות שינחו אותם להתפתח דווקא לכיוון שבו אנו מעוניינים, ולא לסוגי תאים אחרים. השיטות שמשמשות אותנו למיין תאי גזע הולכות ומתפתחות, והיום ישנם ”מתכונים“ רבים ליצירת סוגי תאים ייחודיים במבחנה. בשנים האחרונות פותחו אף שיטות גידול תלת-ממדיות, שגורמות לתאים ליצור גרסאות ממוזערות של איברים אמיתיים. גרסאות מוקטנות אלה מכונות ”אוֹרְגָנֹואִידִים“ [3].
הגדרת יעדים טיפוליים וחיפוש אחר תרופות
לאחר שקיבלנו את סוג התא שנפגע במחלה, עלינו להבין כיצד הפגם הגנטי משבש את תפקוד התאים. האם הוא משפיע על מבנה התא או על חלוקתו, על פעילותו הכימית או החשמלית? כשמדובר בתאים שגדלים במבחנה, זו שאלה מורכבת מאוד – עלינו להבין עד כמה השינויים שאנו מגלים משקפים את המצב בגוף השלם. למרות האתגר, חשיבותם של ניסויים אלה רבּה, כיוון שהם מאפשרים לנו להבין את המנגנון שגורם למחלה, ולהגדיר יעדים טיפוליים – תהליכים בתא שההשפעה עליהם תוכל להקל על תסמיני החולים.
אחד היתרונות המרכזיים בשימוש בתאי גזע הוא היכולת לבדוק טיפולים מסוגים שונים על תאי החולים, בלי לסכן את המטופלים עצמם. הקלות שבה ניתן לגדל את התאים במבחנה ולמיינם, מאפשרת למדענים ולמדעניות לסרוק אלפי תרופות במקביל, כדי לבדוק אלה תרופות ”מתקנות“ את תאי החולים והופכות אותם דומים יותר לתאים בריאים. סריקות אלה מאפשרות גם לזהות מראש השפעות בלתי צפויות של תרופות על רקמות שונות. לבסוף, כיוון שניתן להפיק תאי גזע פלוריפוטנטיים ישירות מחולים, אפשר להתאים את הטיפול לסוג המוּטציה שנושא החולה ולרקע הגנטי שלו, ולתכנן טיפולים מותאמים אישית.
לצד השימוש בתאי גזע ככלי מחקרי, מדעניות ומדענים בוחנים שימוש בתאים פלוריפוטנטיים גם בתור טיפול. במחלות שנגרמות מפגיעה בסוג תא מוגדר, לדוגמה מחלת הפרקינסון, שבה נפגעים תאי מוח מיוחדים החשובים לשליטה על תנועות הגוף – אם נוכל למיין את תאי הגזע לסוג התא שנפגע, ולהשתיל את התאים הממוינים במוחם של החולים, אולי יהיה באפשרותנו להחליף את התפקוד הפגוע.
סיכום
תאי גזע פלוריפוטנטיים טומנים בחובם פוטנציאל רפואי עצום. בעשורים האחרונים נוצרו מודלים מחקריים למחלות רבות בתאי גזע פלוריפוטנטיים, פותחו שיטות התמיינות חדשניות ונערכו סריקות תרופתיות רחבות-היקף [4]. גם היום, לאחר מחקרים רבים שנערכו, רב הנסתר על הגלוי – מה עומד מאחורי יכולתם המופלאה של תאי הגזע ליצור את כל סוגי התאים בגוף? האם שיטות גידול מתקדמות יצליחו להביא ליצירת איברים אמיתיים במבחנה, ולענות על המחסור המשמעותי בתרומות איברים מבני אדם? מהי הדרך הנכונה לתווך בין טיפולים שהתגלו במבחנה לבין ניסויים רפואיים במטופלים?
מחקרים רבים עוד יידרשו לצורך ירידה לעומקן של שאלות אלה.
מילון מונחים
תא (Cell): ↑ יחידת החיים הבסיסית והקטנה ביותר. גופנו מורכב מתאים מסוגים שונים: תאי מוח, תאי שריר, תאי עור ועוד.
רקמה (Tissue): ↑ צֶבֶר תאים בעלי מבנה ותפקוד משותפים.
גידול סרטני (Cancer): ↑ מצב שבו תאים מרקמה מסוימת משנים את תכונותיהם ומתחילים להתחלק ולגדול ללא בקרה.
הפריה (Fertilization): ↑ המפגש בין תא זרע לתא ביצית שמביא ליצירת העובר.
התמיינות (Differentiation): ↑ התהליך שבו תא גזע הופך לתא בעל תפקיד ומאפיינים מוגדרים בגוף כגון תא מוח, תא לב, תא דם או תא מעי.
פלוּריפוֹטנטיוּת (Pluripotency): ↑ מונח מלטינית (”פּלוּרִי“ = ריבוי, ”פּוֹטֶנְטִיוּת“ = יכולת) המתאר את יכולתם של תאי הגזע להתמיין לכל סוגי התאים המצויים בגוף.
דנ”א (DNA): ↑ החומר התורשתי המצוי בכל אחד מתאי גופנו, ומכיל את “ספר ההוראות” לכל תפקודי הגוף ותכונותיו.
הפריה חוץ-גופית [In Vitro Fertilization (IVF)]: ↑ תהליך שבו מפגישים בין תא זרע לתא ביצית במבחנה, מחוץ לגוף, ויוצרים עובר זעיר שניתן להחזיר אל תוך הרחם.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
אנו מודים לאנה ביאלר-ציפין על עזרתה בהכנת האיורים.
מקורות
[1] ↑ Tachibana, M., Amato, P., Sparman, M., Gutierrez, N. M., Tippner-Hedges, R., Ma, H., et al. 2013. Human embryonic stem cells derived by somatic cell nuclear transfer. Cell. 153:1228–38. doi: 10.1016/j.Cell.2013.05.006
[2] ↑ Takahashi, K., and Yamanaka, S. 2006. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126:663–76. doi: 10.1016/j.Cell.2006.07.024
[3] ↑ Lancaster, M. A., and Knoblich, J. A. 2014. Generation of cerebral organoids from human pluripotent stem cells. Nat. Protoc. 9:2329–40. doi: 10.1038/Nprot.2014.158
[4] ↑ Avior, Y., Sagi, I., and Benvenisty, N. 2016. Pluripotent stem cells in disease modelling and drug discovery. Nat Rev Mol Cell Biol. 17, 170–82. doi: 10.1038/nrm.2015.27
