תַקצִיר
תאי B הם תאי דם לבנים קטנים שתורמים להגנה החיסוּנית שלנו. הם מייצרים נוגדנים, אשר מסייעים לנו להחלים מזיהומים. כאשר אינם פועלים באופן תקין, תאים אלה עלולים לגרום למחלות. אם הם עוברים מוּטַצְיָה ובעקבותיה מתחלקים בצורה בלתי נשלטת, תאי B עלולים לייצר סוגים שונים של סרטן הדם, שנקרא לוֹקֶמְיָה, או סוגים שונים של סרטן קשרי הַלִּימְפָה, שנקרא לִימְפוֹמָה. מאמר זה עוקב אחרי ההתפתחות של רִיטוּקְסִימַאבּ (Rituximab)–תרופה שהורגת תאי B סרטניים. באופן פרדוֹקסלי, התרופה עצמה היא נוֹגדן–תוצר של תא B! פיתוח נוגדן כזה לכדי תרופה הִצריך יֶדַע מעמיק לגבי מערכת החיסון; הנדסה גנטית חכמה ומאמץ גדול של מדענים ושל רופאים. זהו סיפורם של כמה מדענים מצוינים שהתקדמו בשיתוף פעולה על בסיס עבודותיהם , במטרה ליצור תרופה אשר לימים התגלתה כמצילה חיים רבים.
הקדמה
במאמר זה נביא בפניכם את סיפורה של רִיטוּקְסִימַאבּ–תרופה המשמשת לטיפול בסרטני הדם והלימפה [1]. סוגי סרטן אלה נגרמים על ידי תאים של מערכת החיסון שעוברים מוּטַצְיָה ומתחלקים כשאינם אמורים להתחלק. אופן פעולתן של תרופות רבות שבהן נעשה שימוש לטיפול בסוגי סרטן אלה, מבוסס על הריגת כל תא שמתחלק, לרבּוֹת תאים סרטניים, אשר מתחלקים מהר. אולם, סוגים מסוימים של תאים תקינים גם נדרשים להתחלק כל הזמן, בהם התאים שמרפדים את המעיים והתאים יוצרי הדם בּמֵּחַ העצם. כחלק מפעילותן של התרופות האנטי-סרטניות שמאתרות תאים מתחלקים, נהרגים גם התאים הבריאים הללו. עקב ההשפעות השליליות של התרופות האלה, מידת השימוש בהן מוגבלת.
רִיטוּקְסִימַאבּ–'גלולת פלא' שמציעה פתרון לבעיה
היה טוב יותר לוּ יכולנו להרוג רק את התאים שגורמים לסרטן, באמצעות 'גלולת קסם'. מדענים משתמשים בביטוי זה כדי לתאר תרופות שפועלות באופן מדויק מאוד על גורם המחלה, והן בעלות השפעות לוואי מינימליוֹת. רִיטוּקְסִימַאבּ היא תרופה שמתקרבת באופן משמעותי לשאיפה הזו. התרופה נקשרת למולקולה שנקראת CD20, אשר נמצאת על פני השטח של תאים חיסוניים מסוימים, שנקראים תאי B. היקשרות הריטוקסימאב לתאים אלה מאפשרת את הֲסָרָתָם של תאי B האַבְּנוֹרמליים שגורמים לסרטן. בעת פעולתה, ריטוקסימאב גם מסירה תאי B תקינים, שהם חלק מההגנות החיסוּניוֹת שלנו, אך באופן שאינו מזיק מאוד: תאים חיסוניים אחרים עדיין יכולים להגן עלינו מפני מַרְבִּית הזיהומים. ריטוקסימאב אינה תוקפת תאים אחרים בגוף, מאחר שאינם מכילים את מולקולת ה-CD20. לכן, טיפול זה נמצא יעיל יותר ופחות מזיק לעומת תרופות יְשָׁנוֹת יותר.
בפיתוח של ריטוקסימאב היו מעורבים מדענים רבים שבּנו באופן הדדי על בסיס עבודות עמיתיהם, במשך עשורים. הם נדרשו לגלות כיצד תאי B פועלים בתוך מערכת החיסון; כיצד הם גורמים למחלה ובאיזה אופן ניתן להבדיל תאים אלה מסוגי תאים אחרים. לאחר מכן, היה על המדענים להשתמש ביֶדַע זה וליישׂמו במטרה להרוג תאי B שאינם פועלים באופן תקין במטופלים אנושיים.
תאי B בהגנה ובחולי
כולנו חווינו תחושות של מחלה ועייפוּת, הַמְּלֻוּוֹת בנזלת, שיעול, או חום במשך כמה ימים, ואז אט-אט התחלנו להרגיש טוב יותר שוב. תחושות אלה עלולות להיגרם על ידי נגיף צינון שכיח שנכנס לריאות ומשתכפל בתאי הגוף. מערכת החיסון נלחמת בנגיף ומשקמת את בריאוּתנו. ללא תגובה חיסונית, היינו נהפכים במהרה לקרקע להתרבּוּת נגיפים וזיהומים אחרים.
מערכת החיסון משתמשת בתאי דם לבנים ובחלבונים במחזור הדם כדי לְאַתֵּר סוכנים מזהמים ולחסל אותם. חלק מתאי הדם הלבנים מייצרים תסמינים שמסייעים להילחם בזיהומים: דלקת; עייפוּת וחום. תאי דם לבנים אחרים וחלבונים שונים נלחמים בזיהומים בגוף באמצעות זיהוי כל נגיף או חיידקמזהם על ידי צורות ייחודיות של המולקולות שלו (שנקראות אַנְטִיגֶנִים). זיהוי אנטיגנים מאפשר לתקוף את הגורם המזהם באופן מדויק הרבה יותר.
תאי B הם סוג של תאי דם לבנים המשתתפים בתגובה החיסונית [2]. על פני השטח של כל תא B יש חלבון, שנקרא נוגדן, אשר שונה במעט מהנוגדנים של תאי B אחרים (איור 1A). במהלך זיהום, תאי B פוגשים את הגורם המזהם. אם לגורם המזהם יש אנטיגן שאליו הנוגדן של תא B נקשר, אותו תא B יתחלק. תהליך זה מייצר תאי B נוספים שמייצרים את אותו הנוגדן. חלק מהתאים האלה ישחררו את הנוגדנים שלהם, כך שיוכלו לנוע בדם ולהיקשר לגורם המזהם בכל מקום שהוא עשוי להיות בו. הנוגדן הקשור מְאַתֵּר את הגורם המזהם כדי שמערכת החיסון תהרוס אותו. חלק מתאי ה-B המגיבים יכולים לשרוד במשך תקופות ארוכות, והם מספקים זיכרון חיסוני, כלומר תגובה מהירה יותר ועוצמתית יותר, כאשר אותו גורם מזהם נכנס שוב לגוף בשלב מאוחר יותר בחיים. המדען והאימוּנוֹלוֹג הַדֶּנִי ניילס קָאג' גֶּ'רֶן גילה את ההסבר הזה לתגובות חיסוּניוּת [3 ,2].
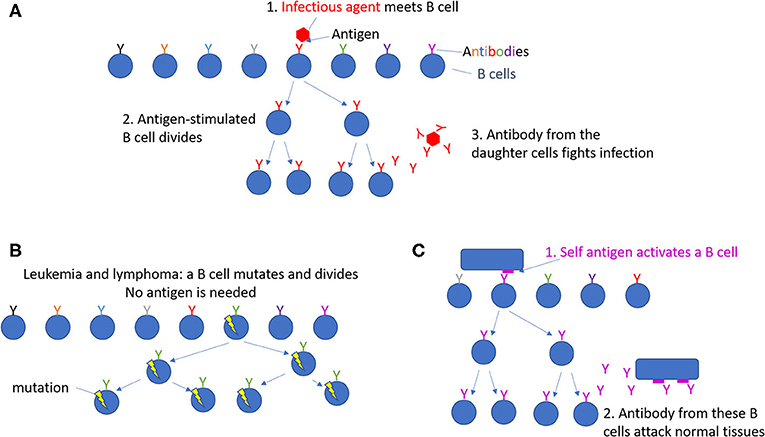
- איור 1 - חלוקה של תאי B.
- (A) על פני השטח של כל תא B יש נוגדן (Antibody) ייחודי, שמוצג כאן בצבעים שונים. תאי B תקינים מתחלקים רק כאשר גורם מזהם (Infectious agent) נכנס לגוף, ולאחר זיהוי האנטיגנים (Antigen) שלו. לאחר מכן, תאי B ספציפיים עבור אותו גורם מזהם מתחלקים ומייצרים נוגדנים שנלחמים בזיהום שנוצר.
(B) סוגי לוֹקמיה (leukemia)– סרטן הדם, וסוגי לימפוֹמה (lymphoma)– סרטן קשרי הלימפה, עלולים להתפתח מתאי B שעברו מוּטציה (Mutation), כך שתאים אלה מתחלקים יותר מדי, אפילו כשאין זיהום. (C) במחלות אוטואימוניות, תאי B מתחלקים ומייצרים נוגדנים שפוגעים ברקמות (Tissues) תקינות.
מקרא:
.1 .A גורם מזהם פוגש תאי B
2. תאי B אשר גֹּרוּ על 3. ידי אנטיגן, מתחלקים נוגדנים מתאי הבת (הנוצָרים לאחר החלוקה) נלחמים נגד הזיהום B. לוקמיה ולימפומה: תאי B עוברים מוטציה ומתחלקים (לא נדרשת נוכחות אנטיגן)
.1 .C אנטיגן עצמי מפעיל תא B
2. נוגדן מתאי B אלה תוקף רִקמה תקינה.
מרבית תאי ה-B האחרים לא ישתתפו במאבק זה, מאחר שהנוגדנים שלהם אינם יכולים להיקשר לאותו האנטיגן. אולם, הם עשויים להגיב לזיהום אחר, בזמן אחר. לבני אדם יש מיליוני נוגדנים ייחודיים על גבי תאי ה-B שלהם. רק חלק קטן מהם נעשה פעיל בתגובה לכל זיהום. יחד, תאי ה-B שלנו יכולים להילחם כנגד כל הזיהומים שאנו עלולים להיתקל בהם.
לפעמים, במקום להילחם בזיהומים, תאי B עלולים לגרום למחלות. לעיתים, עשויות להתרחש מוטציות בתא B, ולגרום לו להתחיל להתחלק כל הזמן, אף על פי שאין בנמצא אנטיגן כדי להפעיל אותו (איור 1B) [1]. תאי ה-B שעברו מוטציה מצטברים בדם כסרטן מסוג לוֹקֶמְיָה, או במקום אחר בגוף, תוך יצירת מצבור תאים שנקרא לִימְפוֹמָה. תאי B הסרטניים עשויים לשבש את התפקודים התקינים של הדם או של האיברים שבהם הם מצטברים, ובסופו של דבר לגרום למוות. ישנם סוגים רבים של לוקמיה ולימפומה; רק חלקם מגיעים מתאי B שאינם פועלים באופן תקין.1 במטופלים אחרים, תאי B מייצרים נוגדנים שתוקפים בטעות רקמות בריאוֹת בגוף, שאינן מזוהמות (איור 1C). מחלות שנגרמות עקב טעויות כאלה נקראות מחלות אוֹטוֹאימוּניוֹת, והן עלולות לתקוף מִפרקים, כלי דם, את המוח, או רקמות אחרות.
זיהוי תאי B אנושיים באמצעות עכברים
במטרה לפתח תרופה לטיפול בסרטן דם לסוגיו, מדענים ראשית היו צריכים ללמוד כיצד להבחין תאי B אנושיים (לרבּוֹת תאי B שעברו מוטציה ויצרו סרטני לוקמיה ולימפומה), מסוגים אחרים של תאי דם לבנים. עד כה, למדתם כי נוגדנים משמשים את מערכת החיסון לזיהוי אורגניזמים מזהמים... אולם, מדענים גם למדו כיצד לייצר נוגדנים שמזהים סוגי תאים מסוימים, כמו תאי B! דרך זו לשימוש במערכת החיסון פותחה בתחילה בעכברים.
בשנות ה-70 של המאה הקודמת, הביולוג הגרמני ז'וֹרז' קוֹהֵלֶר והביוכימאי הארגנטינאי- בריטי סֵזַר מילשטיין, שעבדו בקיימברידג', בריטניה, השתמשו בעכברים כדי לפתח תהליך ליצירת נוגדנים כנגד אנטיגן מסוים [3]. הם התחילו על ידי חיסון עכבר באמצעות אנטיגן. בעכבר נוצרה תגובה חיסונית, שבה חלק מתאי ה-B התחלקו ויצרו נוגדנים שיכלו להיקשר לאנטיגן. לאחר מכן, הם גידלו תאי B מעכבר בצלחות תִּרְבּוּת זעירות, והכריחו אותם להתחלק כל הזמן. אז, צמד המדענים היה מסוגל לזהות, בין אלפי תרביות כאלה, את אותם תאי B שיצרו נוגדנים ספציפיים לאנטיגן המחסן. תאי ה-B האלה גודלו בכמויות גדולות במטרה לקבל נוגדן ייחודי שנוצר על ידי תא ה-B הראשון וכל התאים שגדלו ממנו, שנקראים תאי בת. תא בודד עם כל תאי הבת שלו נקראים שבט (clone), מאחר שכל התאים יוצרים את אותו הנוגדן בדיוק. הנוגדן שמיוצר על ידי שבט בודד של תאי B נקרא נוגדן חד-שבטי.
אולם, כיצד הדבר סייע למדענים לזהות תאי B אנושיים? בעכברים, נוגדנים חד-שבטיים יכולים להיות מיוצרים כנגד כל אנטיגן שהוא זָר לעכבר. מאחר שתאי B אנושיים הם זָרים לעכברים, עכברים שחוסנו עם תאי דם לבנים ייצרו כמה מהנוגדנים הספציפיים למולקולות שנמצאות בתאי B אנושיים (איור 2). בשימוש בשיטה ליצירת נוגדנים חד- שבטיים שתוארה לעיל, מדענים זיהו מולקולה שנקראת CD20, אשר נמצאת על תאי B אנושיים אך לא על תאים אחרים בגוף האדם. כשתאי B עוברים מוטציה ונעשים סרטניים, הם ממשיכים להכיל מולקולות CD20 על פני השטח שלהם. לכן, נוגדנים שנקשרים ל-CD20 יכולים לשמש לזיהוי תאי B תקינים וסרטניים כאחד [5].
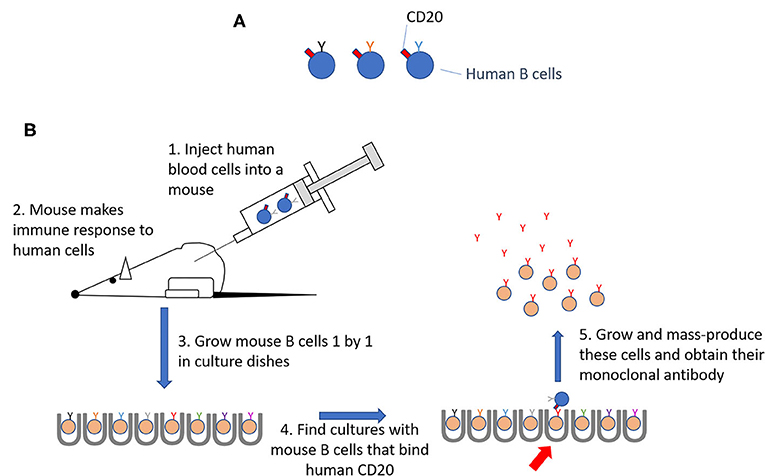
- איור 2 - יצירת נוגדנים שמזהים תאי B אנושיים.
- (A) מולקולת CD20 נמצאת על כל תאי B האנושיים (Human B cells). (B) 1+2. תאי דם אנושיים, בהם תאי B, הוזרקו לעכברים במטרה לגרות תגובה חיסונית (Immune response). 3. תאי B מהעכברים המחוסנים גודלו אחד-אחד בצלחות תִּרְבּוּת (Culture dishes). 4. נמצא תא B אחד של עכבר, אשר יצר נוגדן שנקשר (bind) ל-CD20 על תאי B אנושיים. 5. השבט זה גֻּדַּל ויֻצַּר בכמויות (mass-produce), בתור מקור לנוגדן חד-שבטי (Monoclonal antibody) זה.
הפיכת נוגדנים ספציפיים ל-CD20 לתרופה שפועלת בבני אדם
ראינו כי מערכת החיסון הורגת גורמים מזהמים שאליהם נקשר נוגדן. אם כן, האם אפשר להרוג תאי B מסוג לוקמיה או לימפומה פשוט על ידי הַזְרָקַת נוגדני CD20 מעכברים למטופלים? לרוע המזל, נוגדנים מעכברים אינם פועלים היטב עם חלקים אחרים במערכת החיסון האנושית שנדרשים להריגת גורמים מזהמים הַמְּצֻפִּים בנוגדנים. לכן, נדרש צעד אחד נוסף כדי ליצור תרופה יעילה [5].
נוגדנים מעוצבים בצורת האות 'Y', כשלחלקים השונים של ה-'Y' יש תפקודים שונים (איור 3). האנטיגן נקשר לשני הקצוות של ה-'Y', בעוד שגזע ה-'Y'מפעיל את מערכת החיסון להריגה. תהליך מעבדה שנקרא הנדסה גנטית יכול לשמש ליצירת מולקולות מלאכותיות, על ידי ארגון חומר גנטי בשילובים חדשים. קבוצת מדענים בתאגיד IDEC Pharmaceuticals, חברת ביוטכנולוגיה בסן דייגו, ארצות הברית, עשתה זאת ויצרה את הריטוקסימאב [6 ,5 ,1]. ריטוקסימאב מכילה את קצוות ה-'Y' מנוגדן חד-שבטי של עכבר, אשר נקשר ל-CD20. החלק הנוסף של הריטוקסימאב מגיע מנוגדן אנושי, אשר פועל היטב במערכת החיסון האנושית. הנוגדן המלאכותי הזה, חלקית אנושי-חלקית של עכבר, הוכח כתרופה יעילה להריגת תאי B.

- איור 3 - כיצד יוצרה ריטוקסימאב.
- משמאל לימין באיור: ריטוקסימאב מכילה חלק של נוגדן חד-שבטי מעכבר, אשר נקשר ל-CD20 אנושי, שמחובר לשאר מולקולות הנוגדן מבן אדם. מנגנון זה יכול לפעול בתוך מערכת החיסון האנושית כדי להרוג תאים שהנוגדן נקשר אליהם. שילוב זה אינו קיים בטבע, אך ניתן לייצרו באמצעות הנדסה גנטית (Genetic engineering).
ריטוקסימאב עברה מבדקי בטיחות בחיות, ואז ניתנה למטופלים שחלו בלימפומה של תאי B לסוגיה. התרופה הוּכחה כהצלחה גדולה, ריפאה יותר אנשים בהשוואה לשילוב של תרופות שהרג תאים מתחלקים, ועוררה פחות תופעות לוואי חמורות. מאז 1997, כאשר ריטוקסימאב ניתנה לראשונה בהיקף נרחב למטופלי לימפומה, שיעורי ההישרדות של מטופלים גדלו מאוד. שילוב של ריטוקסימאב עם תרופות אחרות נמצא יעיל עוד יותר. בהמשך, נצפו תועלות גם בסוגים שונים של לוקמיה של תאי B [1]. כיום, ריטוקסימאב משמשת לטיפול במחלות אחרות שבהן תאי B גורמים נזק בלי להפוך לסרטניים [7]. נוכחנו כי לעיתים תאי B גורמים למחלות אוטואימוניות על ידי תקיפה מוטעית של אזור בריא בגוף. גם בחלק מהמחלות האלה, ריטוקסימאב, או נוגדנים דומים, מהווים טיפולים יעילים.
מסקנות ותחזית
ראינו כי תרופה עוצמתית חדשה, ריטוקסימאב, נוצרה ראשית על ידי זיהוי תאי B של מערכת החיסון האנושית, באמצעות נוגדנים חד-שבטיים. הנדסה גנטית סייעה לשפר את יעילותם של נוגדנים חד-שבטיים אלה בהריגת תאי B סרטניים בגוף האדם. סיפור זה מדגיש כיצד מדענים ורופאים יכולים לעבוד יחד, במשך שנים רבות, במטרה לשפר חיים ולהאריכם. ריטוקסימאב הייתה אחד הנוגדנים החד-שבטיים הראשונים שפותחו במטרה לטפל בסוגים שונים של סרטן הדם האנושי. נוגדנים חד-שבטיים היו לתוצרים חשובים שמיוצרים על ידי תעשיית הביוטכנולוגיה לטיפול במחלות רבות, כמו גם לאבחון מחלות ולמחקרי מעבדה. מההצלחה של ריטוקסימאב ושל נוגדנים חד-שבטיים אחרים בטיפול במטופלים, כמו גם מחלק מהכישלונות, אנו ממשיכים ללמוד עוד על המחלות עצמן. אולי באחד הימים אתם תצטרפו למאמץ הזה.
מילון מונחים
אנטיגן (Antigen): ↑ החלק של גורם מזהם שמגרה תאי B ליצירת נוגדן, ושאליו אותו הנוגדן נקשר.
נוגדן (Antibody): ↑ חלבון על תאי B ובדם, אשר יכול להיקשר לאנטיגן. תאי B מרכיבים כל אחד נוגדן אחר.
לוקמיה (Leukemia): ↑ מחלה שבה תאים חיסוניים שעברו מוטציה מצטברים בדם.
לימפומה (Lymphoma): ↑ מחלה שבה תאים חיסוניים שעברו מוטציה מצטברים ברקמות קשיחוֹת.
מחלה אוטואימונית (Autoimmune disease): ↑ מחלה שבה מערכת החיסון תוקפת חלק מהגוף.
נוגדן חד-שבטי (Monoclonal antibody): ↑ נוגדן שנוצר על ידי תא B בודד ותאי הבת שלו. נוגדן מסוג זה מיוצר בכמויות גדולות במעבדה.
הנדסה גנטית (Genetic engineering): ↑ תהליך המעבדה שבו מדענים משנים דנ"א במטרה ליצור מולקולות או אורגניזמים בעלי תכונות חדשות.
הצהרת ניגוד אינטרסים
המחברים מצהירים כל המחקר נערך בהעדר כי קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
אני מודה לפרופסור Simon Bowman, לדוקטור Frances Hall, לדוקטור Michele Bombardieri ולדוקטור Paul Lyons על שיתוף הפעולה בחקירת תאי T במטופלים שקיבלו ריטוקסימאב, כחלק מניסוי ה-TRACTISS.
הערת שוליים
1. ↑מאמר זה בפרונטירז – מדע לצעירים [4] מתאר סוג אחר של לוקמיה, ואת הפיתוח של 'גלולת קסם' שונה לחלוטין לטיפול בו.
מקורות
[1] ↑ Borman, S. 2005. The top pharmaceuticals that changed the world: Rituxan. Chem Eng News. 83. doi: 10.1021/cen-v083n025.p110
[2] ↑ Kaiser, G., 2019. Adaptive immunity. In: Microbiology. Unit 6. Available online at: https://bio.libretexts.org/Bookshelves/Microbiology/Book%3A_Microbiology_(Kaiser)/Unit_6%3A_Adaptive_Immunity (accessed August 10, 2020).
[3] ↑ The Nobel Prize in Physiology or Medicine. 1984. Available online at: https://www.nobelprize.org/prizes/medicine/1984/summary/ (accessed August 10, 2020).
[4] ↑ Esposito, M. 2020. Imatinib, the magic bullet for treatment of blood cancer. Front. Young Minds 8:17. doi: 10.3389/frym.2020.00017
[5] ↑ Mohammed, R., Milne, A., Kayani, K., and Ojha, U. 2019. How the discovery of rituximab impacted the treatment of B-cell non-Hodgkin’s lymphomas. J. Blood Med. 10:71–84. doi: 10.2147/JBM.S190784
[6] ↑ Reff, M. E., Carner, K., Chambers, K. S., Chinn, P. C., Leonard, J. E., Raab, R., et al. 1994. Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20. Blood 83:435–45. doi: 10.1182/blood.V83.2.435.435
[7] ↑ Hofmann, K., Clauder, A.-K., and Manz R. A. 2018. Targeting B cells and plasma cells in autoimmune diseases. Front Immunol 9:835. doi: 10.3389/fimmu.2018.00835
