תַקצִיר
האם אתם יכולים לדמיין את הטלפון הנייד, שלט הטלוויזיה, או הרחפן שלכם מחוברים כל הזמן לכבל חשמל? זו הייתה המציאות לפני 1991, כאשר סוללות ליתיום נטענות הומצאו ושינו את עולמנו. המכשירים הקטנים האלה יכולים לספק חשמל לכל מכשירי האלקטרוניקה האלה, מה שמאפשר להם להיות ניידים ואלחוטיים. אולם המכשירים האלקטרוניים שלנו נעשים יותר ויותר מתקדמים, ודורשים יותר חשמל. מדעני סוללות עובדים קשה במטרה לפתח סוללות חדשות ומשופרות שיכולות לספק חשמל לטלפון הנייד שלכם למשך זמן רב עוד יותר לפני שתצטרכו לטעון אותו. החלום הוא להשתמש במתכת ליתיום, שיכולה לאגור הרבה חשמל. לרוע המזל, קשה מאוד לשלוט בליתיום, והוא יכול לגדל לחוטים שהופכים את הסוללה לבלתי בטוחה לשימוש. במחקרנו האחרון, חקרנו כיצד ליתיום גדל בתוך סוללות, וגילינו שאפשר לְאַלֵּף את הליתיום ולגרום לו להיות בטוח לשימוש בסוללות העתיד.
כיצד סוללה פועלת?
סוללות הן מכשירים אלקטרוניים קטנים שמספקים חשמל לכל דבר, החל מטלפונים ניידים ועד למכוניות חשמליות. סוללות משחררות חשמל על ידי המרת אנרגיה כימית מאוחסנת לאנרגיה חשמלית. בתוך הסוללה ישנן שתי אלקטרודות, שנקראות אָנוֹדָה וקָתוֹדָה, אשר מופרדות על ידי נוזל שנקרא אלקטרוֹליט. ישנם שני חלקיקים חשובים שמניעים את הסוללה, יונים ואלקטרונים. היונים, שיש להם מטען חיובי, יכולים לשחות דרך נוזל האלקטרוליט, אולם אלקטרונים, שטעונים שלילית, לא יכולים לשחות וצריכים לעבור דרך הכבלים כשהם נעים בין שתי האלקטרודות.
כפי שמוצג באיור 1, ישנן שתי דרכים “להפעיל” סוללה: טעינה (אגירת אנרגיה) ופריקה (שימוש באנרגיה האגורה). כשאתם טוענים את הסוללה בטלפון הנייד שלכם, אתם מספקים אנרגיה לסוללה שמפמפמת את האלקטרונים לתוך האנודה. שם, האלקטרונים יכולים להתחבר לבני הזוג היונים שלהם. כשאתם משתמשים בסוללה בטלפון הנייד שלכם, האלקטרונים רוצים למהר אל הקתודה. אנו קוראים לזרימת האלקטרונים הזו זרם. הזרם מנוהל על ידי מעגלים אלקטרוניים כדי לספק חשמל למכשירים כמו הטלפון הנייד שלכם. בסופו של דבר, הזרם נגמר והסוללה נפרקת. סוללות מסוימות יכולות להיטען מחדש על ידי אילוץ האלקטרונים חזרה אל האנודה. סוללת הליתיום היא הסוללה הנטענת הטובה ביותר, שנמצאת בשימוש הרב ביותר.
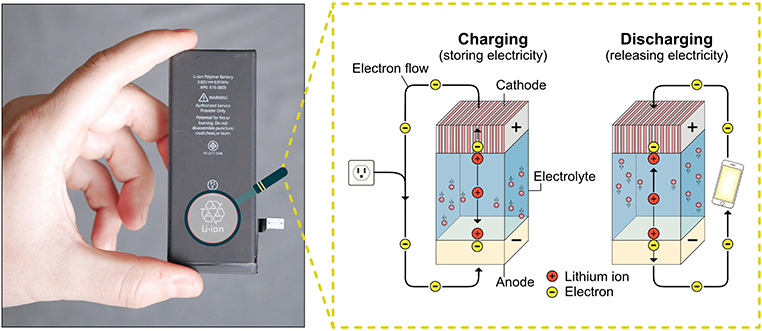
- איור 1 - סוללת ליתיום יון בטלפון נייד (משמאל) ותוך הסוללה (מימין).
- כאשר מתרחשת טעינה, אלקטרונים שליליים נעים על ידי מקור הכוח מהקתודה לאנודה. כאשר מתרחשת פריקה לצורך סיפוק חשמל לטלפון הנייד שלכם, אלקטרונים שליליים נעים באופן טבעי מהאנודה לקתודה. בשני המקרים, היונים החיוביים נעים באותו הכיוון כמו האלקטרונים השליליים, אולם שוחים דרך האלקטרוליט.
בניית סוללות לעתיד
כאשר המכשירים האלקטרוניים שלנו נעשים מתקדמים יותר, ה“תיאבון” שלהם לחשמל גדל. חוקרי סוללות ברחבי העולם עובדים קשה כדי ליצור סוללות חדשות ומשופרות. ישנם הרבה חלקים של הסוללה שאפשר לשפר, אולם המטרה החשובה ביותר היא להגדיל את כמות האנרגיה שאפשר לאחסן בה.
כדי להגדיל את יכולת אחסון האנרגיה של סוללות, אנו צריכים למצוא אלקטרודות טובות יותר. אלקטרודה אחת מבטיחה ביותר משתמשת ביסוד ליתיום. ליתיום הוא המתכת הקלה ביותר על פני כדור הארץ. היא גם ריאקטיבית מאוד, מה שאומר שהיא המתכת שמשחררת אלקטרונים הכי בקלות. זה גורם לליתיום להיות מושלם לסוללות ניידות. ליתיום היה בשימוש לראשונה בסוללה שהומצאה על ידי פרופסור וויטינגהאם בשנות 1970 [1]. לרוע המזל, קשה מאוד לשלוט בליתיום, והוא יכול לגרום לסוללה להתלקח. הפרופסורים יושינו [2] וגודאינף [3] שינו את האלקטרודות בסוללת הליתיום הראשונה כדי להפיק את הגרסה הבטוחה שאנו משתמשים בה כיום בחיי היומיום שלנו. ההישגים החשובים האלה זיכו את שלושת הפרופסורים בפרס נובל בכימיה בשנת 2019.
הבעיה של ליתיום
מדענים ברחבי העולם צריכים לעולם לא הרפו מהחלום להשתמש בליתיום לייצור סוללות טובות יותר. במשך כמעט 40 שנים, מדעני סוללות ניסו את כל הדרכים האפשריות להפוך ליתיום לבטוח יותר. הבעיה קשה מאוד, ועדיין לא מצאנו פתרון. אז, מדוע ליתיום לא בטוח? מאחר שהוא אוהב לגדול לחוטים בתוך הסוללה!
לאחרונה חקרנו את בעיית הליתיום הזו כדי למצוא דרך לשלוט באופן שבו הליתיום גדל [4]. התחלנו מחקירת האופן שבו חוטי ליתיום נוצרים על האנודה. איור 2 מראה את הגדילה של חוטי ליתיום. כאשר יון ליתיום חיובי פוגש באלקטרון שלילי, הם מגיבים ויוצרים אטום ליתיום נייטרלי (ללא מטען חשמלי) על פני השטח של האלקטרודה. יותר ויותר יונים פוגשים את בני הזוג האלקטרונים שלהם ויוצרים אטומים על פני השטח. באופן נורמלי, התהליך הזה מתרחש מהר מאוד, ולאטומי הליתיום החדשים שנוצרים יש זמן קצר מאוד לארגן את עצמם בשכבות שוות. במקום זאת, האטומים ייבנו זה על גבי זה ויגדלו כחוטים אל תוך האלקטרוליט. ליוני הליתיום יש כעת דרך קצרה יותר לשחות אל חוט הליתיום הגדל. החוטים ימשכו יונים קרובים ויגדלו מהר יותר משאר פני השטח של האלקטרודה. בסופו של דבר, חוטי הליתיום יגדלו ויהיו כל כך ארוכים שהם יתחברו לצד הנגדי של האלקטרודה. אלקטרונים יוכלו כעת לנוע לאורך החוט במקום לעשות מעקף ברחבי הסוללה (דרך המעגלים האלקטרוניים של המכשיר), כדי להגיע לאלקטרודה של הליתיום. הדרך הקצרה יותר הזו נקראת קֶצֶר, והיא גורמת לסוללה להיות בלתי בטוחה.
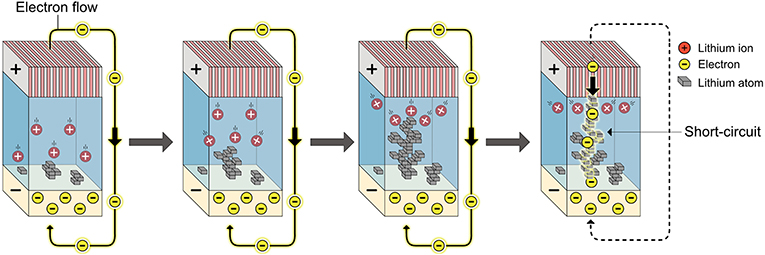
- איור 2 - כאשר יונים ואלקטרונים של ליתיום נפגשים ומגיבים באופן בלתי נשלט, אטומי ליתיום נוצרים והם נערמים זה על גבי זה, ויוצרים חוטי ליתיום.
- כאשר חוט ליתיום מחבר את שתי האלקטרודות בתוך סוללה, זה יוצר דרך קצרה יותר עבור האלקטרונים. האלקטרונים ממהרים מהקתודה לאנודה דרך החוט, במה שנקרא קֶצֶר. זה מסוכן מאחר שהחוטים מתחממים ויכולים להעלות באש את האלקטרוליט.
כיצד אפשר למנוע את הבעיה המסוכנת הזו? חקרנו זאת על ידי התבוננות באלקטרודות ליתיום בתוך הסוללה [4]. הסוללה נטענה תחילה כדי לגדל אטומי ליתיום חדשים על פני השטח של האנודה. לאחר מכן, פתחנו את הסוללה והסרנו את אלקטרודת הליתיום. הסתכלנו על פני השטח של האלקטרודה עם מיקרוסקופ אלקטרונים מיוחד שיכול לראות פריטים קטנים בגודל של כמה אטומים. לאחר מכן, שינינו את הרכיבים שבסוללה ואת האופן שבו החשמל הוזן לסוללה במהלך הטעינה. מצאנו שלושה גורמים עיקריים שמשפיעים על האופן שבו הליתיום גדל (איור 3).
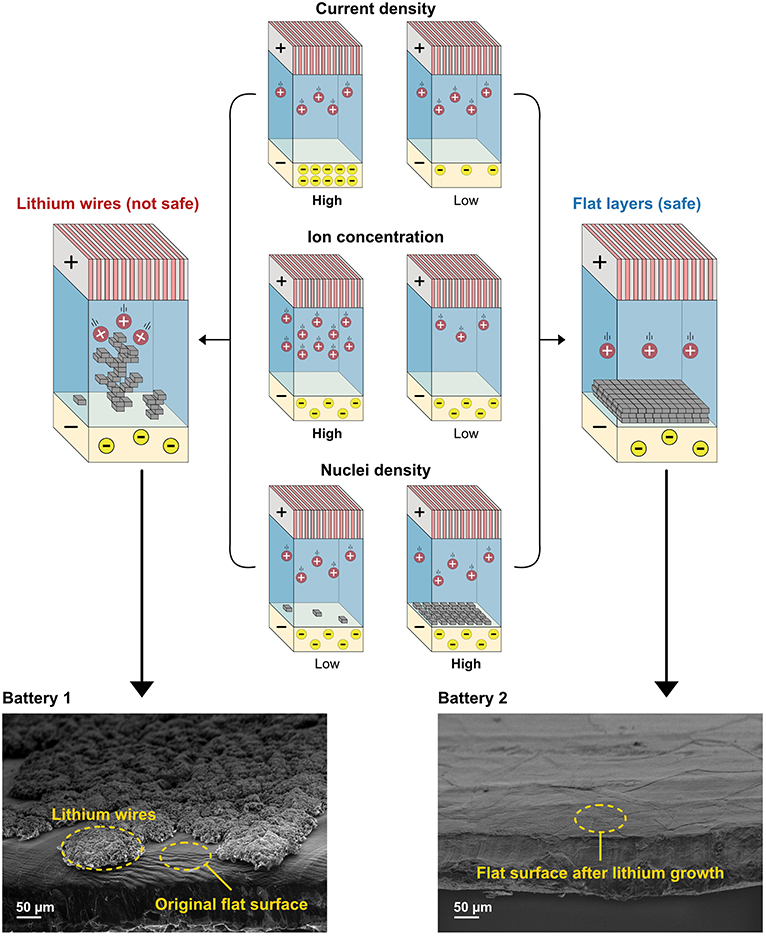
- איור 3 - צפיפות זרם, ריכוז יונים וצפיפות גרעינים כולם שולטים באופן שבו ליתיום גדל בסוללה.
- כאשר צפיפות הזרם וריכוז היונים גבוהים, ומספר “חניות” הגרעינים נמוך, נוצרים חוטים. אולם כאשר ישנם הרבה מקומות חנייה, וצפיפות הזרם וריכוז היונים נמוכים, נוצרות שכבות שטוחות ובטוחות יותר. בתחתית האיור אתם יכולים לראות את התמונות ממיקרוסקופ האלקטרונים של פני השטח של הליתיום מהסוללה הראשונה והשניה,2, אשר מראות הבדלים בהיווצרות חוט הליתיום בשני התנאים האלה.
הקטנת זרימת האלקטרונים
הגורם הראשון שמשפיע על גדילת חוטי הליתיום הוא צפיפות הזרם, שהוא זרימה של אלקטרונים דרך הסוללה. צפיפות זרם גדולה משמעותה שהרבה אלקטרונים נעים בין האלקטרודות באותו הזמן. כאשר מספר אלקטרונים נעים, הזרם נמוך. הזרם הוא כמו תחבורה בעיר. בלי מגבלות מהירות, האלקטרונים ימהרו לאלקטרודה ויתפסו כל יון בן זוג שמתקרב לפני השטח של האלקטרודה. עם הזרם הגבוה הזה, זוגות האלקטרון-יון ינחתו בכל מקום שהם יכולים. אם במקום זאת נוסיף מגבלות מהירות לסוללה, צפיפות הזרם תהיה נמוכה. משמעות הדבר היא שיהיו פחות אלקטרונים על פני השטח של האלקטרודה. לאלקטרונים יש כעת זמן לנוע ברחבי הסוללה ולמצוא נקודה נוחה שבה הם יכולים לתפוס יון וליצור אטום ליתיום. צפיפות זרם נמוכה נותנת יותר זמן לאטומי הליתיום להתמקם ולהתארגן בתבנית מסודרת. זה אומר שאנו יכולים לסייע לליתיום לגדול לשכבות במקום לחוטים, באמצעות הוספת מגבלות מהירות לאלקטרונים. שכבות ליתיום גורמות לסוללה להיות בטוחה לשימוש, מאחר שחוטים לא יכולים לגדול בין האנודה לבין הקתודה ולגרום לקֶצֶר מסוכן.
הפחתת יוני ליתיום באלקטרוליט
הגורם השני שמשפיע על גדילת חוטי ליתיום הוא ריכוז היונים באלקטרוליט. ריכוז גבוה משמעותו יותר יונים באלקטרוליט. כאשר האלקטרוליט מלא ביונים, הם ישחו סביב ויחפשו אלקטרונים להגיב איתם. כפי שראינו עם האלקטרונים, ההתנהגות הזו גורמת לאטומים לגדול מהר זה על גבי זה, וליצור חוטים. אם במקום זאת נקטין את ריכוז היונים, אז פחות יונים ישחו סביב, מה שיתן להם זמן למצוא נקודה טובה על פני השטח של האלקטרודה. חשוב להבין שכאשר מנמיכים את ריכוז היונים, איננו משנים את האנרגיה שאגורה בסוללה. האנרגיה בסוללה תלויה בכמות הליתיום שיש לנו באלקטרודות, ולא באלקטרוליט, מה שאומר שאנו יכולים לשנות את ריכוז היונים כדי לשלוט בכמות היונים שיעברו באותו הזמן, בלי להחליש את הסוללה.
הגדלת מספר “מקומות החנייה”
הגורם השלישי שמשפיע על גדילת חוטי ליתיום הוא צפיפות הגרעינים על פני השטח של האלקטרודה. גרעינים הם איים קטנים של אטומים שפועלים כנקודות שבהן גדילת ליתיום יכולה להתרחש. גרעינים הם כמו מקומות חנייה לאטומים. צפיפות גרעינים נמוכה משמעותה שישנו מספר קטן של מקומות חנייה, מה שמאלץ את אטומי הליתיום להיערם זה על גבי זה. אם נגדיל את צפיפות הגרעינים ונציע עוד מקומות חנייה, אז אטומי הליתיום יכולים למצוא כולם מקום ולארגן את עצמם בצורה מסודרת. צפיפות גרעינים גבוהה יכולה לסייע לאטומים לגדול בשכבות, במקום בחוטים.
סוללת הבוחן שלנו
במחקרנו, התמקדנו בשינוי ריכוז היונים וצפיפות הגרעינים כדי לראות אם נוכל להפחית את היווצרותם של חוטי ליתיום. בנינו שתי סוללות דומות. סוללה אחת הכילה ריכוז יונים גבוה וצפיפות גרעינים נמוכה. סוללה שנייה הכילה ריכוז יונים נמוך וצפיפות גרעינים גבוהה. שתי הסוללות נטענו ונפרקו. לאחר מכן, פרקנו את הסוללות והסתכלנו על הליתיום שעל פני השטח של האנודה. באיור 3, אנו מראים את התמונות שצולמו באמצעות מיקרוסקופ האלקטרונים, כך שתוכלו לראות כיצד נראו פני השטח של הסוללות האלה. האלקטרודה מהסוללה הראשונהכוסתה ברשת של חוטי ליתיום, שהם קטנים פי כמעט 1,000 מחוט השערה. לאלקטרודה מהסוללה השנייה היו פני שטח חלקים מאוד. משמעות הדבר היא שהליתיום גדל בשכבות.
המתכון שלנו לסוללת ליתיום בטוחה
במטרה לְאַלֵּף ליתיום ליצור סוללות בטוחות, אנו צריכים להאט את גדילת חוטי הליתיום. אפשר לעשות זאת על ידי הפחתת כמות האלקטרונים והיונים שנעים בסוללה באותו הזמן. ליתיום גם יגדל באופן נשלט יותר לצורת שכבות אם נוסיף הרבה גרעינים לפני השטח של האלקטרודה. עם האסטרטגיה החדשה שלנו, פני השטח של האלקטרודה חלקים מאוד ומראים מעט מאוד חוטים. ללא האסטרטגיה שלנו, פני השטח של הליתיום כוסו לגמרי על ידי החוטים. זה מוכיח שאפשר לשלוט באלקטרודות של הליתיום, וזו תגלית חדשה מרגשת ביותר. אנו מקווים שהידע החדש יסייע לחוקרי סוללות לפתח סוללות חדשות ומשופרות. מטרתנו היא שהדור הבא של הסוללות יאגור יותר אנרגיה כך שהן יוכלו לספק חשמל לטלפון הנייד שלכם או למכוניתכם לפרק זמן אפילו ארוך יותר, לפני שתצטרכו לטעון אותם שוב.
מילון מונחים
אלקטרודות (Electrodes): ↑ חומר קשיח שמאחסן יונים על ידי קשירתם לאלקטרונים. באלקטרודה, הזרם החשמלי מוּלך על ידי אלקטרונים נעים.
אנודה (Anode): ↑ אחת האלקטרודות בסוללה, שנמצאת בקוטב הטעון שלילית. כאן, יונים ואלקטרונים משוחררים במהלך הפריקה.
קתודה (Cathode): ↑ אחת האלקטרודות בסוללה, שנמצאת בקוטב הטעון חיובית. כאן, יונים ואלקטרונים נספגים ומאוחסנים במהלך הטעינה.
אלקטרוליט (Electrolyte): ↑ נוזל שמכיל מלח שמומס בממס, כמו למשל מלח שולחן בתוך מים. האלקטרוליט יכול להוליך זרם חשמלי על ידי הנעת יונים.
יון (Ion): ↑ אטום או קבוצת אטומים עם מטען חשמלי שהוא חיובי או שלילי. ליונים של ליתיום יש מטען חשמלי חיובי.
אלקטרון (Electron): ↑ אלקטרונים אפילו קטנים יותר מאטומים, ויש להם מטען חשמלי שלילי.
זרם (Current): ↑ כשאלקטרונים נעים בכיוון אחד, זרימת האלקטרונים הזו נקראת זרם. כאשר אתם מחלקים את הזרם בגודל האלקטרודה, זה נקרא צפיפות זרם. הזרם הוא הכוח המניע של כל המכשירים האלקטרוניים, כמו למשל הטלפון הנייד שלכם.
אטום (Atom): ↑ חלקיק קטן מאוד ללא מטען חשמלי. אטומים הם אבני הבניין הבסיסיות של כל החומר ביקום.
הצהרת ניגוד אינטרסים
DR הוא הממציא של פטנט מוגש שכותרתו “An electrochemical device and method for charging the electro-chemical device”
הַמְּחַבֶרֶּת הנותרת מצהירה כי המחקר נערך בהיעדר כל קשר מסחרי או כלכלי שיכול להתפרשׁ כניגוד אינטרסים פוטנציאלי
מאמר המקור
↑ Rehnlund, D., Ihrfors, C., Maibach, J., and Nyholm, L. 2018. Dendrite-free lithium electrode cycling via controlled nucleation in low LiPF6 concentration electrolytes. Mater. Today 21:1010–8. doi: 10.1016/j.mattod.2018.08.003
מקורות
[1] ↑ Whittingham, M. S. 1976. Electrical energy storage and intercalation chemistry. Science 192:1126–7. doi: 10.1126/science.192.4244.1126
[2] ↑ Yoshino, A. 2012. The birth of the lithium-ion battery. Angew. Chem. Int. Ed. 51:5798–800. doi: 10.1002/anie.201105006
[3] ↑ Mizushima, K., Jones, P. C., Wiseman, P. J., and Goodenough, J. B. 1980. LixCoO2 (0 < x < -1): a new cathode material for batteries of high energy density. Mater. Res. Bull. 15:783–9. doi: 10.1016/0025-5408(80)90012-4
[4] ↑ Rehnlund, D., Ihrfors, C., Maibach, J., and Nyholm, L. 2018. Dendrite-free lithium electrode cycling via controlled nucleation in low LiPF6 concentration electrolytes. Mater. Today 21:1010–8. doi: 10.1016/j.mattod.2018.08.003
