תַקצִיר
פצעי עור קטנים בקרב אנשים בריאים מחלימים ונסגרים בעצמם, אולם לצורך החלמה של פצעים גדולים ועקשניים יותר יש להזדקק לעיתים לטיפול רפואי. באופן טיפוסי, משתמשים בתפרים כדי לסגור פצעים ולהחזיק יחד רקמות שונות. אומנם השיטות והחומרים שמשמשים לסגירת פצעים השתפרו לאורך השנים, אך הבעיה שעדיין נותרה בשימוש בהם היא צלקות. כדי למנוע צלקות, יוצרו מגוון חומרי דמויי-דבק, שנקראים דבקי רקמות, במטרה להחזיק יחד רקמות ולמלא חללים גדולים יותר ביניהן. החיסרון בדבקים אלה הוא שהם לא חזקים מספיק ומתקשים מהר, מה שמונע את השימוש בהם במקרים שבהם הנראוּת של הפצע המרופא חשובה. במטרה להשיג שליטה רבה יותר בתהליך החיבור בין רקמות, פותחו שיטות מתווכות אור שנקראות “פוטובונדינג” (photobonding).
הגוף הוא מערכת מורכבת שמאפשרת לנו לנוע ולבצע את כל הפעילויות היומיומיות שלנו, אפילו אלה שאיננו מודעים אליהן כמו נשימה, מצמוץ, בליעה ושמירה על פעימות הלב. גופנו גם מצויד באלמנטים ובאסטרטגיות להתמודד עם מיקרובים, להגן עלינו מפני קרינת אור השמש ולאפשר לנו לבצע סוגים שונים של תנועות. הגוף האנושי מסוגל לשקם את עצמו במידה מסוימת כאשר תאים ורקמות נפגעים. אולם כאשר הנזק גובר על יכולתו של הגוף לרפא את עצמו, אנו מגיעים למצבי מחלות או לתנאים בריאותיים שדורשים השגחה וטיפול רפואי. במקרים רבים, נדרש לבצע חתכים בגוף כדי למצוא את מה שלא פועל כשורה ולשקם אותו. לאחר השלמת תהליך החיתוך צריך לסגור את הפצע – בידי הרופאים יש אומנם אפשרויות שונות כתלות בסוג הפצע ובגודלו, אך הבחירה עדיין מוגבלת. חתכים קטנים לרוב נרפאים מהר, בתוך 10-8 ימים [1], בעוד שמשך החלמתם של חתכים עמוקים וגדולים יותר עשוי לנוע בין כמה שבועות לכמה חודשים [2].
מהן השיטות הקיימות לסגירת פצעים?
ניתן לסווג את השיטות לסגירת פצעים לקיבוע מכני (תפרים או סיכות), ולדבקי רקמות (פיברין, BioGlue) (איור 1). כפי שאתם עשויים לצפות, ההליכים השכיחים ביותר לסגירת פצעים מתבצעים באמצעות תפרים – בדומה לשריכת הנעליים שלכם. תפרים היו בשימוש במשך מאות שנים מאחר שהם חזקים וזולים [3]. אך ישנם דברים רבים שקשורים לשימוש בתפרים שאינם חיוביים כמו התפתחות דלקת, זיהומים והצורך בביצוע הפעולה על ידי רופא מיומן. מסיבות אלה אין זה נדיר שאחרי ביצוע תפרים צריך לפתוח מחדש פצעים, או להישאר עם צלקות [3, 4].
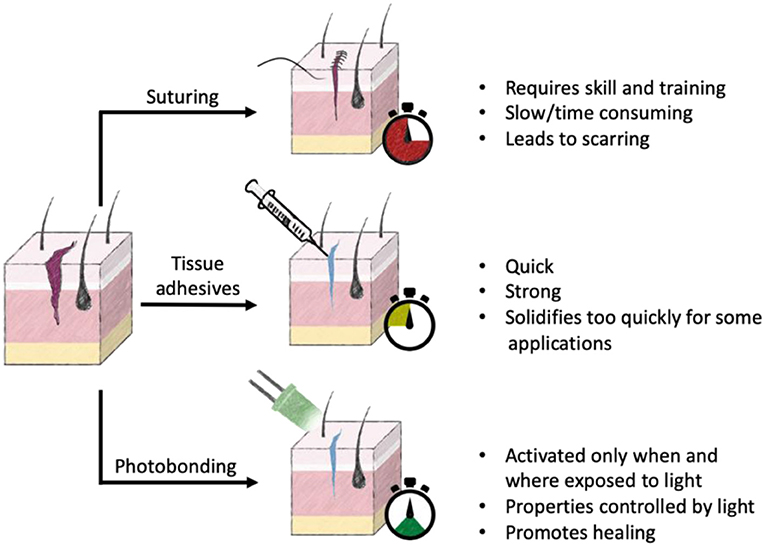
- איור 1 - אפשרויות שזמינות כיום עבור סגירת פצע וריפויו כוללות תפרים, דבקי רקמות ופוטובונדינג.
- לכל שיטה יש יתרונות וחסרונות ייחודיים. שעון העצר מדגיש את הזמן היחסי עד לסגירת הפצע באמצעות שימוש בשיטה המסוימת. תפרים: דורשים רופא מיומן, דורשים זמן לביצועם, מובילים לצלקות. דבקי רקמות: מהירים, חזקים, מתקשים מהר מדי עבור חלק מהפרוצדורות. פוטובונדינג: פועל רק כאשר נחשף לאור, מקדם החלמה.
חלופה אחת שמנסה להימנע מהבעיות הכרוכות בתפרים היא דבקי רקמות. דבקים אלה פועלים ממש כמו הדבק שאתם משתמשים בו כדי להדביק יחד שתי פיסות נייר. לרוע המזל, דבקי רקמות לא מספקים את הקשר הראשוני החזק ביותר וכן מתקשים מהר, מה שמגביל את השימוש בהם [3].
לאחרונה, פותחו אפשרויות חדשות שמשתמשות באור כדי להפעיל חומרים לסגירת פצעים. היתרון העיקרי בכך הוא שקל יחסית לשלוט בזמן ובמיקום שבו הרקמה חשופה לאור. ישנן כמה שיטות מתווכות אור לסגירת פצעים, חלקן משתמשות בלייזרים ואחרות משתמשות בכימיקלים. בשימוש בלייזרים, האנרגיה מהלייזר מחממת את הצומת של הרקמות הפצועות. בשל הטמפרטורה הגבוהה, האזור מתרכך, כמעט “נמס”, ואחרי שהוא מתקרר הפצע נסגר. אף על פי שזה נשמע מגניב (ואולי מפחיד) וקל לביצוע, ישנן גם השלכות שליליות אפשריות כמו רקמות פגועות ומתות, צילוק מוגבר וכמו כן הקשר המתקבל בין הרקמות הוא חלש [5–3]. בהתחשב בחסרונות של ריפוי פצעים באמצעות לייזרים, מאמר זה יתמקד בשיטות הפוטובונדינג הנוספות, מאחר שהן מציעות יתרונות על פני שיטות אחרות, ועשויות לייצג את עתיד ריפוי הפצעים.
כיצד פועלת טכניקת ריפוי פצעים באמצעות אור?
אם יש לנו פצע, האם אנו יכולים פשוט להאיר מעליו באור ולחכות עד שהוא ייסגר? זה לא עד כדי כך פשוט, אבל זה מאוד מעניין. נתחיל עם תיאור קצר של מהו אור. מתברר שהמונח “אור” מצביע לא רק על בהירות אלא גם על אנרגיה. אור הוא סוג של אנרגיה שנקראת קרינה אלקטרומגנטית (איור 2), והוא מכיל חבילות קטנות של אנרגיה, שנקראות פוֹטוֹנים, אשר “מטיילות” בתור גלים ומעבירות אנרגיה מחומר אחד לאחר [6]. הסוגים השונים של קרינה אלקטרומגנטית מסווגים כתלות באורך הגלים שלהם ובתדירותם. המונח “אורך גל” משמש כדי לבטא כמה הגלים ארוכים או קצרים, בעוד שתדירות מתייחסת לכמה גלים עוברים בפרק זמן מסוים. בני אדם יכולים לראות אורכי גל מסוימים, וזה מה שאנו בדרך כלל מכנים אור [7]. סוג הקרינה הזה ממוקם במרכז הספקטרום האלקטרומגנטי, והוא נקרא אזור האור הנראה. ייתכן שאתם גם מכירים אור אולטרה-סגול (UV), שהוא בעל אנרגיה גבוהה יותר מאור נראה, ובמינונים גדולים הוא עלול לגרום לנזק לרקמה.
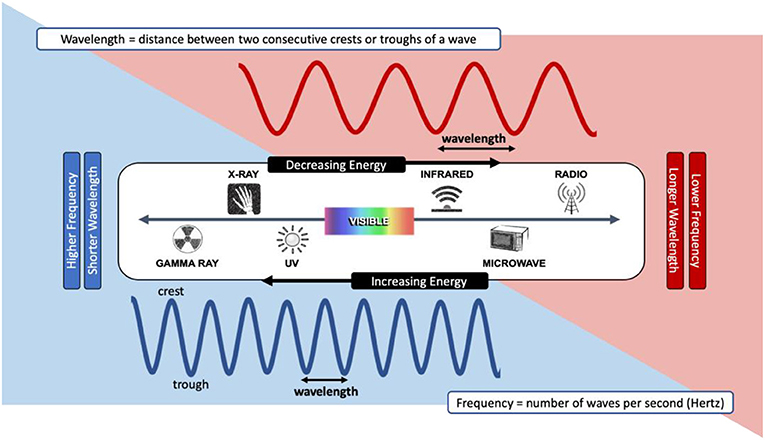
- איור 2 - ספקטרום הקרינה האלקטרומגנטית.
- הספקטרום כולל סוגים שונים של קרינה, אל חלקם אנו חשופים בכל יום. קרינה אלקטרומגנטית מתקיימת בצורת גלים, ולכל סוג יש אורך גל ותדירות ייחודיים. לסוגי הקרינה משמאל יש יותר אנרגיה מאלה שמימין. אור נראה, שהוא האור שאנו רואים, אשר יכול לשמש לפוטובונדינג, נמצא ממש במרכז הספקטרום.
הקידומת “פוטו” בתחילת מילה בדרך כלל מלמדת שהמושג קשור לאור. לדוגמה, פוטוכימיה היא חֵקֶר של תגובות כימיות בין אור לבין מולקולות. לכן, כשאנו דנים בפוטובונדינג של פצעים, אנו מתייחסים לתהליכים שבהם חיבור שני צדדים של רקמה פצועה מתבצע על ידי תגובות כימיות שמאותחלות על ידי אור.
באיזה סוג אור משתמשים?
עבור פוטובונדינג ניתן להשתמש בכמה מקורות אור. אור שמש טבעי או אור יום קשים לשליטה, ולכן נדיר שהם ישמשו כמקור אור לתגובות פוטוכימיות. בדרך כלל נמצאים בשימוש מכשירים שפולטים אור מאזורים שונים של הספקטרום האלקטרומגנטי לרבות מנורות קסנון, לייזרים ודיודות פולטות אור (LEDs). המכשירים האלה מאפשרים לאורך הגל ולעוצמה של האור להיבחר בקלות [6].
פוטוסנסיטייזרים מסייעים לרקמות פצועות להתחבר יחד
המולקולות שאנו רוצים להדביק יחד בשיקום פצע נקראות מולקולות המטרה. שיטות מתווכות לייזר לעיתים קרובות משתמשות במולקולות מטרה שממוקמות בתוך התאים של הרקמה הפצועה. בפוטובונדינג, מולקולת המטרה העיקרית לחיבור רקמה היא חלבון שנקרא קולגן. זהו חלבון שכיח שנמצא מחוץ לתאים, בחומר שנקרא מטריצה חוץ-תאית, שמספק לתאים תמיכה מבנית ומסייע להם להתארגן בצורת רקמות.
לעיתים, מולקולות המטרה לא סופגות אור באורכי גל מסוימים, או שאי אפשר להפעיל אותן ישירות על ידי אור כדי לייצר תגובות פוטוכימיות מתאימות. במקרים האלה, שימוש בחומר שנקרא פוטוסנסיטייזר יכול לסייע, מאחר שפוטוסנסיטייזרים יכולים לספוג אור באורכי גל מסוימים. כאשר הם נדרשים, פוטוסנסיטייזרים משמשים לציפוי מולקולות המטרה. ברגע שהם שם, הם סופגים את האנרגיה ממקור האור ואז התגובות הפוטוכימיות יכולות להתרחש כדי לחבר יחד את הרקמות הפצועות [6]. אנו יכולים לחשוב על פוטוסנסיטייזר בתור זרועות שיכולות לסייע לקרב את שני צידי הרקמה הפצועה זה אל זה.
מה קורה במהלך פוטובונדינג של רקמות?
ראשית, שׂמים תמיסה של פוטוסנסיטייזר על קצוות הרקמות שרוצים לחבר ביניהן, או שׂמים תערובת של מולקולות מילוי ופוטוסנסיטייזר על הרווח שבין הרקמות. שני צידי הרקמה הפצועה מובאים קרוב זה אל זה, ואז מפעילים את האור על האזור כדי לספק את האנרגיה הדרושה להפעלת הפוטוסנסינטייזר [3]. הפוטוסנסיטייזר סופג את אנרגיית האור הזו ומעביר אותה הלאה למולקולות מטרה, כמו קולגן [6]. לאחר מכן, למולקולות המטרה יש מספיק אנרגיה כדי להתחיל את התגובה שמחברת אותן יחד באופן בטוח על פני השטח של הרקמה [6].
יישומים שונים של פוטובונדינג
שימוש בפוטובונדינג עדיין אינו שכיח בקליניקות. אולם מגוון מחקרים מדעיים שהשתמשו ברקמות שיוצרו במעבדה, בחיות מעבדה, או בבני אדם הראו שניתן לתקן בהצלחה כמה רקמות באמצעות שיטה זו. חלק מהרקמות שנבדקו היו עור, רשתית, כלי דם, עצבים פריפריאליים, מיתרי קול, מיניסקוס וגידים [5]. בעוד שישנם סוגים שונים רבים של דבקים שמופעלים על ידי אור, מרביתם פועלים על קולגן ברקמה המודבקת. אך לא כל הרקמות זהות, ומשום כך יכולים להיות אתגרים ייחודיים תלויי-רקמה שיש להתגבר עליהם כדי לחבר בהצלחה את הרקמה באמצעות אור.
מדוע טכנולוגית פוטובונדינג אינה שכיחה?
לשימוש באור למטרת ריפוי פצעים יש כמה יתרונות בהשוואה לתפרים לרבות הפחתת דלקת והפחתת צילוק של רקמות [4, 8]. טכנולוגיות פוטובונדינגיוצרות מייד סגירה מהודקת, מה שמסייע להאיץ את הריפוי. טכנולוגיות אלה שימושיות במיוחד לסגירה של רקמות עדינות, שקשה לסגור באמצעות תפרים, ולמקרים שבהם ישנם רווחים גדולים בין הרקמות [4].
עם יתרונות רבים כל כך, מדוע השיטות האלה אינן הנורמה כיום? לפני ששיטות פוטובונדינג לסגירת פצעים יוכלו להפוך פופולריות יותר, הן צריכות להיות נגישות יותר, פחות יקרות, ואמינוֹת באותה המידה כמו תפרים, בכל היישומים. בעוד שמולקולות סופגות אור של הדבקים האלה זולות יחסית, רכיבים אחרים, כמו למשל מולקולות מטרה, עשויים להיות יקרים. כשהשיטות להכנת הרכיבים היקרים האלה ישתפרו, מחירם ירד. כמו כן לפני שניתן לייצר מוצרים, לשווקם ולהשתמש בהם, נדרשים מבדקים נוספים כדי לוודא את בטיחותן של השיטות החדשות.
לסיכום, השיטה האידיאלית לחיבור רקמות צריכה להיות פשוטה, בטוחה, חזקה ומהירה. יתרה מזו, עדיף שתהיה לא יקרה, נטולת כאבים ולהוביל לפצע מרופא בעל נראוּת טובה. כמה שיטות פוטובונדינג עומדות במרבית הדרישות האלה, אך נדרשת עוד עבודה כדי שהשימוש בהן יגדל והן יהפכו לטיפול האידיאלי עבור פצעים אנושיים בעתיד.
מילון מונחים
פוטובונדינג (Photobonding): ↑ תהליך שבו חיבור של שני צידי רקמה פצועה מבוצע על ידי תגובות כימיות שמאותחלות על ידי אור.
קרינה אלקטרומגנטית (Electromagnetic Radiation): ↑ סוג של אנרגיה שמסווגת בהתאם לכמה הגלים שלה ארוכים ותכופים.
אור נראה (Visible Light): ↑ האור שאנו יכולים לראות באמצעות העיניים שלנו.
מולקולות מטרה (Target Molecules): ↑ מולקולות בעלות עניין בתהליך הפוטובונדינג. הן מופעלות על מנת שיידבקו יחד.
קולגן (Collagen): ↑ חלבון שכיח שנמצא כמספק תמיכה ומבנה למרבית הרקמות.
מטריצה חוץ-תאית (Extracellular Matrix): ↑ חומר שמספק תמיכה לתאים בסביבתם, ומסייע להם להתארגן בצורת רקמה.
פוטוסנסיטייזר (Photosensitizer): ↑ מולקולות שסופגות אור באורכי גל מסוימים, וממירות אותו לאנרגיה פיזיקלית וכימית.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
המחברים רוצים להודות על תמיכתן של סוכנויות המימון הקנדיות NSERC, CIHR, NFRF; המשרד לפיתוח כלכלה, יצירת עבודה ומסחר, ופרס Early Researcher Award, כמו גם למכון הלב של אוניברסיטת אוטאווה. EA רוצה להודות לדוקטור Irnen Kochevar מבית הספר לרפואה של הרווארד עבור החונכות שלה בתחום פוטובונדינג של רקמות.
מקורות
[1] ↑ Sorg, H., Tilkorn, D. J., Hager, S., Hauser, J., and Mirastschijski, U. 2017. Skin wound healing: an update on the current knowledge and concepts. Eur. Surg. Res. 58:81–94. doi: 10.1159/000454919
[2] ↑ Cañedo-Dorantes, L., and Cañedo-Ayala, M. 2019. Skin acute wound healing: a comprehensive review. Int. J. Inflam. 2019:3706315. doi: 10.1155/2019/3706315
[3] ↑ Ark, M., Cosman, P. H., Boughton, P., and Dunstan, C. R. 2016. Review: photochemical tissue bonding (PTB) methods for sutureless tissue adhesion. Int. J. Adhes. Adhes. 71:87–98. doi: 10.1016/j.ijadhadh.2016.08.006
[4] ↑ Kochevar, I. E., and Redmond, R. W. 2014. “Tissue repair by photochemical cross-linking,” in Handbook of Photomedicine, eds M. R. Hamblin and Y. Y. Huang (Boca Raton, FL: Taylor & Francis Group CRC Press). p. 771–83.
[5] ↑ Frost, S. J., Mawad, D., Hook, J., and Lauto, A. 2016. Micro- and nanostructured biomaterials for sutureless tissue repair. Adv. Healthc. Mater. 5:401–14. doi: 10.1002/adhm.201500589
[6] ↑ Chan, B. P. 2010. Biomedical applications of photochemistry. Tissue Eng. B Rev. 16:509–22. doi: 10.1089/ten.TEB.2009.0797
[7] ↑ Elliott, D. A., Nabavizadeh, N., Seung, S. K., Hansen, E. K., and Holland, J. M. 2018. “13–Radiation therapy,“ in Oral, Head and Neck Oncology and Reconstructive Surgery, eds R. B. Bell, R. P. Fernandes, and P. E. Andersen (St. Louis, MO: Elsevier). p. 268–90.
[8] ↑ Wynn, T. A. 2008. Cellular and molecular mechanisms of fibrosis. J. Pathol. 214:199–210. doi: 10.1002/path.2277

