תַקצִיר
מחקר של מחלות אנושיוֹת ובחינת תרופות חדשות דורשים מספר גדול של תאים אנושיים. כדי להשיג מספיק תאים מדענים מאלצים תאים להתרבּוֹת (להתחלק) ולייצר תאים נוספים, או שהם בוחרים רק תאים בעלי יכולת להתרבּוֹת ללא גבול. אולם התאים שיכולים להתרבות בלי לעצור, לעיתים קרובות מאבדים את התכונות שלהם ומתחילים להשתנות ולהתנהג אחרת מהתאים המקוריים שבגוף האדם. אנו פיתחנו כלי שמאפשר לנו להדליק את מנגנון ההתרבות התאית ולכבותו לפי הצורך, ולחקור כיצד זה משפיע על תפקוד התאים. באמצעות שימוש בכלי זה ראינו כי תאים של כלי דם שמתרבים במהירוּת אינם יוצרים כלים יעילים כמו אלה שמייצרים תאים שאינם מתרבים במהירוּת. למדנו גם כיצד לייצר במעבדה מספיק תאים תוך שימור התפקוד הרגיל של כל תא.
מתא בודד לגוף שלם
גוף האדם מורכב ממיליארדי אבני בניין קטנטנות שנקראות תאים. לא כל התאים בגוף הם זהים. תאים שמרכיבים את העור שונים מהתאים שבעיניים, למשל בגודל שלהם, בצורה שלהם, באופן שבו הם מחוברים זה לזה ובאופן שבו הם מְתַקְשְׁרִים עם תאים אחרים. ישנם כ-200 סוגי תאים שונים בגוף האדם! וכל סוג תא מיועד לתפקד בצורה מסוימת.
זה מדהים שגוף האדם כולו מתפתח מתא בודד – הביצית הַמֻּפְרֵית. יצירת הגוף מתא בודד היא תהליך מורכב אשר דורש מהתא להתחלק פעמים רבּות, וגם דורש התמחוּת של התאים אשר מאפשרת להם לבצע את התפקידים המסוימים שלהם. הגדלת מספר התאים מושׂגת בתהליך שמְכֻנֶּה הִתְרַבּוּת תאית, שבּו תא אחד מתחלק כדי לייצר שני תאים זהים שנקראים “תָּאֵי בַּת”. התמחוּת תאית דורשת תהליך אחר שנקרא התמיינוּת תאים. במהלך ההתמיינות, תאי בת מתחילים להשתנוֹת ביחס לתאי הָאָב, ונעשים מתאימים יותר לתפקוד מסוים.
אם תסתכלו מקרוב על הגוף שלכם תִּראו שהוא מורכב בעיקר מִתָּאִים ממוינים בעלי תפקודים מסוימים. העור שלכם, הכבד, הלב והשרירים מכילים בעיקר תאים מסוגים ממוינים לחלוטין. אולם מרבית התאים באיברים האלה אינם מתרבים כלל. אם כן, מהיכן מגיע המספר הרב הזה של תאים ממוינים? תאים ממוינים הם צאצאים של מה שמכֻנה “תא אָב”. תאי אב מתחלקים בקלוּת, ויכולים לייצר תאי בת שמסוגלים להתחלק לתת-קבוצה של סוגי תאים שונים, אולם תאי האב עצמם אינם מתפתחים מספיק כדי למלא תפקיד מסוים. תאי אב, בְּתוֹרָם, מגיעים מִתָּאִים בלתי ממוינים כלל שנקראים “תאֵי גזע”. תאי גזע יכולים להתחלק ללא גבול אולם חסרות להם יכולות מסוימות שיאפשרו להם לבצע את העבודות שצריכות להתבצע בגוף. מתאי הגזע מתפתחות כל הרקמות בגוף, ואפשר למצוא אותם בעיקר בשלבי ההתפתחות הראשונים של הגוף. אולם אפשר לְאַתֵּר מספר מצומצם של תאי גזע באיברים של אדם בוגר. אצל מבוגרים, תאי גזע מְשַּׁמְּשִׁים בעיקר כ“מערכת תיקון” אשר מחליפה תאים שניזוקו. גוף האדם מתפתח מתאי גזע שמייצרים תאי אב, אשר גורמים להיווצרותם של תאים ממוינים לחלוטין. לאורך הדרך תאים רוכשים יכולות נוספות, אך מאבדים את יכולתם להתרבּוֹת. במובן מסוים, התמיינות ותפקודים תאיים מנוגדים זה לזה במהלך ההתפתחות (איור 1A).
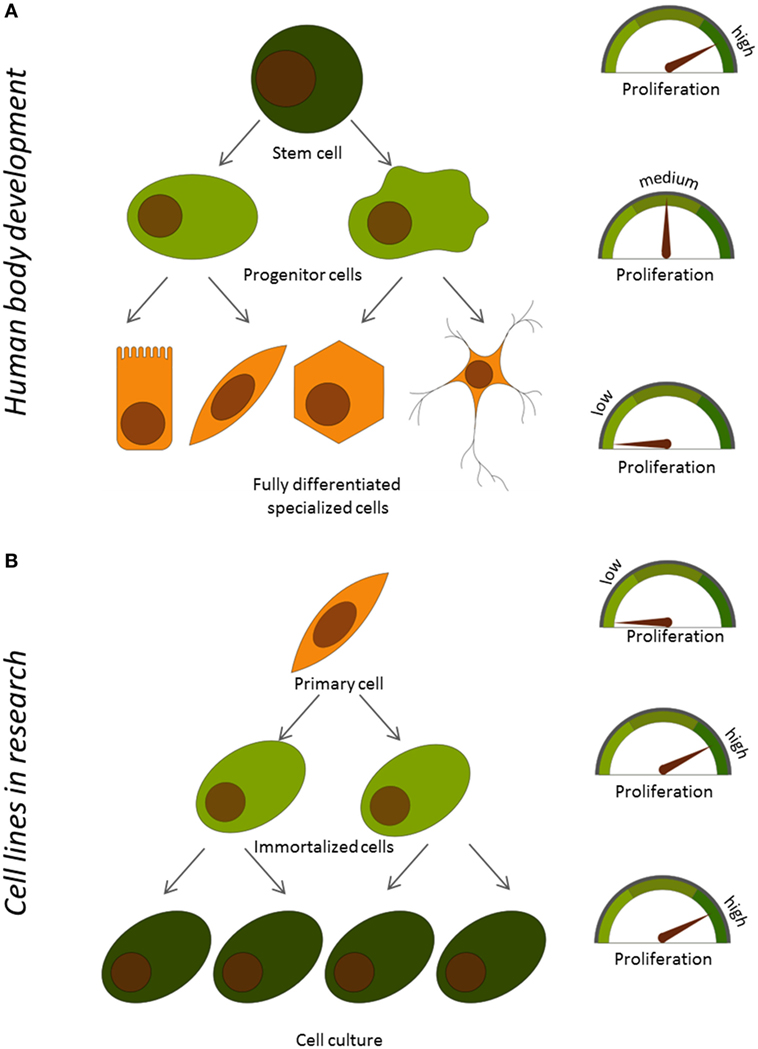
- איור 1 - הַקֶּשֶׁר בין הִתְרַבּוּת (A) תאים ותפקודם במהלך ההתפתחות של גוף האדם, (B) בתאים ראשוניים ותאים שמתרבים במעבדה ללא גבול.
- Proliferation = התרבות Stem cell = תא גזע Progenitor cell = תא אב
תאים של כלי דם והדרך לחקור אותם
חשיבה, הליכה, אכילה, קריאה – כל דבר שאנו עושים תלוי בתאים ממוינים לחלוטין שמְבַצְּעִים את עבודתם כהלכה. הבנת גוף האדם דורשת למידה של סוגי תאים מסוימים. נאמר שאנו מתעניינים באופן שבו אנו חושבים. במקרה כזה נצטרך לחקור תאי מוח (שנקראים תאי עצב). אם נרצה ללמוד כיצד אנו הולכים נצטרך לחקור תאי שריר. אם אנו רוצים לדעת כיצד הגוף מייצר אנרגיה ממזון נצטרך להביט מקרוב על תאים במערכת העיכול.
במחקר שלנו אנו מתעניינים בתאים של כלי דם. חלק מכלי הדם אפשר לראות ישירוֹת דרך העור, אולם מרביתם חבויים ומפוזרים לאורך הגוף כולו! כלי דם אחראים על הסעת חמצן וחומרי מזון מהדם אל רקמות הגוף, ודואגים לבריאותם של תאים אחרים. כלי דם עשויים מתאים שנקראים תאי אֶנְדּוֹתֵל. תאי אנדותל שומרים על המבנה של כלֵי הדם, ואם כלִי הדם נשבר תאי האנדותל מתחילים תהליך של קרישת דם. חוסר תפקוד של תאי אנדותל נחשב כסיבה לחלק מהמחלות כמו לחץ דם גבוה, התקף לב, שבץ ומחלות רבּות אחרות. חיידקים ווירוסים מסוימים מדביקים תאי אנדותל וגורמים נזק לגוף. לכן, חקירת תאי אנדותל היא חשובה מאד כדי להבין את המחלות האלה ולמצוא דרכים לרפא אותן או למנוע אותן.
אולם כיצד נשיג מספיק תאי אנדותל כדי לחקור אותם? “קחו אותם מאנשים”, אתם עשויים לומר. אולם השאלה היא כיצד נשיג את כמות התאים הגדולה שנחוצה כדי לערוך ניסויים? תאים שנלקחים ישירות מגוף האדם נקראים תאים ראשוניים. השגת תאי אנדותל ראשוניים היא מורכבת מאוד. חשוב מכך, אפשר לבודד מספר מוגבל בלבד של תאים מאדם בלי שייגרם לו נזק. המספר הזה אינו מספיק כדי לחקור את התאים ולבחון תרופות חדשות. נוסף על כך מאחַר שתאים ראשוניים הם ממוינים לחלוטין, הם אינם מתרבים הרבה אחרי שהם נלקחים מהגוף, כך שמספר התאים המבודדים אינו גדֵּל עם הזמן. מדענים למדו כיצד לשנות תאים ראשוניים במעבדה כך שהם ימשיכו להתרבות. התהליך הזה נקרא אימוֹרטליזציה (מלשון immortal – חיי נצח). התאים שנוצרים מְכֻנים תאים אימורטליים, או תרבית תאים רציפה. תאים אימורטליים שנלקחו מכלי דם נקראים תאי אנדותל אימורטליים, והם שימושיים מאוד לצורך בחינת תרופות חדשות. אולם תאי אנדותל אימורטליים אינם זהים בדיוק לתאי אנדותל ראשוניים בגוף. במהלך האימורטליזציה, התאים האלה מאבדים לעיתים קרובות חלק מהתכונות שהם רכשו במהלך ההתמיינות, ואינם מסוגלים לבצע את אותם התפקודים שמקיימים תאי אנדותל ראשוניים (איור 1B). לכן אנו שואלים: האם אפשר לשפר את התפקוד של תאים אימורטליים על-ידי עצירת ההתרבות התאית? כדי למצוא את התשובה היינו צריכים לְפַתֵּחַ כלי שיתפקד כמֶתֶג, יוכל לפי פקודה להדליק הִתרבות של תאים ולכבותהּ, ואז להשוות מה קורה עם תאים שמתרבים לעומת תאים שאינם מתרבים.
מתגים של גֶּנִים וכיצד לבנות אותם
לכל אחד מאיתנו יש גֶּנוֹם ייחודי אשר מכיל אלפי גֶּנִים שירשנו מההורים שלנו. לכל תפקוד תאי יש לפחות גֶּן מסוים אחד שאחראי עליו. למרות העובדה שהגנום בכל התאים בגוף הוא זהה, כל סוג תא מפעיל רק את סֶט הגנים המסוים שנדרש כדי למלא את עבודתו של סוג התא הזה. לכן, לתאים חייבת להיות דרך להפעיל גנים לפי פקודה. כיצד הם עושים זאת? כדי לשלוט בפעילותו, לכל גן יש מתג שמכונה מְקַדֵּם (promoter). כאשר מקדם הוא פעיל הגן שמקושר אליו מודלק וּמְבַצֵּע את התפקוד שלו. כאשר המקדם אינו פעיל הגן מכובה והתפקוד אינו מתבצע.
עבור המטרה שלנו השתמשנו במקדם מלאכותי שמכֻנה מְקַדֵּם Tet (Tet-promoter). המקדם הזה לרוב אינו פעיל מאחר שחסר לו טְרִיגֶר לפעולה. הטריגר מכיל שני חלקים: גורם מפעיל (חלבון), וחומר שמכֻנה דוֹקסיציקלין (אנטיביוטיקה ממשפחת הטטרהציקלין). אם הגורם המפעיל והדוקסיציקלין נוכחים הם מרכיבים מבנה שיכול להיקשר למקדם ה-Tet ולהדליק אותו. אולם אם האנטיביוטיקה חסרה המפעיל לא יכול לבצע את עבודתו. אם הגורם המפעיל כבר נמצא בתא אנו צריכים רק להזין את התאים בדוקסיציקלין כך ששני החלקים ייצרו את המבנה שיפעיל את המקדם (איור 2A). זו הדרך שבה אנו שולטים על פעולתו של מקדם.
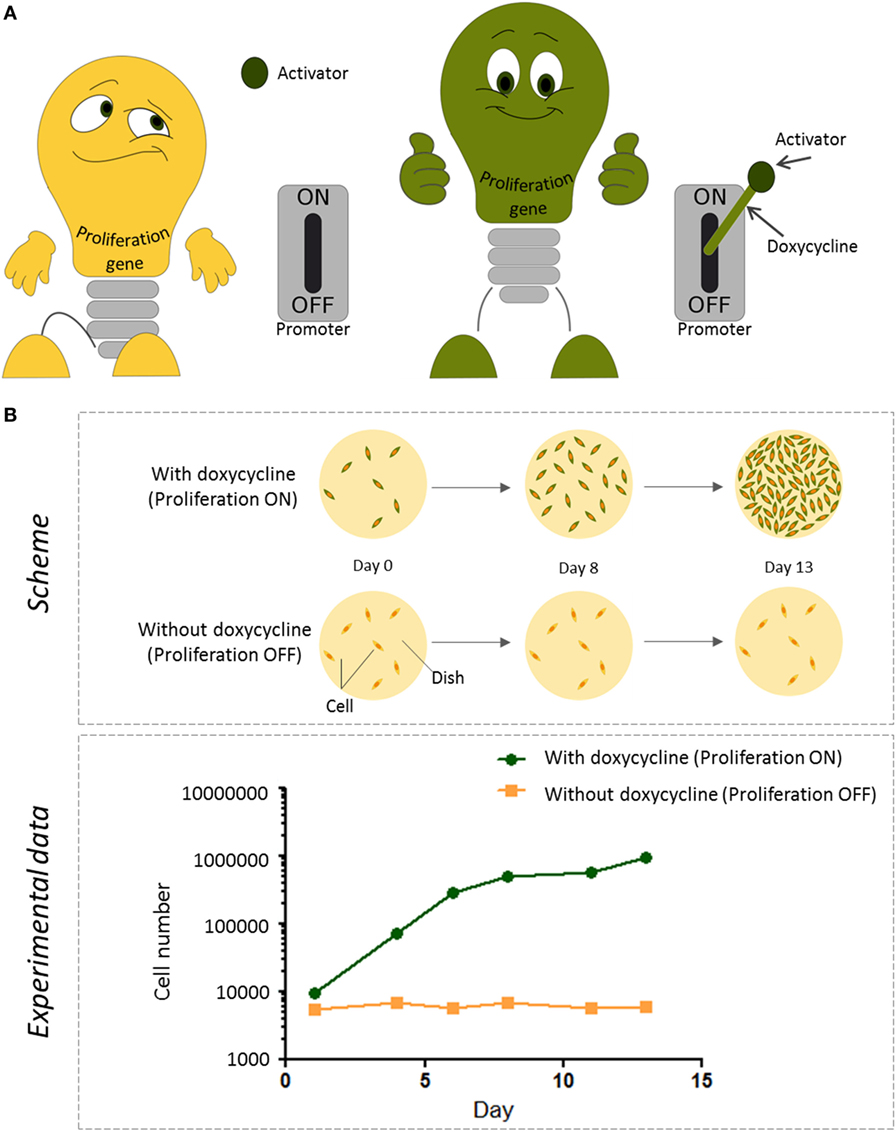
- איור 2 - כיצד אנו שולטים בהִתרבות תאים אימורטליים במעבדה (A) מקדם ה-Tet הוא כמו מתג שיכול להדליק גן של התרבות תאית או לכבותו.
- בדרך כלל, מקדם ה-Tet מכובה והתאים אינם גדלים. הפעלה של מקדם ה-Tet מתרחשת רק בנוכחות חלבון מפעיל (שכבר נמצא בתאים שלנו) ודוקסיציקלין, חומר אנטיביוטי שאותו אנו יכולים להוסיף לתאים. הנוכחות של דוקסיציקלין או היעדרותו קובעת לכן אם גן ההתרבות דלוק או כבוי. (B) למעלה: ייצוג סכמטי של הניסוי אשר מְנַטֵּר התרבות של תאים. תאים אימורטליים הנושאים גם מתג של חלבון ה-Tet וגם גורם מפעיל גֻּדְּלו בשתי צלחות גידול (העיגולים הצהובים, במבט מלמעלה). היום שבו התאים הוכנסו לצלחת סומן כיום 0. לאחר מכן התאים גודלו בצלחות האלה בנוכחות של דוקסיציקלין במשך 13 ימים. הוספת הדוקסיציקלין הפעילה את גן ההתרבות והתאים התחלקו, מה שהוביל לגדילת מספר התאים בצלחת. למטה: כדי לראות כמה מהתאים התרבו התאים בכל צלחת נספרו בימים 1, 4, 6, 8, 11, ו-13. בנוכחוּת דוקסיציקלין (הקו הירוק), מספר התאים בצלחת גדל עם הזמן. לעומת זאת בהיעדר דוקסיציקלין (הקו הכתום), תאים לא התחלקו ומספר התאים נשאר אותו הדבר [1].
איזה גן הוא הטוב ביותר עבור שליטה בהתחלקות של תאים לפי פקודה? כדי לזהוֹת אלה גנים יכולים לבצע את העבודה חקרנו מקרוב את אחת המחלות הקשות אצל בני אדם – סרטן. תאים סרטניים יכולים להתרבוֹת ללא גבול, ובכך הם פוגעים בגוף. פענחנו אלה גנים מאלצים תאים סרטניים להמשיך להתחלק. הגנים האלה נקראים גנים של הִתרבות. תאים של גידול סרטני אינם יכולים לכבות את הגנים האלה, וזו הסיבה שתאים סרטניים מסוכנים כל כך. אולם האם אפשר לשלוט בהתרבות על-ידי קישור בין גנים של התרבות לבין מתגים שאנו שולטים בהם באמצעות הוספת דוקסיציקלין?
כדי לבחון אם זה יכול לעבוד הכנסנו גנים של התרבות שמחוברים למקדם ה-Tet כמו גם לגורם המפעיל לתוך תאי אנדותל. כאשר לא הזנו את התאים בדוקסיציקלין המקדם לא היה פעיל וגן ההתרבות לא התבטא. במקרה הזה מספר תאי האנדותל נשאר ללא שינוי עם הזמן (איור 2B). אולם ברגע שהוספנו דוקסיציקלין המקדם הִפְעִיל את הגן. התאים התחילו להתחלק ומספר התאים גדל. התחלנו עם 10,000 תאים, וכעבור שבועיים הגענו ליותר ממיליון תאים! בכך אישרנו כי התאים שאנו יוצרים עם גֶּן ההִתרבות המוכנס לתוכם מסוגלים להִתרבות בתגובה לדוקסיציקלין.
האם הִתרבות משפיעה על התפקוד של תאי אנדותל?
לאחר שיצרנו כלי המאפשר הדלקה וכיבוי של התרבות תאית לפי רצוננו, שאלנו את עצמנו אם הִתרבות משנה את תפקודם של תאי האנדותל. כדי לעשות זאת היינו צריכים להשוות את התפקודים של תאים מתרבים עם אלה שלא יכלו להתרבוֹת. דרך אחת להשוות תפקודים של תאים מתרבים ובלתי מתרבים היא למדוד את הפעילוּת של הגנים שתאי האנדותל צריכים כדי לבצע את תפקידם בגוף. ניתחנו 45 גנים שפעילים בתאי אנדותל ראשוניים. בתאים האימורטליים שאינם מתרבים 40 מהגנים האלה היו פעילים, אולם כאשר הדלקנו את ההִתרבות רק 34 גנים היו פעילים. זה אמר לנו כי תאים אימורטליים שאינם מתרבים דומים יותר לתאים ראשוניים. אולם האם זה באמת מעיד על כך שהתאים שאינם מתרבים מְבַצְּעִים את עבודתם טוב יותר?
בגוף האדם תאי אנדותל בונים כלי דם, שהם צינוריות חלולות אשר מְשַׁנְּעוֹת נוזלים (דם ונוזלים אחרים שמכֻנים לימפה) דרך הגוף. מתברר שאנו יכולים לחקות במעבדה בנייה של כלי דם. בדרך כלל אנו משאירים את התאים בצלחות פלסטיק שמאפשרות להם להתפשט בצורה אקראית לאורך מִשְׁטָח שטוח ולייצר שכבת תאים אחת. בגוף האדם לעומת זאת תאים אינם גדלים על פלסטיק אלא נתמכים על-ידי פיגום מסוים שמכֻנה מַטְרִיצָה חוץ-תאית (בלועזית extracellular matrix, או ECM בקיצור). אם אנו מאפשרים לתאים לגדול על ECM בצלחת מפלסטיק אנו רואים שבִּמְקום שהם יהיו מפוזרים לאורך משטח, התאים מתחברים זה לזה בצורה מסוימת ומייצרים צינוריות אשר נראות כמו קשים קטנטנים שאפשר לראות במיקרוסקופ. הצינוריות גדלות בכיוונים שונים וחוֹצוֹת זו את זו כך שנוצרת רשת. אורכן של הצינוריות ומִספרן יכולים לספֵּק לנו מידע על איכות העבודה שתאי האנדותל מסוגלים לבצע.
בניסוי זה השווינו תאי אנדותל אנושיים ראשוניים עם התאים האימורטליים שלנו. כדי לעשות זאת גידלנו תאים על ECM ושמרנו אותם עם דוקסיציקלין או בלעדיו כדי לשלוט בהִתרבות שלהם. לאחר מכן ספרנו כמה צינוריות נבנו בתנאים האלה והשווינו את מספר הצינוריות שנוצרו על-ידי תאים ראשוניים לעומת הכמות שנוצרה על-ידי תאים אימורטליים. התברר שהתאים האימורטליים המתרבים לא יצרו צינוריות בצורה יעילה כמו תאים שאינם מתרבים. בסך הכול, התאים הבלתי מתרבים יצרו צינוריות באותה יעילוּת כמו תאים ראשוניים (איור 3). הנתונים האלה אישרו שההתרבות אכן מתערבת בתפקוד של תאי אנדותל, והתאים שאינם מתרבים ביצעו את עבודתם טוב יותר מִתָּאִים שמתרבים.
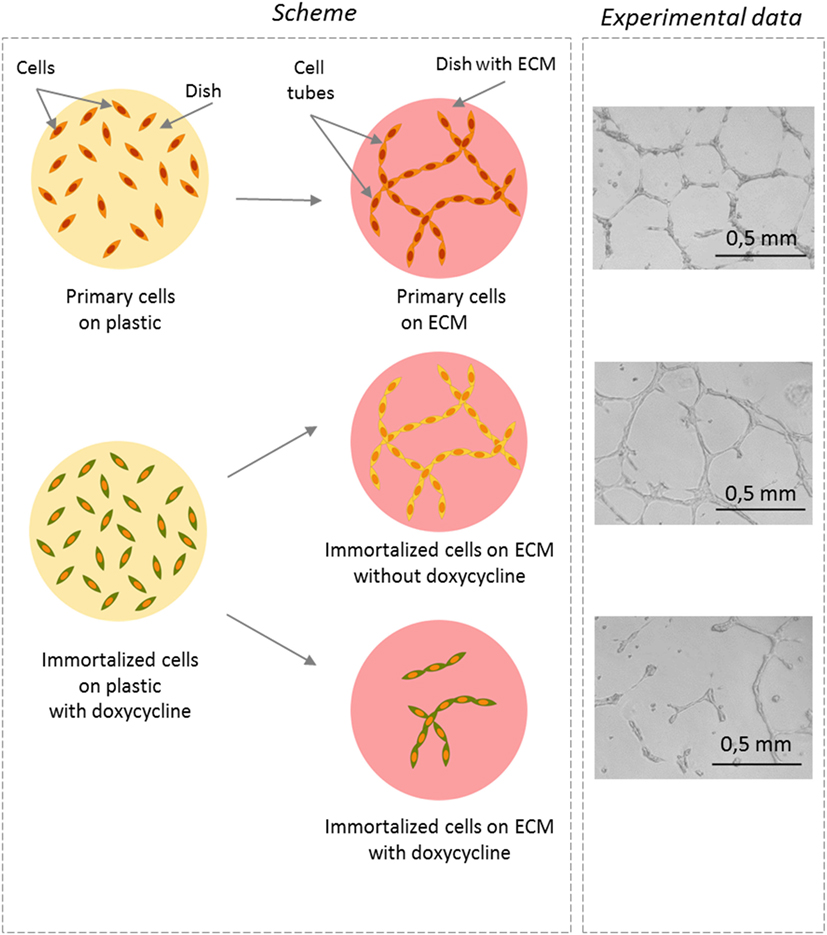
- איור 3 - האם הִתרבות משפיעה על היכולת ליצירת צינוריות דם? פאנל שמאלי: ייצוג סכמטי של הניסוי – ציור של האופֶן שבּו תאי אנדותל ראשוניים או אימורטליים נראים כאשר הם גדלים על צלחת פלסטיק פשוטה (העיגול הצהוב) או על צלחת שמכוסה במטריצה חוץ-תאית (ECM; עיגול אדום).
- אתם יכולים לראות שהתאים מפוזרים על גבי צלחת הפלסטיק אולם הם מייצרים צינוריות רק אם הם שקועים ב-ECM. פאנל ימני: צילומים שנלקחו בעזרת מיקרוסקופ, 16 שעות אחרי שיקוע התאים ב-ECM. בהיעדר דוקסיציקלין התאים שאינם מתרבים (מוצגים בצהוב) יצרו צינוריות, בדומה לתאים ראשוניים. זה הורָה על כך שתאים שאינם מתרבים די דומים לתאים ראשוניים. לעומת זאת כאשר נוסף דוקסיציקלין והתָאים התרבו (מוצג בירוק), פחות צינוריות נוצרו, ואלה שנוצרו היו קצרות יותר ולא יצרו רשת. משמעות הדבר היא שהִתרבות משפיעה על תפקוד של תאי אנדותל.
כיצד נוכל להיתרם עוד מהִתרבות נשלטת של תאי אנדותל?
פיתחנו תאים אימורטליים שאנו יכולים לאלצם לגדול לפי פקודה. מצד אחד על-ידי הוספת דוקסיציקלין אנו יכולים לגרום לתאים האלה להתרבוֹת כדי להשיג את מספר התאים שאנו צריכים לניסויים שלנו. מצד אחר אם אנו מסירים את הדוקסיציקלין התאים מפסיקים להתרבות ומְבצעים תפקודים של תאי אנדותל בצורה טובה כמו התאים הראשוניים בגוף שלנו. לכן, באמצעות הַכְנָסַת מתג הִתרבות אנו יכולים להגדיל את מספר התאים ובד בבד להימנע מההתלבטות של איזון בין הִתרבות לבין תפקוד.
התאים האימורטליים שנוצרו יכולים להתרבוֹת ללא גבול, ואפשר להשתמש בהם במגוון ניסויים. בפרט אפשר להשתמש בהם עבור חקירת התפקיד של תאי אנדותל במחלות שונות. לאחרונה איששנו כי בדומה לתאי אנדותל בגוף, תאי אנדותל אימורטליים יכולים להיות מודבקים על-ידי שני וירוסים אנושיים שנקראים (KSHV) Kaposi’s sarcoma-associated herpesvirus (CMV) Cytomegalovirus-ו. KSHV הוא וירוס נדיר שבדרך כלל מתחבא בשקט בגוף האדם ואינו מזיק. אולם במקרים מסוימים, כאשר מערכת החיסון של מטופל אינה פועלת כהלכה, הווירוס יכול לגרום לסרטן שנקרא סרקוֹמת קפוּשי. הסרטן הזה הוא חמוּר, וכיום אין טיפולים או חיסונים אמינים כנגדו. אנו משתמשים בתאים אימורטליים כדי לבחון כיצד וירוסים מְשַׁנִּים את התאים והופכים אותם לתאים סרטניים כך שנוכל לפתח שיטות לעצור את התהליך. כמו כן אנו משתמשים בתאי אנדותל אימורטליים כדי לזהוֹת תרופות חדשות שמתגברות על הווירוס ומאטות את התפשטות הסרטן שנגרמת על-ידי הווירוס. בעזרתם של תאי אנדותל אימורטליים כבר הצלחנו לזהוֹת כמה תרופות אפשריות שעשויים להשתמש בהן כדי לרפא חולֵי סרטן בעתיד.
מילון מונחים
הִתְרַבּוּת תאית (Proliferation): ↑ תהליך שבו תא בודד מתחלק ומייצר שני תאי בת, ובכך מגדיל את מספר התאים הכולל.
התמיינוּת תאים (Differentiation): ↑ התבגרות של תאים ורכישת תכונות מסוימות אשר נדרשת כדי לקיים סֶט של תפקודים ברקמות שונות בגוף האדם.
תאים ראשוניים (Primary cells): ↑ תאים מקוריים שבודדו ישירות מהגוף ולא עברו שום שינוי.
אימוֹרטליזציה (Immortalization): ↑ יצירת תאים שמתחלקים ללא גבול.
תאים אימורטליים (Immortalized cells): ↑ תאים שמתרבים באופן רציף, אשר הופקו מגידולים סרטניים או שגודלו במעבדה מתוך תאים ראשוניים.
גֶּן (Gene): ↑ אזור ב-DNA שמקוֹדד מידע עבור תפקוד תאִי מסוים.
מְקַדֵּם (Promoter): ↑ אזור ב-DNA ששולט על ביטוי של גֶּנים באמצעות כיבוי והדלקה שלהם.
מַטְרִיצָה חוץ-תאית (Extracellular matrix, ECM): ↑ מולקולות שונוֹת שמיוצרות מִתאים, אשר מתפקדות כפיגומים עבור גדילה של תאים בגוף והתפתחותם.
הצהרת ניגוד אינטרסים
DW הגישה פטנט על הטכנולוגיה ליצירת שורות תאים אימורטליים מֻתְנִים. הַמְּחַבֶּרֶת השנייה מצהירה בזאת כי המחקר נערך בהיעדר קשר מסחרי או כלכלי שיכול להתפרשׁ כניגוד אינטרסים פוטנציאלי.
מאמר המקור
↑ Lipps, C., Badar, M., Butueva, M., Dubich, T., Singh, V. V., Rau, S., et al. 2017. Proliferation status defines functional properties of endothelial cells. Cell. Mol. Life Sci. 74(7):1319–33. doi: 10.1007/s00018-016-2417-5
מקורות
[1] ↑ Lipps, C., Badar, M., Butueva, M., Dubich, T., Singh, V. V., Rau, S., et al. 2017. Proliferation status defines functional properties of endothelial cells. Cell. Mol. Life Sci. 74(7):1319–33. doi: 10.1007/s00018-016-2417-5