תַקצִיר
חיידקים הם אורגניזמים מיקרוסקופיים שחיים בכל מקום – אפילו בתוך גופנו. חלקם לא מזיקים, אולם אם חיידקים מזיקים נכנסים לגופנו, הם יכולים לגרום לזיהום. כדי להיפטר מזיהומים, רופאים רושמים טיפולים עם אנטיביוטיקה. אך כיצד מגלים אנטיביוטיקה או מייצרים אותה? כיצד הרופאים יודעים שהאנטיביוטיקה תהרוס את החיידקים, אך לא תפגע בנו? האם האנטיביוטיקות האלה נבחנות לפני שאנו משתמשים בהן? במאמר זה, נתייחס לשאלות האלה על ידי התבוננות מקרוב בתהליך פיתוח של תרופה, שהוא סדרה של צעדים שמובילים לפיתוח אנטיביוטיקות חדשות, לצד תרופות אחרות. רק טיפולים שעוברים את שלבי הניתוח והסקירה האלה, שלעיתים קרובות אורכים כמה שנים, נחשבים ראויים לשימוש אנושי, ובמקרה של אנטיביוטיקות הן מומלצות לשימוש כנגד זיהומים.
מבוא
האם אתם זוכרים את הפעם האחרונה שביקרתם אצל הרופא בגלל זיהום באוזן מלאה מוּגלה? או אולי היה זה זיהום בגרון עם שקדים נפוחים? בכל מקרה, כנראה חוויתם זיהום חיידקי. אם כך, הרופא ככל הנראה רשם עבורכם תרופות מסוימות כמו למשל אנטיביוטיקה, שיכולה להרוס חיידקים שגורמים לזיהום.
חיידקים הם אורגניזמים זעירים, מיקרוסקופיים, שקיימים בכל מקום לרבּות בגוף האדם (למידע נוסף על היצורים המרתקים האלה, הסתכלו במאמרים [3–1]). זיהום חיידקי נובע מנוכחות ומִגדילה של חיידקים מזיקים על הגוף או בתוכו. אנטיביוטיקות הן תרופות שהורגות חיידקים, או עוצרות את גדילתם. רופאים ממליצים על טיפול באנטיביוטיקה על בסיס מיקום הזיהום וסוג החיידקים שגורמים לזיהום.
בזמן שאתם בולעים כפית של נוזל בטעם דובדבן או בולעים גלולה צבעונית, האם אי פעם תהיתם כיצד פיתחו את האנטיביוטיקות האלה? תופתעו לדעת שלפני שהסירופ או הגלולה האנטיביוטיים מגיעים לבית המרקחת, ומאוחר יותר לביתכם, הם נמצאו תחת מחקר מדעי מעמיק. התהליך הזה ידוע בתור מסלול פיתוח תרופות, והוא מכיל סדרה של שלבים, מהמעבדה ועד לקליניקה. הרופאים שלכם יכולים להמליץ לכם בבטחה על תרופה רק אחרי שהיא עברה את כל השלבים בתהליך. השלבים האלה כוללים בדרך כללי גילוי של אנטיביוטיקה פוטנציאלית (או תרופה אחרת) במעבדה, אפיון תכונות חשובות של האנטיביוטיקה, בחינת השפעותיה על חיות, ולאחר מכן בחינתה על בני אדם. לאורך התהליך הזה, האנטיביוטיקה הפוטנציאלית מוערכת ביחס לכמה מאפיינים, בהם יכולתה להרוג חיידקים או למנוע את גדילתם, בטיחות השימוש בה עבור בני אדם, אינטראקציות עם תרופות אחרות, מינונים ומשך זמן הטיפול, תנאים מיטביים לאחסון ומאפיינים נוספים. מִנְהַל המזון והתרופות האמריקאי (FDA) הוא סמכות גלובלית שמפקחת אחר הרגולציות החשובות האלה ואוכפת אותן, כדי לוודא את הבטיחות והאיכות של תרופות, חיסונים, תחבושות וטיפולים אחרים.
שלבים עיקריים במסלול פיתוח תרופות
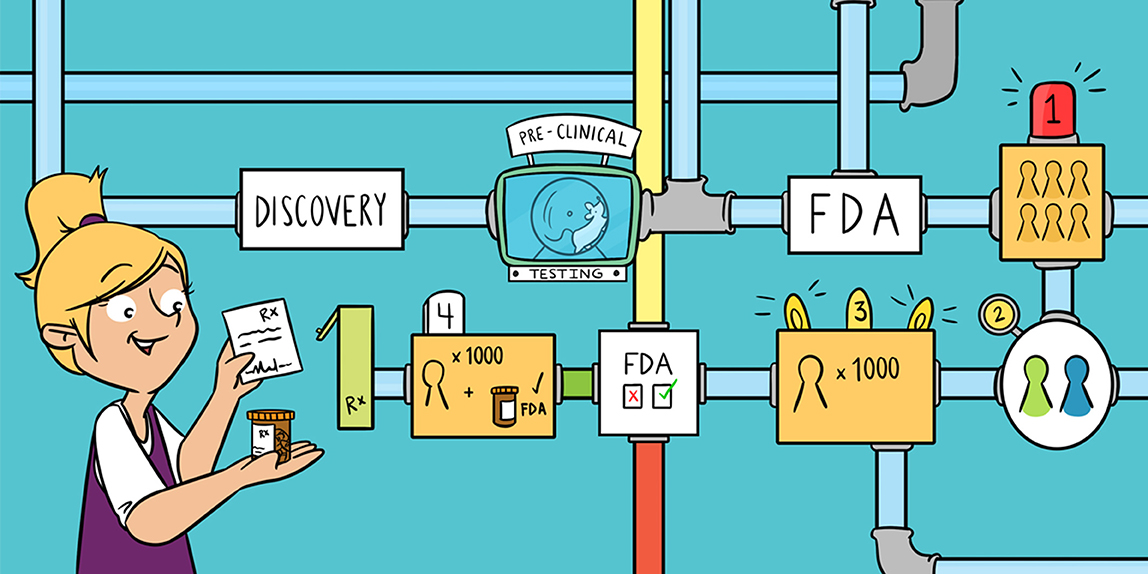
כפי שציינו קודם, פיתוח של אנטיביוטיקה מוצלחת ובטוחה צריך להתרחש בכמה צעדים, מגילוי ועד לניתוח קפדני של פעילות התרופה ותופעות הלוואי שלה. מסלול ההתקדמות הכולל של פיתוח תרופה עשוי לארוך בין 10 ל-20 שנים, מגילוי של אנטיביוטיקה פוטנציאלית ועד שהיא מאושרת לשימוש בבני אדם. המסלול יכול להתחלק לשלושה שלבים עיקריים: גילוי ואפיון, ניסויים פרה-קליניים וניסויים קליניים (איור 1).

- איור 1 - מסלול של פיתוח תרופה מכיל כמה שלבים, החל מגילוי התרופה ועד לשיווקה לשימוש אנושי.
- אנטיביוטיקה פוטנציאלית צריכה לעבור דרך השלבים השונים האלה לפני אישור על ידי ה-FDA ושירותי הבריאות. התהליך הזה יכול לארוך בין 10 ל-20 שנים.
גילוי ואפיון
במעבדות בכל רחבי העולם, מדענים מנסים למצוא אנטיביוטיקות חדשות. בשלב הזה, מדענים בוחנים טווח של תרכובות ממקורות צמחיים, מחיות ומפטריות ביחס להשפעתן על חיידקים שונים. כיום, מדענים אוספים ובוחנים באופן אקטיבי מקורות פוטנציאליים לאנטיביוטיקה, אולם האנטיביוטיקה הראשונה התגלתה לגמרי במקרה על ידי רופא בריטי בשם אלכסנדר פלמינג [4]! בעודו עובד במעבדתו, פלמינג הבחין בגוש של פטרייה שגדלה על צלחת עם תרבית חיידקית, והוא ראה שהחיידקים שעל הצלחת לא היו מסוגלים לגדול באזור שקרוב לפטרייה. הפטרייה ייצרה פניצילין, אנטיביוטיקה חזקה, שהרגה את החיידקים שקרובים אליה. כיום, גישות בדיקה דומות יכולות לזהות אנטיביוטיקות פוטנציאליות חדשות, שלאחר מכן מנותחות יותר לעומק [5]. אנטיביוטיקות פוטנציאליות נחקרות מבחינת הכימיה והמבנה שלהן, וגם ביחס לפעילויות הביולוגיות שלהן, כמו למשל עד כמה הן יעילות בהריגת חיידקים, ומהן האינטראקציות שלהן עם תרופות אחרות. המידע הזה קריטי לייצור של אנטיביוטיקה, והוא מוודא את הבטיחות של תרופה חדשה, את ניקיונהּ ואת חוזקהּ. האפיון הזה גם מספק מידע חשוב עבור החברה שבסופו של דבר תייצר את האנטיביוטיקה, שעליה להגיש מידע ל-FDA לצורך אישור התרופה (איור 1).
ניסויים פרה-קליניים
בצעד הבא של פיתוח תרופה, תרכובות שהראו תוצאות מבטיחות בניסויי מעבדה עוברות סיבוב נוסף של בדיקות לפני שניתן לנסותן על בני אדם. השלב הזה נקרא ניסויים פרה-קליניים, והוא מתמקד בהערכת היעילוּת של התרופה ביחס לזיהומים “אמיתיים” (בניגוד לבחינה במעבדה), ובהשפעות הרעילות האפשריות של התרופה. ניסויים פרה-קליניים לעיתים קרובות מערבים שימוש בחיות כמו למשל ארנבים, חולדות, עכברים, חזירי ים, אוגרים, ואפילו חיות גדולות יותר כמו למשל כלבים, חזירים, כבשים ועגלים (איור 2). החיות האלה נקראות מודלים אורגניזמיים, מה שאומר שהן מגודלות להיות חיות מעבדה. אלו לא חיות מהטבע, חיות מחמד או חיות נטושות.
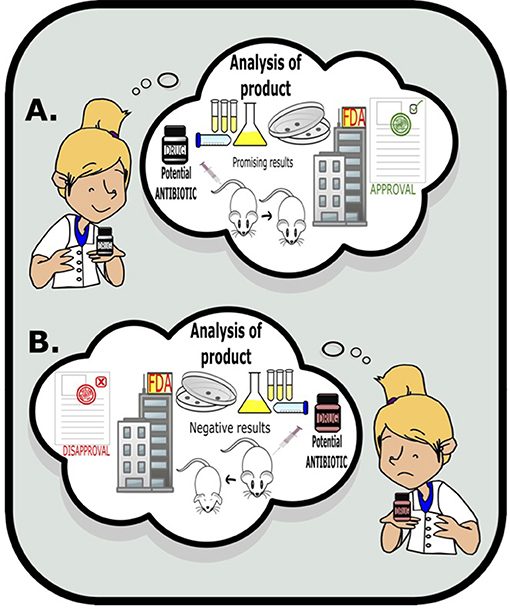
- איור 2 - מדענים משתמשים במבחנים שונים כדי לחקור פעילות של אנטיביוטיקה פוטנציאלית ואת יעילותה, כמו למשל ניסויי מעבדה וחיות מודל.
- אם תוצאות המבחנים מבטיחוֹת, התרופה מומלצת על ידי ה-FDA לבחינות נוספות או לניסויים קליניים.
בואו נעצור כאן לרגע – ודאי קשה לכם לחשוב על כך שחיות משמשות לניסויים במעבדה. מדענים לוקחים ברצינות ניסויים בחיות, והקהילה המדעית מודעת לשיקולים האתיים של שימוש בחיות עבור המטרות האלה. כתוצאה מכך, ניסויים בחיות נמצאים בפיקוח מחמיר, ומדענים במעבדות מוכשרים לבצע את העבודה הזו בסטנדרטים הגבוהים ביותר לטיפול בחיות. בד בבד, חוקרים מנסים באופן פעיל לפתח חלופות לניסויים בחיות, על ידי יצירת ניסויי מעבדה שֶׁיְּחַקּוּ במידה טובה זיהומים אנושיים. הקהילה המדעית מנסה להחליף את הניסויים בחיות בניסויי המעבדה דמויי-האדם האלה, אולם לפני שזה יוכל להפוך למציאות, ניסויי מעבדה דמויי-אדם יצטרכו להיחקר לעומק כדי לוודא שהם יכולים באופן ראוי את בטיחותן של תרופות חדשות. עקבו אחר ההתפתחויות החשובות האלה!
כיום, ניסויי מעבדה עם חיות מאפשרים ניתוח של מאפייני תרופות כמו למשל פעילות של אנטיביוטיקה, בטיחות, מינון ורעילות של אנטיביוטיקה במערכת חיה, כך שהמידע הזה מובן כראוי לפני שהתרופה ממשיכה לשימוש בניסויים קליניים או בבני אדם.
ניסויים קליניים
הצעד העיקרי האחרון במסלול של פיתוח תרופה הוא ניסוי התרופה על בני אדם, במה שנקרא ניסויים קליניים (איור 1). כדי לקחת את האנטיביוטיקה הפוטנציאלית לניסויים קליניים, צריך ראשית להגיש ל-FDA טופס שנקרא Drug New Investigational (IND). הטופס הזה מוגש בדרך כלל על ידי החברה שתפתח את התרופה. ה-FDA יסתכל מקרוב על התוצאות מהניסויים הפרה-קליניים, יבחן את המבנה הכימי של התרופה ואת מנגנון פעולתה, יבין את תופעות הלוואי ויעריך את בטיחות התרופה ביחס למינון שלה ולרעילותה בתוך מערכת חיה. אם ה-FDA יאשר את של מפתחת התרופה, אז התרופה יכולה לעבור לשלב של ניסויים קליניים אנושיים [5] (איור 2). ניסוי קליני טיפוסי כולל ארבעה שלבים.
שלב :1 השלב הראשון מערב מתן מינונים נמוכים של התרופה למספר קטן (בסביבות 12) של אנשים בריאים. הניסוי הזה בודק כיצד התרופה נספגת ומעובדת בגוף, ואם יש לה תופעות לוואי. הוא מתמקד בעיקר בקביעת המינון והבטיחות של שימוש בתרופה בבני אדם.
שלב :2 השלב הזה מערב שתי קבוצות של אנשים – אנשים בריאים ואנשים חולים, שבמקרה של אנטיביוטיקה מכילה אנשים שקיבלו זיהום. ניסוי זה מתמקד בהבנה אם התרופה יעילה בטיפול במצב עבור קבוצת האנשים החולים, למשל אם האנטיביוטיקה באמת נלחמת בזיהום בבני אדם. הוא גם מתמקד בהבנת המינון המדויק שנדרש כדי שהתרופה תעבוד.
שלב :3 הפאזה הזו מערבת ניסויים קליניים על מאות עד אלפי מטופלים. בשלב זה, התרופה החדשה מושווית לתרופות קיימות. מטופלים נבחנים מקרוב, והניסוי מפסיק אם יש למטופלים תופעות לוואי. בשלב הזה, בטיחות התרופה נמצאת בעדיפות עליונה, יחד עם הצלחת התרופה ביצירת התוצאה הרצויה. באמצעות שימוש בנתונים מהניסויים הקליניים האלה, צריך למלא ולהגיש ל-FDA טופס אחר שנקרא New Drug Application. ה-FDA בוחן מקרוב את הנתונים שהתקבלו מהניסויים הקליניים, ובהתבסס על הנתונים האלה הוא יכול לקבל אחת משלוש החלטות: הוא יכול לאשר את התרופה, הוא יכול לשלול את התרופה, או שהוא יכול לבקש מידע נוסף. אם היא מאושרת על ידי ה-FDA, התרופה נעשית זמינה מייד לייצור מסחרי.
שלב 4 – ניסויים קליניים: השלב הזה בוחן תרופות חדשות שאושרו על ידי ה-FDA, במספרים גדולים (בדרך כלל אלפים) של מטופלים. הוא בודק במיוחד אם מופיעות תופעות לוואי נדירות (או יתרונות), שאותם ניתן לזהות רק כשבוחנים כמויות גדולות של אנשים.
כעת אתם יודעים!
אם כן, עכשיו אתם יודעים שפיתוח אנטיביוטיקה חדשה אינו תהליך פשוט! זהו תהליך ארוך וקפדני שמערב גילוי של תרופה במעבדה, ניתוח היעילות והבטיחות שלה, ולאחריהם הגשת טופס Investigational drug Application (IND) ועריכת ניסויים פרה-קליניים וקליניים. התהליך הזה חשוב לזיהוי תרופות שהן יעילות, ולא מאפשר שימוש בתרופות שאינן יעילות. בפעם הבאה שתלכו לרופא ותקבלו מרשם לתרופה, אולי תרצו לחלוק איתו את הידע שלכם!
מילון מונחים
אנטיביוטיקה (Antibiotic): ↑ תרופה שנלחמת בזיהום חיידקי, על ידי הריגת החיידקים או מניעת גדילתם.
חיידקים (Bacteria): ↑ אורגניזמים זעירים שאינם נראים לעין.
תרופה (Drug): ↑ חומר שיש לו השפעות רפואיות כאשר הוא מתעכל או מוכנס לגוף.
מסלול פיתוח תרופות (Drug Development Pipeline): ↑ התהליך כולו, החל מגילוי תרופה ועד להבאה של תרופה חדשה, בטוחה ומוצלחת לשימוש בשוק.
מִנהל המזון והתרופות האמריקאי (Food and Drug Administration): ↑ סוכנות בשירותי בריאות הציבור האמריקאים שאחראית על הגנה על בריאות הציבור על ידי הבטחת הבטיחות והיעילות של חומרים שונים שמשמשים בני אדם וחיות, כולל תרופות.
ניסוי קליני (Clinical Trial): ↑ סוג של מחקר שחוקר בדיקות וטיפולים חדשים, ומעריך את השפעתם על בריאות אנושית.
יעילות (Efficacy): ↑ יעילותה של תרופה לייצר את התוצאה הרצויה.
מודלים אורגניזמים (Model Organisms): ↑ חיות שמגודלות כדי לשמש בניסויי מעבדה.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ da Silva, G. J., and Domingues, S. 2017. We are never alone: living with the human microbiota. Front. Young Minds 5:35. doi: 10.3389/frym.2017.00035
[2] ↑ Okshevsky, M., and Meyer, R. L. 2016. Big bad biofilms: how communities of bacteria cause long-term infections. Front. Young Minds 4:14. doi: 10.3389/frym.2016.00014
[3] ↑ Reches, M. 2018. Fighting bacteria: how can we prevent hospital-acquired infections? Front. Young Minds 6:43. doi: 10.3389/frym.2018.00043
[4] ↑ Letek, M. 2020. Alexander Fleming, the discoverer of the antibiotic effects of penicillin. Front. Young Minds 7:159. doi: 10.3389/frym.2019.00159
[5] ↑ Horien, C., and Yuan, P. 2017. Focus: drug development: drug development. Yale J. Biol. Med. 90:1.