תַקצִיר
האם השינוי הגדול הבא בטיפול בסרטן יכול להיות זעיר? ישנן סיבות רבות לכך שמחלת הסרטן היא כל כך קשה לטיפול. מדענים יכולים לנסות להמציא תרופות חדשות וטובות יותר לטיפול בסרטן, או שהם יכולים למצוא דרכים טובות יותר שבהן חולי הסרטן יוכלו לקבל את התרופות שלהם. מאמר זה מתאר דרך אפשרית חדשה להעביר תרופות לטיפול בסרטן באמצעות ננו-חלקיקים (Nanopartiales) – חומרים קטנטנים דמויי ספוג שמחזיקים בתוכם את התרופות. מדענים מקווים שננו-חלקיקים ישפרו את שיגור התרופות לטיפול בסרטן לתוך גידולים. באמצעות כך ששָׂמים את התרופה בתוך ננו-חלקיק אנו יכולים להגן על תאים בריאים בתוך הגוף מפני התרופות האלה, ועשויים להיות מסוגלים להשתמש בכמויות קטנות יותר של תרופות לצורך טיפול בחולה. טכנולוגיה מלהיבה זו עדיין נמצאת במחקר ותחת תהליכי שיפור, אולם באחד הימים היא עשויה להיות בשימוש כאסטרטגיה יעילה לטיפול בחולי סרטן.
הקדמה
אף על פי שחלו שיפורים רבים בטיפולים, עדיין קשה לטפל בסרטן. אחת הסיבות לכך היא שטיפול נפוץ לסרטן באמצעות תרופות כימיות, שנקרא כימותרפיה, יכול להיות קשה עבור המטופלים. התרופות שניתנות הן די חזקות, ומטופלים שעוברים כימותרפיה יכולים לחוות תופעות לוואי כמו עייפוּת, נשירת שיער, הרזיה וכאב. מה אם יכולנו להשתמש במכשיר מיוחד כך שחולה הסרטן יוכל לעבור כימותרפיה רק בתאי הסרטן, בלי לפגוע בתאים הבריאים שלו? זו מטרתם של החוקרים אשר מפתחים דרכים חדשות לשגר תרופות לתאי הסרטן בלבד. שיטות אלה שבאמצעותן משוגרות תרופות לתאי הסרטן נקראות אמצעים לשיגור תרופות (DDVs – Drug Delivery Vehicles). התקווה היא שאם הכימותרפיה תוכל להגיע אל תאי הסרטן בלבד ולא להפריע לתאים הבריאים, אולי חולי סרטן יוכלו לקבל מינונים נמוכים יותר של תרופות ולחווֹת פחות תופעות לוואי חזקות שבדרך כלל נחווֹת בעקבות כימותרפיה. חלק מאמצעי שיגור התרופות כבר נמצאים בשימוש בטיפולים בחולי סרטן, וחלקם עדיין מפותחים במעבדות מחקר כדי לשפר אותם ולוודא שהם בטוחים לשימוש לפני שאפשר יהיה לבדוק אותם על בני אדם. בעיה מרכזית שעומדת בפני מדענים המנסים לפתח אמצעי שיגור תרופות מוצלחים היא מציאת פתרון כיצד לכוון את המכשירים לתאי הסרטן בלבד. פתרון אחד הוא ניצול חלק מהמאפיינים של תאי סרטן, שהם שונים מתאים בריאים [1].
התא הסרטני
מחלת הסרטן היא מחלה מסובכת אשר גורמת לתאים לגדול בצורה שונה מאשר תאים רגילים ובריאים. תא רגיל בגוף שלכם מתחלק עד שהוא נעשה ”זקן“ או עד שהוא ניזוק, ואז הוא מת בדרך מיוחדת שנקראת ”מוות תאי מתוּכנת“ (Programmed cell death). התחלקות זו שמלוּוָה במוות תאי מתוכנת היא תהליך מכוּון בעל איזון עדין שמתרחש בתאים שונים בכל הגוף השלנו! אולם תאי סרטן לא מקבלים את האות להפסיק להתחלק, וכתוצאה מכך הם גדלים בצורה בלתי נשלטת אשר יכולה להיהפך לצֶבֶר של תאים סרטניים שנקרא גידול (Tumor). לתאים בגידול יש יתרון הישרדותי מאחר שגידולים מסוגלים לרוב לגדל הרבה כלי דם, מה שמאפשר להם לקבל אספקה של חומרי מזון ולהמשיך לגדול. דרך אחרת שבה תאי סרטן נבדלים מתאים רגילים היא שהם בעלי כמות גדולה יותר של מולקולות בפני השטח שלהם, שנקראות קולטני פְּנֵי שטח (Surface receptors), מאשר שיש לתאים רגילים. הקולטנים האלה יכולים לזהות חומרי מזון מסוימים שנמצאים מחוץ לתא, להכניס אותם לתוכם ולהשתמש בהם כדי להמשיך לגדול.
חוקרים יכולים לנצל את ההבדלים האלה בין תאי גידול ובין תאים רגילים כדי לנסות לכוון אמצעים לשיגור תרופות אל תוך תאי הסרטן ולהימנע מפגיעה בתאים בריאים. אמצעים לשיגור תרופות יכולים להיכנס לתוך גידולים בקלות רבה יותר מאשר לתוך תאים בריאים, מאחר שכלי הדם הנוספים הופכים את הגידולים להיות חדירים יותר לאמצעי שיגור התרופות הזעירים, ומרגע שאמצעי לשיגור תרופות נכנס לתוך הגידול הוא יישאר בתוכו למשך זמן רב יותר (איור 1). משמעות הדבר היא שאם אמצעים לשיגור תרופות יוכלו לשמור את התרופות לטיפול בסרטן בתוך עצמם עד שיגיעו לתוך הגידול, זה עשוי להיות המפתח לטיפול ממוקד בסרטן, כאשר שיגור התרופות יתבצע ישירות לתוך התאים הסרטניים ולא לתוך תאים בריאים.
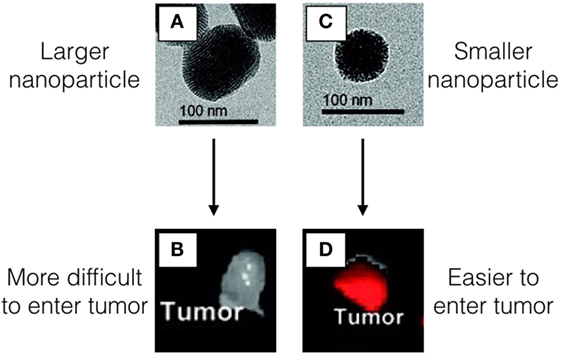
- איור 1
- תמונות A ו-C מראות את הננו-חלקיקים כפי שהם נראים דרך מיקרוסקופ מיוחד שנקרא מיקרוסקופ אלקטרונים חודר (TEM – transmission electron microscope), אשר מאפשר לנו לראות פריטים קטנים מאוד.
- הננו-חלקיקים שב-A גדולים יותר מהננו-חלקיקים שב-C. שני הננו-חלקיקים מחזיקים בתוכם מולקולות שגורמות להם לזרוח בצבע אדום מתחת לאור מיוחד. לננו-חלקיקים הגדולים יותר ב-A קשה להיכנס לתוך הגידול, כפי שניתן לראות ב-B, אולם החלקיקים הקטנים יותר ב-C מסוגלים להיכנס לתוך הגידול ולהישאר בתוכו, כפי שניתן לראות ב-D. אנו יודעים שישנם יותר ננו-חלקיקים קטנים מאשר ננו-חלקיקים גדולים בתוך הגידול מאחר שהגידול שמוצג ב-D זוהר באור אדום חזק יותר מאשר הגידול ב-B, כאשר מאירים את שניהם באור המיוחד שגורם לננו-חלקיקים לזרוח.
אמצעים לשיגור תרופות שעשויים מננו-חלקיקים
בהתבסס על מה שאנו יודעים לגבי המאפיינים של תאים סרטניים ושל גידולים, ישנן כמה דרישות לפיתוח של אמצעים לשיגור תרופות. ראשית, האמצעים לשיגור התרופות צריכים להיות מיוצרים מחומרים שאינם מזיקים לאדם המקבל את התרופות. שנית, האמצעים לשיגור התרופות צריכים להיות קטנים מספיק כדי להיכנס לגידול דרך קולטני פני השטח שעל התאים ודרך כלי הדם. שלישית, האמצעים לשיגור תרופות צריכים לשאת את התרופה לטיפול בסרטן ולשמור אותה בתוכם עד שהם מגיעים לתא הסרטני, היכן שהתרופה צריכה להיות משוחררת. דרישה רביעית, שאינה הכרחית עבור מטופלים אבל הכרחית עבור מדענים שרוצים לחקור את האמצעים לשיגור תרופות, היא שאנו צריכים להיות מסוגלים לעקוב אחרי האמצעים האלה בדרך כלשהי, כדי לדעת לאן הם מגיעים בתוך הגוף ואם הם מצליחים להיכנס לתוך התאים הסרטניים.
בניסויים אלה מדענים השתמשו בסוג של אמצעים לשיגור תרופות אשר נקרא ננו-חלקיקים. ננו-חלקיקים הם חלקיקים זעירים מאוד (קטנים בערך פי 1,000 מקוטרהּ של שערה בודדת!). הננו-חלקיקים בהם השתמשו במחקר זה עשויים מסיליקה, סוג של זכוכית, ויש להם נקבוביות או חורים קטנים מאוד, בדומה לספוג, שבתוכם התרופה יכולה להיות מאוחסנת.
אנו יודעים שככל שננו-חלקיקים קטנים יותר, כך הם נשארים יותר בקלות בתוך הגידול [2]. שחרור של התרופות מתוך הננו-חלקיקים שנמצאים בתוך הגידול עצמו יכול לאפשר לגידול לקבל מינון גדול יותר של התרופה נגד סרטן. מאחר שהננו-חלקיקים הם כמו ספוֹגים קטנים, אנו יכולים להכניס לתוכם תרופות בקלות. אולם, אם התרופה לא נשארת בתוך הננו-חלקיק עד שהוא מגיע אל הגידול, אז ברגע שהמטופל יקבל מינון מסוים של הננו-חלקיקים התרופה תתחיל בהדרגה לזלוג החוצה! במצב כזה התאים הבריאים לא יהיו מוגנים ולא נצליח להעביר מינון גבוה של התרופה ישירות לתוך הגידול.
אסטרטגיה אחת שבה אנחנו יכולים להשתמש כדי לשמור את התרופה בתוך הננו-חלקיקים עד שהם יגיעו לגידול היא לחבֵּר כמה מולקולות אל פני השטח של הננו-חלקיקים כדי לחסום את הפתחים הקטנים שב”ספוג“ – מולקולות אלה נקראות מולקולות שוֹעֵר (Gatekeeper molecules). אם אנחנו מתכננים את מולקולות השוער כך שהפתחים שבננו-חלקיקים יהיו חסומים לחלוטין, התרופות לא יוכלו לדלוף החוצה. אנו יכולים ליצור מולקולות שוער שמסוגלות לשנות את צורתן בתנאים שונים, כך שכאשר הננו-חלקיקים מגיעים אל הגידול מולקולות השוער ”פותחות“ את הנקבוביות, והתרופה יכולה להיות משוגרת. אם מולקולות השוער לא מצליחות לחסום לחלוטין את הפתחים, או אם הן משנות את צורתן לפני ההגעה אל הגידול, חלק מהתרופה ידלוף החוצה, לכן חשוב שהשוער יהיה מתוכנן היטב.
אחת הדרכים שבהן אנחנו יכולים לשנות את הצורה של מולקולות השוער האלה היא באמצעות חימומן. עבור הניסוי הזה אנו השתמשנו במכשיר מיוחד שנקרא ”מכשיר חימום השראתי“ (Inductive heating machine). בתוך המכשיר הזה יש סליל מיוחד בו זורם זרם חשמלי, והזרם יוצר שדה מגנטי סביב לסליל. אם שָׂמִים פריט מתכתי כמו מברג בתוך הסליל הוא יכול לחמם את המתכת לטמפרטורה גבוהה מאוד.
למרבה המזל, איננו נדרשים לחמם הרבה את הננו-חלקיקים כדי לגרום למולקולות השוער לשנות את צורתן. לכן, אם אנו שָׂמִים חתיכת מתכת קטנה בתוך הננו-חלקיק, אנו יכולים להשתמש במכשיר החימום ההשראתי הזה כדי לחמם בעדינות את אזור הגידול ולשנות את הצורה של מולקולות השוער עד לטמפרטורה שבה הנקבוביות יפתחו והתרופות ישוגרו, וזאת בלי לשרוף תאים בריאים או להרוג אותם (איור 2).
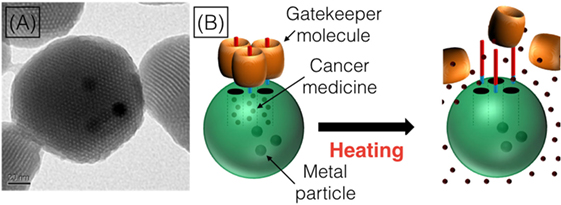
- איור 2
- שימוש במולקולות השוער עבור שיגור תרופות.
- מיקרוסקופ האלקטרונים החוֹדר (TEM) מאפשר לנו לראות כיצד נראים הננו-חלקיקים. (A) בננו-חלקיקים יש חורים (כך אנו יכולים להכניס לתוכם את התרופות לטיפול בסרטן!), והנקודות הכהות במרכז הננו-חלקיק הן חתיכות מתכת קטנטנות שאנו מכניסים לתוכו. האופן שבו פועלים הננו-חלקיקים, כפי שניתן לראות ב-B, הוא שאנו ממלאים אותם בתרופה (המוצגת כנקודות שחורות) ואז חוסמים את החורים עם מולקולות השוער (החביות הכתומות). לאחר מכן, כשהננו-חלקיקים מגיעים לתוך תאי הסרטן, אנו יכולים להשתמש בחוֹם כדי לגרום למולקולות השוער לזוז הצידה מהננו-חלקיקים, כך שהחורים הקטנים כבר לא יהיו חסומים והתרופות לטיפול בסרטן יוכלו לדלוף מהננו-חלקיקים אל תוך התא הסרטני.
לבסוף, אנו יכולים לגרום לננו-חלקיקים שלנו להיות פלואורסצנטיים (כלומר במקרה זה לזרוח בצבע ירוק כשנאיר עליהם עם אור מיוחד), כך שנוכל להשתמש במיקרוסקופ כדי לראות היכן הם נמצאים. זה מאפשר לנו לעקוב אחריהם ולראות אם הם מסוגלים להיכנס לתוך הגידול.
הניסוי
ברגע שהצלחנו להשלים את ייצור הננו-חלקיקים עם כל התכונות הנ“ל (תרופה לטיפול בסרטן בתוכם, מולקולות שוער בפני השטח שלהם וחלקיקים מתכתיים זעירים בתוכם) השתמשנו בהם כדי לבחון מה קורה בתוך תאי הסרטן. עבור הניסוי הזה לא השתמשנו בחיה או בבן אדם שיש להם סרטן, אלא במקום זאת בחנו את הננו-חלקיקים על תאים של סרטן הַשָּׁד שיכולנו לגדל במעבדה. ניסינו שלושה תנאים שונים עם תאי סרטן השד. קבוצה אחת של תאים קיבלה ננו-חלקיקים עם תרופה אבל לא קיבלה חימום השראתי, קבוצה שנייה קיבלה ננו-חלקיקים בלי תרופה בתוכם, אך כן קיבלה חימום השראתי, והקבוצה השלישית קיבלה גם ננו-חלקיקים עם תרופה וגם חימום השראתי [3].
באיור 3 אתם יכולים לראות באפור את קו הַמִּתְאָר של תאי סרטן השד. הנקודות הצהובות-ירוקות הן הננו-חלקיקים שלנו, והנקודות האדומות הן התרופה לטיפול בסרטן שהשתחררה מהננו-חלקיקים ונכנסה לתוך התאים. קיווינו שכאשר נשתמש בננו-חלקיקים שמכילים את התרופה בתור אמצעי לשיגור תרופות, נראה שתאי הסרטן מתים!
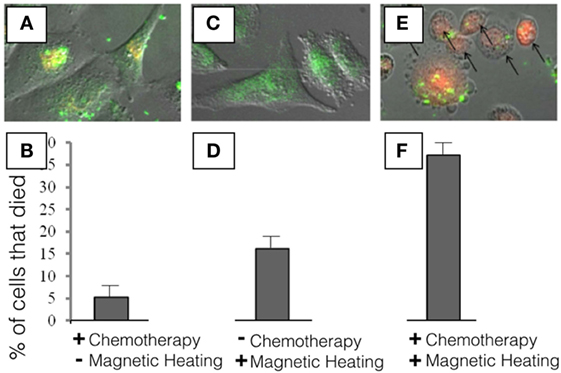
- איור 3
- בניסוי זה השתמשנו בתאי סרטן השד כדי לראות מה קורה כשמכניסים את הננו-חלקיקים לתוך התאים הסרטניים.
- השתמשנו בתרופה לסרטן שנקראת דוֹקסוֹרוּבּיצין, ונראית בצבע אדום דרך המיקרוסקופ. A ו-B – תרופה וננו-חלקיקים, ללא חימום השראתי. הננו-חלקיקים נראים בתור נקודות ירוקות מאחר שהוספנו להם צבע ירוק שמאפשר לנו לראות לאן הם מגיעים בתוך התאים, והנקודות האדומות הן התרופה לטיפול בסרטן. כ- 5% מהתאים מתו בתנאים האלה. C ו-D – ננו-חלקיקים ללא תרופה, עם חימום השראתי. ב-C אין נקודות אדומות מאחר שלא הוספנו את התרופה לטיפול בסרטן, אולם הנקודות הירוקות שבתוך התאים אומרות לנו שהננו-חלקיקים הצליחו להיכנס לתוך התאים. ב-5 הדקות הראשונות של החימום כבר היה מספיק חום כדי להרוג כ-17% מתאי סרטן השד ב-D, אף על פי שהננו-חלקיקים האלה לא הכילו שום תרופה. זה מאחר שהחום שנוצר בעזרת חלקיקי המתכת הזעירים שהוטבעו בננו-חלקיקים הספיק כדי להרוג חלק מהתאים E ו-F – ננו-חלקיקים עם תרופה, עם חימום השראתי. אנחנו יכולים לראות שהננו-חלקיקים הצליחו להיכנס לתאים (הנקודות הירוקות שבתוך התאים), ושהתרופה לטיפול בסרטן הצליחה להשתחרר מהננו-חלקיקים ונכנסה לתאים (הנקודות האדומות בתוך התאים). אנחנו גם רואים שצורת תאי הסרטן השתנתה רבות. במקום להיות ארוכה כמו ב-A וב-C, צורת התאים נהייתה עגולה, מה שמעיד על כך שהתאים עומדים למות. בניסוי אחרון זה השתמשנו בננו-חלקיקים שהכילו את התרופה לטיפול בסרטן, והפעלנו את המחמם ההשראתי שלנו למשך 5 דקות. אנחנו יכולים לראות שבמקרה הזה F, בסביבות 37% מתאי הסרטן מתו.
כשהכנסנו את הננו-חלקיקים לתאים בלי להפעיל את מכשיר החימום ראינו שבסביבות 5% מתאי הסרטן מתו (ראו איור 3 משמאל). משמעות הדבר היא שחלק מהתרופה לטיפול בסרטן דלפה מהננו-חלקיקים. במרכז איור 3 ניתן לראות את המקרה שבו הכנסנו לתאים את הננו-חלקיקים ללא התרופה, אלא רק עם חלקיקי מתכת זעירים שמושתלים בתוכם. כששמנו את התאים האלה בתוך מכשיר החימום למשך 5 דקות ראינו שבסביבות 17% מהתאים מתו. משמעות הדבר היא שאפילו ללא התרופה הננו-חלקיקים פלטו מספיק חום כדי להרוג חלק מתאי סרטן השד. לבסוף, כאשר שילבנו את התרופה לטיפול בסרטן עם חלקיקי המתכת הזעירים ועם חימום התאים, ראינו ש-37% מהתאים מתו. יכולנו לראות את התרופה בתוך התאים (באדום) ויכולנו לראות שהתאים נעשו עגולים, מה שמהווה סימן למותו הַקָּרֵב של התא.
מסקנות
הניסויים הראו לנו שהאמצעי לשיגור תרופות שלנו, העשוי מננו-חלקיקים, הוא התחלה מבטיחה עבור שיגור תרופות לטיפול בסרטן לתוך תאים סרטניים, אולם עלינו עדיין לשפר את המערכת. אנו יכולים לעצב מחדש את הננו-חלקיקים כדי לוודא שהתרופה לטיפול בסרטן לא תדלוף מתוכם לפני שהם מגיעים אל התאים הסרטניים. אנו יכולים גם לנסות להפחית את משך הזמן של הפעלת מכשיר החימום ההשראתי כדי למצוא טווח ביטחון שיבטיח כי תאים בריאים לא ימותו גם הם בשל החום שהופעל. אמנם ישנם אמצעים אחרים לשיגור תרופות שעשויים מננו-חלקיקים וכבר נמצאים בשימוש בטיפולים בחולי סרטן, אולם השיטה שלנו זקוקה לפיתוח נוסף לפני שנוכל לבחון אותה על מטופלים. אם האמצעי לשיגור תרופות שלנו יהפך לאחת מהאפשרויות לטיפול בחולי סרטן, אנו מקווים שהמטופלים יחוו פחות תופעות לוואי שליליות של הכימותרפיה מאשר במקרים שבהם הכימותרפיה ניתנת בדרך הרגילה. אולי השינוי הגדול הבא בטיפול בסרטן יהיה פתרון קטן בגודל ננומטרי!
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Hanahan, D., and Weinberg, R. A. 2000. The hallmarks of cancer. Cell 100(1):57–70. doi:10.1016/S0092-8674(00)81683-9
[2] ↑ Meng, H., Xue, M., Xia, T., Ji, X., Tarn, D. Y., Zink, J. I., et al. 2011. Use of size and a copolymer design feature to improve the biodistribution and the enhanced permeability and retention effect of doxorubicin-loaded mesoporous silica nanoparticles in a murine xenograft tumor model. ACS Nano 5(5):4131–44. doi:10.1021/nn200809t
[3] ↑ Thomas, C. R., Ferris, D. P., Lee, J. H., Choi, E., Cho, M. H., Kim, E. S., et al. 2010. Non-invasive remote-controlled release of drug molecules in vitro using magnetic actuation of mechanized nanoparticles. J. Am. Chem. Soc. 132(31):10623–5.
