Résumé
Le méningocoque est une bactérie qui peut provoquer une maladie très sévère. Le développement d’un vaccin efficace a été extrêmement difficile. Les vaccins anti-méningococciques développés dans les années 1990 sont orientés contre la capsule de la bactérie. Celle-ci constitue un bouclier qui la protège mais peut également servir de cible à notre corps afin de lutter contre la terrible maladie qu’elle provoque. Ces vaccins peuvent agir contre quatre types de méningocoques : A, C, W et Y. Cependant, ils ne permettent pas de se défendre contre le méningocoque B. Des scientifiques ont dû imaginer un nouveau moyen de fabriquer des vaccins, en cherchant dans l’ADN bactérien d’autres potentielles cibles vaccinales. Avec cette nouvelle approche, appelée vaccinologie inverse, trois nouveaux composants bactériens ont été découverts : NadA, NHBA et fHbp. Associés à un quatrième composant (PorA), ils forment le vaccin 4CMenB. Ce vaccin a réduit de 75 % les infections à méningocoque chez les nourrissons au Royaume-Uni. Aujourd’hui, 4CMenB protège les enfants du monde entier.
Bien pire qu’un simple mal de tête
Vous n’en avez peut-être jamais entendu parler, mais il existe une bactérie dangereuse appelée Neisseria meningitidis, également connu sous le nom de méningocoque. Habituellement, le méningocoque vit tranquillement dans notre nez sans entraîner de symptôme. Lorsque nous sommes fragilisés, la bactérie peut passer dans la circulation sanguine et causer la maladie qui lui est associée.
Le méningocoque peut être à l’origine d’une maladie très grave, la méningite. Au départ, le malade peut présenter de la fièvre, des vomissements et des maux de tête, comme dans une simple grippe. Ensuite, la bactérie voyage dans le corps et se multiplie très rapidement, atteignant le sang et les organes, y compris le cerveau (Figure 1).
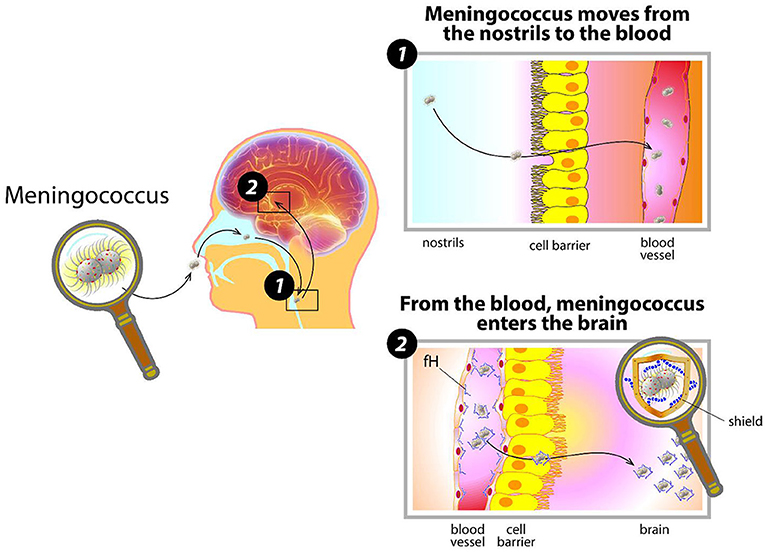
- Figure 1 - Dissémination du méningocoque dans l’organisme.
- Le méningocoque entre par le nez, entre en contact avec les cellules à l’intérieur des narines et pénètre dans le sang. Recouvert de sa capsule et déguisé en s’enrobant de protéines humaines (comme fH), il échappe aux défenses de l’organisme et se multiplie. Lorsque le méningocoque atteint les organes, comme le cerveau, il cause de graves dommages.
La méningite à méningocoque peut entraîner la mort en quelques heures. Pour ceux qui survivent, certains présenteront des handicaps physiques, souvent secondaires à des amputations, et/ou des handicaps mentaux, liés aux dommages cérébraux. Les enfants sont particulièrement vulnérables au méningocoque et des handicaps définitifs peuvent survenir dans la moitié des cas. Alors pourquoi n’avez-vous jamais entendu parler d’une bactérie aussi effrayante ? Parce que ce n’est pas très fréquent. La maladie est surtout présente en Afrique subsaharienne où elle touche 30 000 personnes chaque année. Par ailleurs, le méningocoque peut se manifester dans le monde entier, apparaissant sous forme de séries de cas (il est fréquent dans les rassemblements de jeunes adultes comme les collèges ou les discothèques) ou de grandes épidémies. Comment éviter de contracter cette maladie ? Par la vaccination !
Trouver le point faible
A quoi ressemble le méningocoque ? Comme toutes les autres cellules, elle est entourée d’une membrane sur laquelle se trouvent de nombreuses molécules, appelées antigènes. Ces antigènes aident la bactérie à se fixer dans notre nez et à survivre dans notre corps. Les méningocoques possèdent un bouclier, appelé capsule, qui recouvre cette membrane et les protège des défenses de notre organisme. Il faut un certain temps au corps humain pour préparer ses défenses contre le méningocoque. Cependant, quand le corps est prêt à détruire la bactérie, il est généralement déjà trop tard : le méningocoque se multiplie rapidement dans le sang, pénètre dans les organes comme le cerveau et cause des dégâts souvent irréversibles.
La capsule, qui constitue le principal mécanisme de défense de cette bactérie, peut aussi devenir notre meilleure arme contre le méningocoque. En effet, des scientifiques ont découvert que lorsque nous injections une partie de cette capsule à une personne en bonne santé, son corps apprend à vaincre le méningocoque. Ce serait comme montrer l’identité d’un futur voleur à la police, afin qu’elle puisse l’arrêter avant qu’il ne vole. C’est comme ça que fonctionne la vaccination.
Si nous continuons dans le même parallèle, les cellules appelées lymphocytes B constitueraient une partie des forces de l’ordre de notre corps, nécessaire à la protection contre le méningocoque. Les lymphocytes B produisent des molécules appelées anticorps. Les anticorps sont libérés dans le sang et s’accrochent aux bactéries nuisibles, comme des étiquettes. Après les avoir étiquetées, le corps peut détruire les bactéries avant qu’elles ne causent des dommages.
Histoire des vaccins contre le méningocoque
Les premiers vaccins contre le méningocoque étaient composés d’antigènes de la capsule bactérienne. Ils ne protégeaient que les adultes et pendant une courte période. Chez les enfants, qui représentent la population la plus vulnérable face à cette maladie, ces vaccins n’étaient pas efficaces. En effet, les antigènes de la capsule seuls ne peuvent recruter que des lymphocytes B, mais ils ne font pas appel à d’autres cellules de défense, appelées lymphocytes T. Ces derniers sont des éléments essentiels de la réponse contre les micro-organismes, chez l’enfant comme chez l’adulte. Les lymphocytes T ne produisent pas d’anticorps mais indiquent aux lymphocytes B comment fabriquer des anticorps plus précis, pendant une plus longue période et en plus grande quantité. Ils agissent un peu comme les entraîneurs des lymphocytes B. Grâce à ces lymphocytes T, notre corps peut se souvenir d’un micro-organisme pendant des années. Ainsi, lorsque le même micro-organisme se représente, le corps pourra le combattre plus rapidement et plus efficacement que lors du premier contact. Alors comment protéger les enfants si la capsule ne suffit pas ?
Des scientifiques ont résolu ce problème dans les années 1990. En utilisant un processus chimique, ils ont lié des antigènes de la capsule à une autre molécule, une protéine, très attractive pour les lymphocytes T [1]. Cette molécule provient d’autres bactéries nuisibles, telles que les bactéries associées à la diphtérie ou au tétanos. Elle est appelée protéine porteuse car elle présente la capsule aux lymphocytes T. De cette façon, le vaccin peut stimuler à la fois les lymphocytes B et T. Cette idée brillante a conduit à la création de ce qu’on appelle les vaccins conjugués. De nos jours, ces vaccins sont utilisés couramment et dans le monde entier.
Cependant, le méningocoque est un maître en déguisement. En effet, la capsule peut être de différents types : A, B, C, W et Y. Si le corps crée des anticorps spécifiques contre l’un des types, ils ne protègent pas contre les autres. Pour être protégé contre les différents types, notre corps doit apprendre à reconnaître les cinq variantes de la capsule. Les vaccins conjugués sont hautement protecteurs contre les types A, C, W et Y. Mais qu’en est-il du type B ? Eh bien, le méningocoque avait plus d’un tour dans son sac…
Méningocoque b : la dernière étape
Le développement d’un vaccin contre le méningocoque B a représenté l’un des grands défis de la médecine moderne [2, 3]. Le méningocoque B représente encore un problème majeur de santé publique aux USA, au Canada, en Europe, en Asie et dans de nombreux autres pays. La difficulté vient du fait que la capsule du type B n’entraîne pas de production d’anticorps, même avec la technologie des vaccins conjugués. Le méningocoque B utilise une stratégie sophistiquée: sa capsule imite les molécules présentes sur nos cellules, de sorte qu’elle puisse être identifiée comme une cellule de notre propre corps. De ce fait, en s’attaquant à la capsule du méningocoque B, l’organisme endommagerait aussi ses propres cellules. Par conséquent, le système immunitaire ne réagit pas contre le méningocoque de type B. De nombreux scientifiques ont conclu qu’utiliser la capsule pour lutter contre cette bactérie serait trop risqué. Une nouvelle technologie s’est révélée nécessaire pour relever ce défi.
Une révolution inversée
Si un problème ne peut pas être résolu en utilisant des méthodes bien connues, il faut inventer quelque chose de nouveau! Au lieu de chercher quelque chose de clairement visible à l’extérieur de la bactérie, comme sa capsule, certains scientifiques ont décidé d’étudier la bactérie plus en profondeur, en examinant son ADN. L’ADN est comme un catalogue de tous les composants bactériens qui remplissent les fonctions de la bactérie. À l’aide d’équipements de laboratoire modernes, l’ADN peut être lu comme un texte, exactement comme vous le faites avec cet article (plus de 2 milliards de lettres et plus de 2 000 mots sont contenus dans l’ADN de la bactérie!). En lisant, vous pouvez reconnaître des mots que vous ne connaissez pas et rechercher leur signification à l’aide d’un dictionnaire. C’est exactement ce qui s’est passé pour le méningocoque B. Ces scientifiques ont lu son ADN pour trouver des antigènes bactériens encore inconnus qui, comme la capsule des autres types, pourraient devenir des cibles pour les défenses de l’organisme et composer le nouveau vaccin. Cette approche fut nommée vaccinologie inverse (Figure 2). Elle représente une révolution dans le domaine de la vaccinologie.
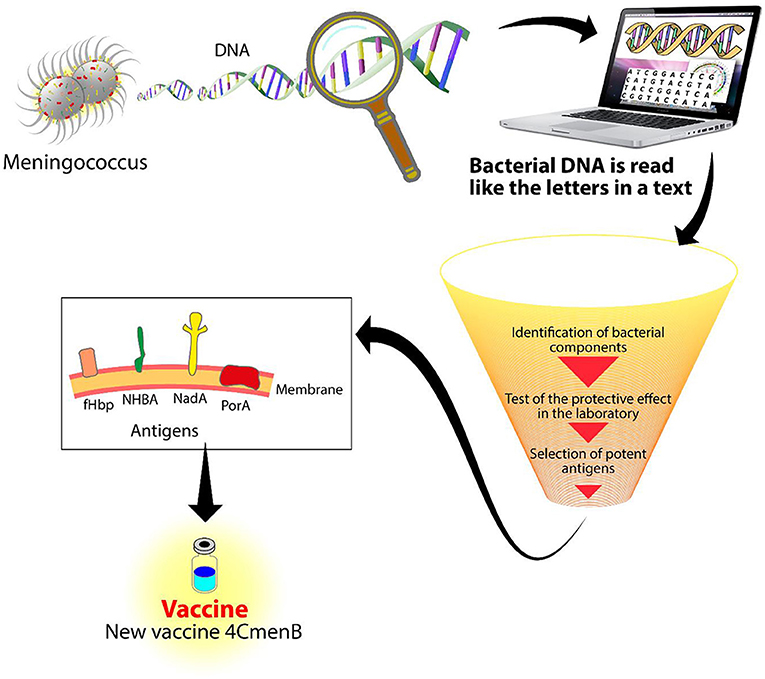
- Figure 2 - Vaccinologie inverse.
- L’ADN du méningocoque est lu par une machine appelée séquenceur. À l’aide de programmes informatiques sophistiqués, l’ADN est analysé pour identifier de nouveaux composants à utiliser pour un vaccin. Après de nombreuses expériences, trois antigènes ont été identifiés comme potentiellement protecteurs contre le méningocoque B : NadA, NHBA et fHbp. Associés à un quatrième antigène, PorA, ils forment le vaccin 4CMenB.
Des algorithmes informatiques sophistiqués ont été utilisés pour analyser l’ensemble de l’ADN du méningocoque de type B. Plusieurs mois de travail ont été nécessaires pour passer de 2000 à 600 antigènes potentiels et enfin aux trois meilleurs [4]. Les trois composants retenus sont NadA, fHbp et NHBA.
Ces trois antigènes jouent un rôle important dans la capacité du méningocoque B à provoquer la maladie (Figure 3A). NadA est un antigène collant qui sert de point d’ancrage à la bactérie lui permettant de se coller aux parois internes des narines humaines. Lorsque la bactérie traverse les cellules nasales et pénètre dans la circulation sanguine, elle se multiplie et peut atteindre tous les organes. Pour circuler dans le sang sans être agressé par les anticorps, le méningocoque a développé plusieurs mécanismes afin de tromper les défenses de l’organisme. Le méningocoque utilise le fHbp et le NHBA comme colle pour enduire sa surface de substances normalement produites par le corps humain, le rendant ≪invisible≫ par l’organisme. Cependant, maintenant que nous connaissons ces astuces, nous pouvons demander au système immunitaire de produire des anticorps contre NadA, fHbp et NHBA. Ainsi, nous pouvons compromettre le mécanisme de déguisement du méningocoque. En combinant ces trois composants avec un quatrième composant, PorA, le premier vaccin contre le méningocoque B, appelé 4CMenB, est né.
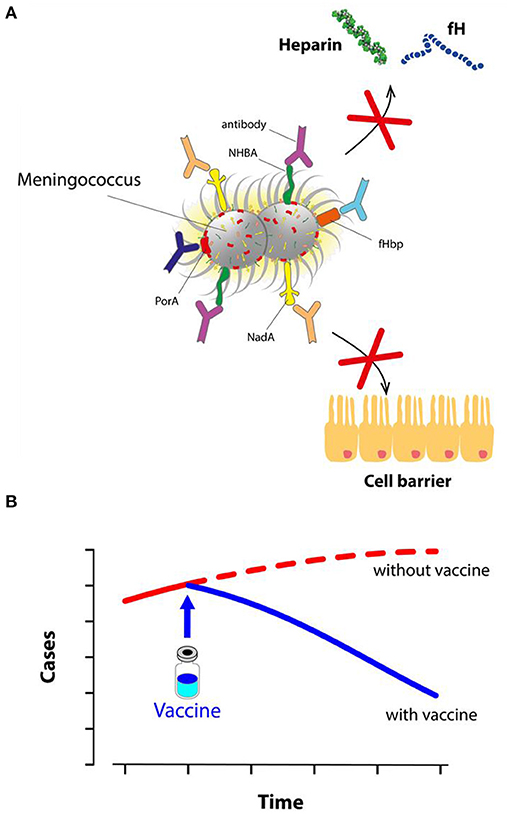
- Figure 3 - Protection vaccinale contre le méningocoque B.
- (A) Après la vaccination par 4CMenB, l’organisme produit des anticorps contre le méningocoque. Les anticorps bloquent NadA, limitant la capacité du méningocoque à envahir les cellules. D’autres anticorps bloquent la fHbp et la NHBA, empêchant la bactérie de se coller aux protéines humaines (comme la fH et l’héparine) et stoppant ainsi le mécanisme de déguisement. Enfin, d’autres anticorps bloquent également PorA et d’autres antigènes. Couvert d’anticorps, le méningocoque B est inoffensif et rapidement détruit. (B) Après son introduction au Royaume-Uni en 2015, l’utilisation du vaccin 4CMenB a considérablement réduit le nombre de cas de maladies associées au méningocoque B chez les jeunes enfants.
Sauver les enfants du méningocoque b
Le Royaume-Uni a été le premier pays à décider de protéger ses enfants avec le nouveau vaccin 4CMenB. Celui-ci a été introduit dans un programme national de vaccination en 2015 [5]. Au cours des 5 années qui ont suivi, environ 5 millions d’enfants au Royaume-Uni ont été vaccinés avec ce nouveau vaccin. Comme le montre la figure 3B, l’utilisation de 4CMenB a permis d’éviter un cas de maladie associée au méningocoque tous les 4 jours! Actuellement, le vaccin 4CMenB est disponible dans 42 pays et protège des milliers de nourrissons, d’enfants et d’adolescents à travers le monde.
Remerciements
Nous remercions Giorgio Corsi pour le travail artistique.
Déclaration d’utilisation des outils d’IA
Tout texte alternatif fourni avec les figures de cet article a été généré par Frontiers grâce à l’intelligence artificielle. Des efforts raisonnables ont été déployés pour garantir son exactitude, notamment par une relecture par les auteurs lorsque cela était possible. Si vous constatez des problèmes, veuillez nous contacter.
Contributions à la version française
TRADUCTEUR: Loïc De Doncker
Glossaire
Vaccin: ↑ substance administrée à une personne pour prévenir une maladie infectieuse spécifique causée par un micro-organisme spécifique.
Antigène: ↑ composant d’un micro-organisme qui sert de cible pour les défenses de l’organisme.
Capsule: ↑ bouclier qui entoure une bactérie et la protège du système immunitaire.
Anticorps: ↑ molécules qui se lient aux antigènes, comme ceux de la capsule bactérienne. Ils indiquent au reste du système immunitaire quels sont les micro-organismes à détruire.
Protéine Porteuse: ↑ molécule, couplée à un antigène, qui permet d’attirer plus de cellules du système immunitaire, y compris les lymphocytes T. Elle est utilisée dans les vaccins conjugués.
Vaccin Conjugué: ↑ vaccin composé d’un antigène de la capsule bactérienne attachée à une protéine porteuse. Il peut activer à la fois les lymphocytes B et T. Il protège les enfants contre les méningocoques de type A, C, W et Y.
Vaccinologie Inverse: ↑ étude de l’ADN d’un organisme pour identifier de nouveaux composants pour les vaccins. A permis la découverte d’un vaccin efficace contre le méningocoque de type B.
Conflit d’intérêts
SP, VM, MP et RR sont des employés à plein temps du groupe GSK. Ce travail a été financé par GlaxoSmithKline Biologicals SA, une entreprise qui détient un intérêt financier direct dans la production et la commercialisation de vaccins.
Références
[1] ↑ Micoli, F., Del Bino, L., Alfini, R., Carboni, F., Romano, M. R., and Adamo, R. 2019. Glycoconjugate vaccines: current approaches towards faster vaccine design. Expert Rev. Vaccines 18:881–95. doi: 10.1080/14760584.2019.1657012
[2] ↑ Rappuoli, R., Pizza, M., Masignani, V., and Vadivelu, K. 2018. Meningococcal B vaccine (4CMenB): the journey from research to real world experience. Expert Rev. Vaccines 17:1111–21. doi: 10.1080/14760584.2018.1547637
[3] ↑ Masignani, V., Pizza, M., and Moxon, E. R. 2019. The development of a vaccine against meningococcus B using reverse vaccinology. Front. Immunol. 10:751. doi: 10.3389/fimmu.2019.00751
[4] ↑ Pizza, M., Scarlato, V., Masignani, V., Giuliani, M. M., Aricò, B., Comanducci, M., et al. 2000. Identification of vaccine candidates against serogroup B meningococcus by whole-genome sequencing. Science 287:1816–20. doi: 10.1126/science.287.5459.1816
[5] ↑ Ladhani, S. N., Andrews, N., Parikh, S. R., Campbell, H., White, J., Edelstein, M., et al. 2020. Vaccination of infants with meningococcal group B vaccine (4CMenB) in England. N. Engl. J. Med. 382:309–17. doi: 10.1056/NEJMoa1901229
