摘要
脑瘤是大脑细胞的异常增殖, 可分为恶性与良性。作为神经外科医生, 我的职责是通过手术切除患者脑中的有害肿瘤。此外, 我还是多伦多大学的教授, 专门在实验室中研究脑瘤, 希望帮助开发新的治疗方法和诊断工具, 改善患者治疗方式及效果。本文将介绍脑瘤的基本知识、常规诊疗方法, 以及我们为推动神经外科发展的后续规划。
Gelareh Zadeh 博士荣获 2023 年“加拿大盖尔德纳动力奖”, 以表彰她在脑瘤分子层面认知的突破性贡献。她的研究推动了脑瘤识别、分类和管理方式的革新, 有望显著提升面向脑瘤患者的医疗诊治水平。
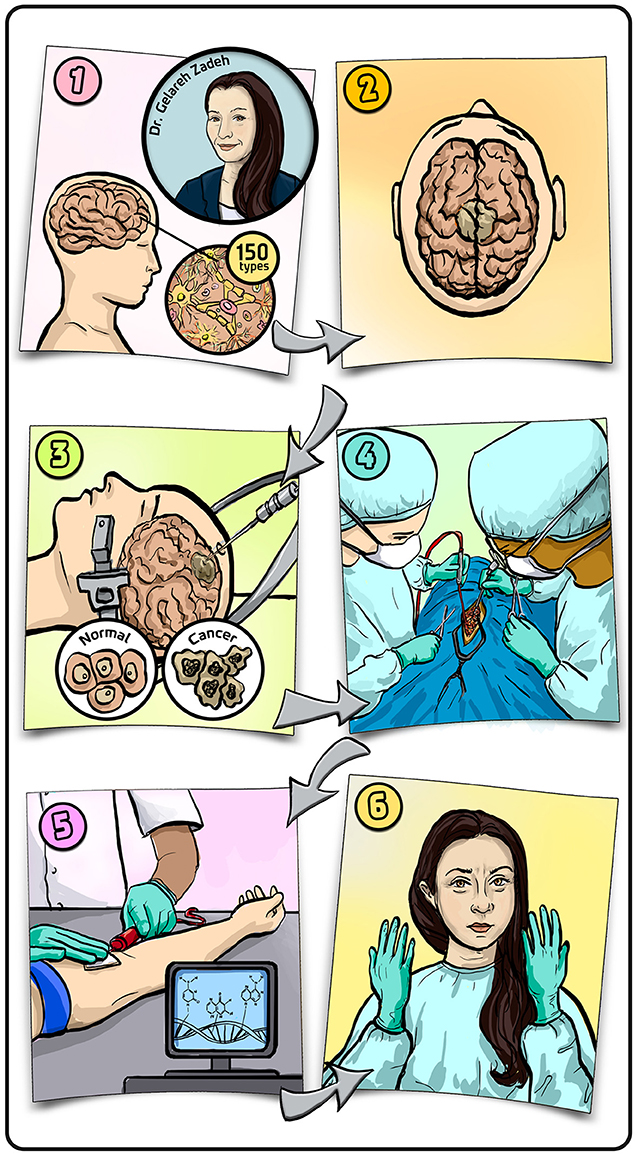
- 图文摘要 - (1) 脑瘤共有 150 多种, 根据其来源细胞种类及是否癌变进行区分。
- (2) 大脑中的肿瘤表现为异常增生的细胞团块。(3) 为确定肿瘤是否癌变, 患者需接受活检, 即通过手术切除部分组织并进行实验室分析。(4) 若确诊为恶性肿瘤, 患者将接受肿瘤切除手术。(5) 我们希望能用验血替代活检, 精准诊断每位患者的肿瘤类型。(6) 作为神经外科医生, 最让我着迷的还是戴上手套那一刻, 大脑进入全神贯注的工作模式。插图: Iris Gat。
什么是脑瘤?
大脑是极其珍贵的器官, 它决定我们的个性与行为模式, 将我们塑造为独特个体。同时, 大脑也非常脆弱, 其功能可能受多种因素的影响。脑瘤, 即大脑细胞的异常增殖, 便是改变脑功能的因素之一。现有超过 150 种脑瘤 [1]。由于大脑由多种细胞构成, 脑瘤可形成于其中任何一种细胞。部分脑瘤属于良性(非癌性), 不会在大脑内扩散。这类肿瘤通常是脱离正常生长模式的细胞团, 会对所在的大脑区域产生压迫。另一些肿瘤则为恶性(癌性), 能够在大脑内快速生长和扩散。
包括我在内的大多数神经外科医生日常主要处理约 8-10 种常见脑瘤。其中最常见的有胶质母细胞瘤和胶质瘤(具有侵袭性的恶性肿瘤)、脑膜瘤(通常形成于脑膜组织的良性肿瘤), 以及垂体瘤(虽然非癌性, 但可能压迫视神经, 导致视力问题)。最具挑战性的当属包裹神经或血管的肿瘤, 切除时可能损伤神经功能或引发脑出血, 这类手术需在显微镜下精细操作。未包裹神经或血管的肿瘤通常可通过手术成功切除。
如何诊断并治疗脑瘤?
脑瘤患者通常因脑功能异常就医(图 1A), 主要表现为视力或听力障碍、记性不好、肢体运动困难或癫痫等症状。医生会为患者进行脑部扫描, 常用的是基于 X 射线的计算机断层扫描(CT)。若 CT 发现可疑病变, 将采用更精细的磁共振成像(MRI)技术进行详细扫描(图 1B)。通过 MRI 影像, 神经外科医生可确认是否存在脑瘤并初步判断其类型。为确认诊断结果, 患者通常需接受活检, 通过手术切除部分疑似肿瘤的组织, 然后送往病理实验室分析(图 1C)。
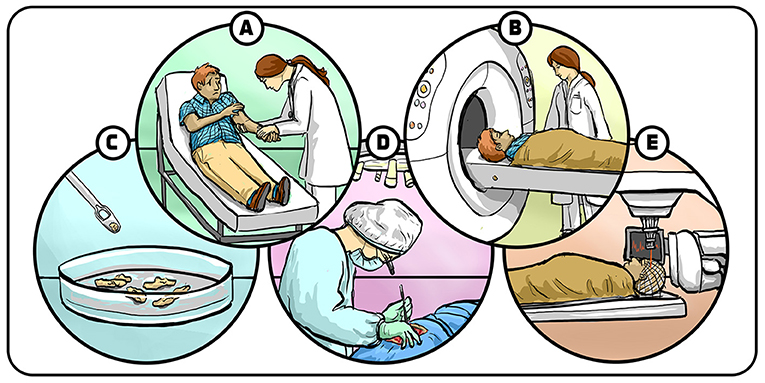
- 图 1 - 脑瘤诊断与治疗。
- (A) 脑瘤患者常因肢体活动障碍等脑部相关症状就医; (B) 接受脑部扫描检查; (C) 通过活检确定肿瘤类型与性质; (D) 若为恶性肿瘤则进行手术切除; (E) 术后辅以放疗和化疗, 清除残余肿瘤细胞。插图: Iris Gat。
对于不累及神经细胞和血管等关键脑结构的良性肿瘤, 手术切除后通常不会复发。但恶性肿瘤的情况更为复杂: 脑癌会向不同脑组织扩散, 往往无法完全切除。医生一般通过手术安全切除部分肿瘤(图 1D), 然后对剩余肿瘤进行放疗和化疗等处理, 以缩小或消除残留病灶(图 1E)。尽管神经外科和肿瘤医生竭尽全力, 脑瘤有时仍会复发。目前, 我的科室中约有 30% 的患者需要接受多次手术。现代手术技术精准高效, 并且对脑组织损伤较小, 术后恢复过程较以往更轻松, 因此可实施多次手术。作为神经外科医生, 我一直希望改善手术效果, 并寻找可减轻手术、放疗及化疗副作用的治疗方法。
我们能通过验血诊断脑癌吗?
目前, 脑癌诊断依赖活检, 但脑部活检需进行开颅手术, 存在风险, 易引发患者焦虑, 因此我们正在寻找更简便可靠的替代方案——验血或将成为可能 [2]。这种检测基于生物标志物, 即血液中可测量的生物物质: 肿瘤中通常会有包含其 DNA 的碎片剥落并流入血液。我们可通过磁力方法捕获并富集血液中的肿瘤 DNA, 然后分析其构成。重点检测目标是包含三个氢原子和一个碳原子的特定分子标记, 即甲基基团。附着于 DNA 不同位点的甲基如同基因开关信号, 决定哪些基因应沉默或被激活。这种通过甲基调控基因的过程称为DNA甲基化 [3], 具有组织特异性, 可视为每种组织的独特“指纹”。甲基化模式可成为 150 种脑瘤的识别依据。若在验血中发现某种脑瘤特异的甲基化特征(图 2), 理论上我们无需活检就能确定患者的脑瘤类型。
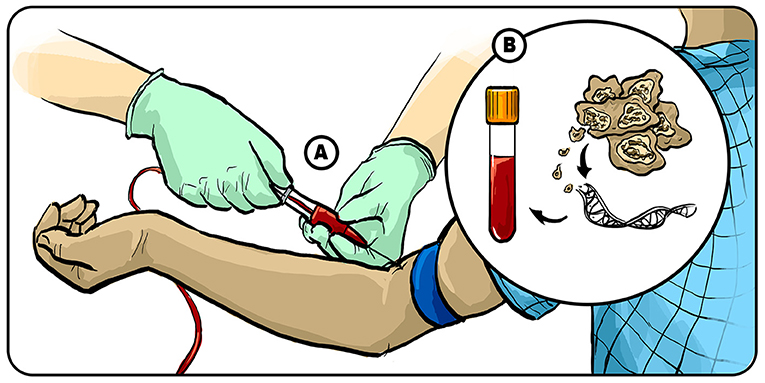
- 图 2 - 通过验血诊断脑瘤。
- (A) 我们正努力开发通过验血诊断脑瘤类型的方法。(B) 提取患者血液后, 通过富集肿瘤 DNA 生物标志物并分析其甲基化“指纹”, 可识别 DNA 究竟来自哪种脑瘤。插图: Iris Gat。
目前, 通过验血诊断脑癌的准确率约为 80%。要取代活检技术, 我们必须将准确率提升至 90% 以上。在医学领域, 新疗法必须优于现有方案才能成为新标准, 并且即使成为新标准, 通常仍需数年时间才能获得全球医生的广泛认可。我相信数年后, 脑瘤诊断性验血将取代活检, 从而彻底改变脑瘤治疗方式, 因为在消除活检需求的同时, 验血还能有效检测术后复发肿瘤。当前, 复发肿瘤的检测手段主要为 MRI, 而当 MRI 能观测到肿瘤时, 其体积往往已较大。我们的目标是开发高灵敏度的 DNA 甲基化验血方法, 在复发癌细胞达到临界规模前便能及时诊断出来, 以便进行早期干预, 从而挽救生命。此外, 复发肿瘤的细胞组成常与原发肿瘤不同, 这取决于哪些细胞在前期治疗中存活下来。换句话说, 存活细胞可能具有与原发肿瘤不同的基因组合。这意味着二次治疗方案可能需要调整, 通过甲基化特征精确掌握复发肿瘤的细胞构成将有助于我们设计最佳治疗方案。
脑癌治疗的未来
过去几十年间, 我们基于 DNA 生物标志物识别肿瘤的能力显著提升。现在, 我们已知甲基化特征与肿瘤之间存在对应关系, 这表明先前认定的各种脑瘤中存在诸多亚型。显微镜下看似相同的肿瘤, 可能因基因突变而被归类为不同亚型, 而我们通过血液样本精准识别这些肿瘤的能力正在不断增强, 下一步将为每种肿瘤开发专属治疗方案。
我们近期发表的一项研究成果利用 DNA 差异来预测胶质母细胞瘤的治疗效果 [4]。我们向肿瘤注射腺病毒, 当病毒进入癌细胞后会复制并导致细胞破裂, 从而激活免疫系统攻击癌细胞。同时, 我们会给予患者增强免疫力的药物。通过分析肿瘤和免疫细胞的基因特征, 我们发现: 若免疫系统的特定基因被高度激活, 患者更可能对治疗产生积极反应;反之则疗效有限。这一重要成果证明了利用基因特征为患者“量身定制”治疗方案的可能性。我们希望此类研究有助于理解患者对特定疗法的反应机制, 并开发更多脑瘤治疗方案。
我毕生致力于研究如何改进脑瘤诊断与治疗, 同时坚持为患者实施脑部手术。平衡科研与医疗工作曾是一项巨大挑战, 另一项挑战是如何在面对患者并发症时不气馁。作为医生, 我自然希望每台手术都完美无缺, 但有时情况会变得复杂, 使患者陷入困境。这对任何神经外科医生而言都是艰难的经历。我发现很重要的一点就是坦诚地与患者和同事分享这些经历, 同时持续为患者提供照护。此外, 我始终专注于每项工作, 无论是照护患者还是科研, 确保从每次经历中汲取经验。
术语表
良性 (Benign): ↑ 不会扩散至身体其他部位的非癌性肿瘤。
恶性 (Malignant): ↑ 可能扩散至身体其他部位的癌性肿瘤。
神经外科医生 (Neurosurgeon): ↑ 精通神经系统(特别是大脑与脊髓)手术的外科医生。
活检 (Biopsy): ↑ 一种外科手术程序, 切除部分可疑组织并送至实验室进行检测。
放疗 (Radiation): ↑ 一种利用高能量射线(通常为 X 射线)杀死或抑制癌细胞生长的治疗方法。
化疗 (Chemotherapy): ↑ 一种通过强效药物干扰癌细胞的生长和分裂过程, 从而破坏癌细胞的治疗方法。
生物标志物 (Biomarker): ↑ 存在于血液等体液中、可用于诊断疾病的生物物质。
甲基化 (DNA Methylation DNA): ↑ 通过向 DNA 添加或移除名为“甲基基团”的化学基团, 以开启或关闭基因的调控机制。
利益冲突声明
作者声明本研究不涉及任何潜在商业或财务关系。
补充资料
致谢
感谢 Noa Segev 为本研究进行访谈并参与撰文, 同时感谢 Iris Gat 提供所有插图。
AI 人工智能工具使用声明
本文中所有图表附带的替代文本(alt text)均由 Frontiers 出版社在人工智能支持下生成。我们已采取合理措施确保其准确性,包括在可行情况下经由作者审核。如发现任何问题,请随时联系我们。
参考文献
[1] ↑ Kleihues, P., Louis, D. N., Scheithauer, B. W., Rorke, L. B., Reifenberger, G., Burger, P. C., et al. 2002. The WHO classification of tumors of the nervous system. J. Neuropathol. Exper. Neurol. 61, 215–225. doi: 10.1093/jnen/61.3.215
[2] ↑ Nassiri, F., Chakravarthy, A., Feng, S., Shen, S. Y., Nejad, R., Zuccato, J. A., et al. 2020. Detection and discrimination of intracranial tumors using plasma cell-free DNA methylomes. Nat. Med. 26, 1044–1047. doi: 10.1038/s41591-020-0932-2
[3] ↑ Moore, L. D., Le, T., and Fan, G. 2013. DNA methylation and its basic function. Neuropsychopharmacology 38, 23–38. doi: 10.1038/npp.2012.112
[4] ↑ Nassiri, F., Patil, V., Yefet, L. S., Singh, O., Liu, J., Dang, R. M., et al. 2023. Oncolytic DNX-2401 virotherapy plus pembrolizumab in recurrent glioblastoma: a phase 1/2 trial. Nat. Med. 29, 1370–1378. doi: 10.1038/s41591-023-02347-y
