תַקצִיר
ייתכן ששמתם לב שכאשר אנשים מתבגרים, הם סובלים לעיתים קרובות יותר מאובדן זיכרון, והם עשויים ללמוד דברים לאט יותר מכם. מה גורם לשינויים האלה בתפקוד המוח שלנו? המחקר שלנו מצא שכאשר אנו מזדקנים, הַמֶּמְבְּרָנָה שמגינה על המוח שלנו, שנקראת מחסום דם-מוח (BBB), נעשית “דולפת”, מה שמאפשר לחלבונים בלתי רצויים ממחזור הדם להיכנס למוח. במאמר הזה נסביר כיצד מחסום דם-מוח דולף יכול להוביל לנזק בתפקוד המוח. יתרה מזו, נדון באפשרות של מציאת תרופה שתמנע את הדליפה הזו.
מהו מחסום דם-מוח ומה קורא כשהמגן הזה מתפרק?
המוחות שלנו מוגנים על ידי מגן שידוע כמחסום דם-מוח. הוא קיבל את השם שלו מכך שבמוחות בריאים מרכיבי דם מסוימים מופרדים מרקמת המוח על ידי מחסום שמורכב מהרבה תאים וגורמים אחרים, אשר יוצר חלוקה בין מחזור הדם לבין המוח. אנו קוראים למחסום הזה חצי חדיר, כלומר שרק מולקולות מסוימות שחשובות לתפקוד המוח יכולות לעבור דרכו. כאשר אנו מתבגרים, המחסום הזה נעשה “דולף”, ומאפשר את כניסתן של מולקולות אסורות.
כאשר אנו צעירים, מחסום הדם-מוח שלנו שלם. בסביבות אמצע החיים, אנו נוטים לראות רְאָיוֹת ראשונות לשחיקה. אצל אחוז קטן מהאנשים מתחילים להופיע חלבוני דם באזור במוח שנקרא היפוקמפוס [1]. היפוקמפוס משמעותו “פרסת סוס” ביוונית, מה שמייצג את צורתו המעוקמת של האזור הזה במוח. ההיפוקמפוס הוא אחד האזור החשובים והסתגלתנים ביותר במוח. כשאתם חווים משהו חדש, ההיפוקמפוס שלכם מגיב על ידי יצירת קשרים חדשים בין תאים במוח שנקראים נוירונים, ולעיתים גם הסרה של קשרים ישנים. היצירה וההסרה האלה של קשרים נקראת פלסטיוּת, ודרך הפלסטיות הזו ההיפוקמפוס ממלא תפקיד חשוב בלמידה ובזיכרון. אולם חוקרים חושבים שהפלסטיות הזו גם גורמת להיפוקמפוס להיות פגיע במיוחד ביחס להזדקנות [2], מה שמסוכן מאחר שנזק להיפוקמפוס יכול להפחית את יכולתנו ללמוד דברים חדשים או להיזכר בדברים שלמדנו קודם לכן.
בסביבות גיל 65 פחות או יותר, אצל אנשים רבים מופיעה כמות מסוימת של חלבוני דם במוח, מה שמגדיל את הסיכון של מחלות שמשפיעות על המוח [1]. נוכחותם של חלבוני דם במוח מתרחשת אצל אנשים רבים אולם אינה מובנת לגמרי, ולכן אנו רוצים לחקור כיצד ומדוע זה קורה (איור 1). אין כל כך הרבה מחקר קיים על האופן שבו מחסום דם-מוח מתפרק בגיל מבוגר. לכן, חיפשנו השראה ממערכת אחרת שנחקרה לעומק: פגיעה מוחית טראומטית (TBI). פגיעה מוחית טראומטית מתרחשת כאשר נגרמת טראומה פיזית לראש, המזיקה לגולגולת ולמוח. חשבנו שאולי להזדקנות טבעית יש השפעה דומה על מחסום דם-מוח כמו בפגיעה מוחית טראומטית, פרט לכך שהנזק הנגרם על ידי הזדקנות מתרחש לאט יותר, במשך הרבה שנים, במקום ב“מכה אחת”. TBI והזדקנות עשויות להיראות שונות מאוד, אולם הן יותר דומות ממה שאתם חושבים. במקרה של TBI, קל להסיק שמחסום דם-מוח סובל מנזק פיזי, בדומה לאופן שבו קסדת אופניים נעשית מעוקמת כשאתם נופלים ומקבלים חבטה בראשכם. אולם בנזק במחסום דם-מוח ב-TBI מתרחשת גם נפיחות סביב לאתר הפגיעה, מתגובות גופניות אחרות שמופעלות על ידי הפגיעה [3]. ברגע ש-TBI מזיקה למחסום דם-מוח, חלבון בדם שנקרא אלבוּמין ובדרך כלל אינו נמצא במוח, מתחיל לדלוף פנימה.
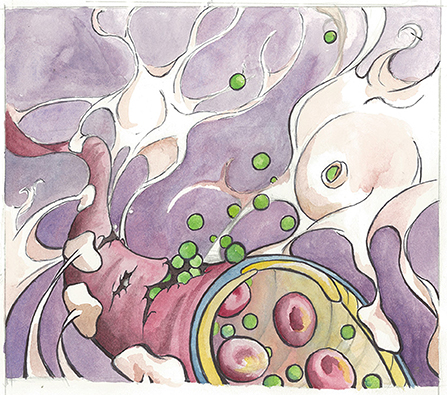
- איור 1 - המחשה של מחסום דם-מוח במוח מזדקן.
- כאן, מולקולות אלבומין (בירוק) דולפות מכלי דם שבור ונקשרות לקולטן TGF-β שנמצא על אסטרוציטים (בלבן). שימו לב שהאסטרוציטים עוטפים את “זרועותיהם” סביב לכלי הדם כדי לסייע לוויסות ולשמירה של מחסום הדם-מוח. אומנית: קרלי האוגן.
מדוע זה רע אם אלבומין נכנס למוח? טוב, אלבומין יכול לגרום לתאים מסוימים במוח לקבל אותות נוספים דרך מולקולה שנמצאת על פני השטח שלהם שנקראת קולטן TGF-β. אנו חושבים שהאיתות הנוסף הזה שנגרם על ידי אלבומין מתרחש גם אחרי TBI וגם במהלך הזדקנות [4]. בסביבות 40-10% מהמטופלים שסבלו מ–TBI פיתחו אפילפסיה בשלב מאוחר יותר בחיים [5], ומחלות כמו דמנציה (שיטיון) או אפילפסיה משפיעות על מבוגרים הרבה יותר מאשר על צעירים, מה שגורם לנו לחשוב שאיתות דרך קולטן TGF-β גם ממלא תפקיד בהפרעות במחסום דם-מוח שקשורות לגיל.
אם כן, כיצד בדיוק פועל האיתות הזה דרך קולטן TGF-β? אנו התעניינו בסוג מסוים של תא במוח שנקרא אסטרוֹציט, שמכיל הרבה קולטני TGF-β. הודות לצורתם הייחודית דמויית הכוכב (“אסטרום” משמעותו כוכב בלטינית), אסטרוציטים מסוגלים למתוח וללפף את ה“זרועות” שלהם סביב לכלי דם, מה שגורם לתאים האלה להיות מרכיב חשוב במחסום דם-מוח (איור 1). בין התפקידים השונים שלהם, אסטרוציטים מווסתים זרימת דם לנוירונים ומסייעים בבחירת המולקולות שיכולות לחצות מהדם אל המוח [6]. הם גם ממלאים תפקיד חשוב בתגובה לפגיעה שנובעת מנזק למחסום דם-מוח. כאשר קולטן TGF-β על אסטרוציט מופעל, האסטרוציט משחרר אות כימי שגורם לדלקת באזור שסביבו (איור 2) [7]. אולי הבחנתם בכך שכאשר אתם נוקעים את הקרסול, רקמת הקרסול נעשית נפוחה, או שכאשר יש לכם חום, השרירים שלכם כואבים והמצח שלכם נעשה חם. אלה דוגמאות לתגובה דלקתית של הגוף שלכם. בהקשר הנכון, התגובות האלה מסייעות לגוף להחלים. אולם קשה להתנהל בחיי היומיום אם הקרסול שלכם מתנפח עד כדי כך שאינכם יכולים ללכת, וזה יכול להיות מסוכן להיות עם חום גבוה מדי. באופן דומה, דלקת ארוכת טווח או לא הכרחית שנגרמת על ידי אסטרוציטים יכולה לפגוע בתפקוד התקין של המוח.
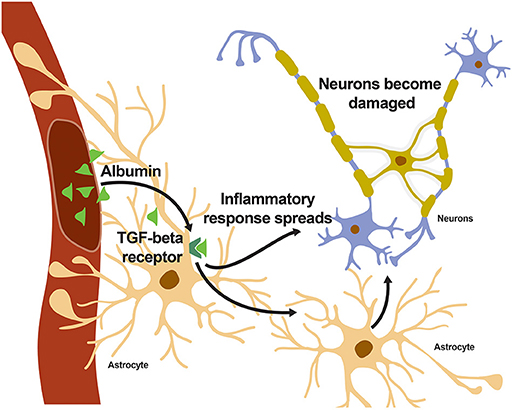
- איור 2 - כאשר אלבומין נכנס למוח ונקשר לקולטן TGF-β על אסטרוציטים, מתפשטת תגובה דלקתית ברחבי המוח, שבסופו של דבר מגיעה לנוירונים.
- נוירונים יכולים להינזק אם התגובה הדלקתית נמשכת זמן רב מדי.
מה הקשר בין עכברים שוחים לבין דמנציה?
כדי לבחון טיפולים אפשריים להשפעות המזיקות של מחסום דם-מוח דולף, היינו צריכים לשנות את הגֶּנִים של עכברים מסוימים. מטרתנו הייתה “להעיף”, או לעשות נוקאאוט, לקולטן TGF-β שגורם לדלקת, באמצעות תהליך שנקרא נוקאאוט גנטי. במילים אחרות, השתמשנו בביוטכנולוגיה כדי למחוק את הקולטנים האלה מהדנ“א של עכבר. דנ”א הוא סרט כימי ארוך שמכיל את הקוד הגנטי שלנו, ומידע על תכונות, כמו למשל צבע עיניים, גובה, ואפילו הסיכוי שלנו לחלות במחלות מסוימות. ביוטכנולוגיה מודרנית מאפשרת לנו להשתמש במולקולות מספריים כדי לחתוך כל חלק של הדנ“א. במקרה הזה, יכולנו להשתמש בטכנולוגיה הזו כדי לחתוך החוצה גֶּן שמקודד לקולטן TGF-β, ולהדביק את שארית הדנ”א חזרה יחד לכדי סרט המשכי. דמיינו כמה מדהים זה, בהינתן שדנ“א הוא דק פי 40,000 מעוביה של פיסת נייר! לאחר מכן, עם העכבר שלנו שעבר שינוי גנטי, יכולנו לקבוע אם הפחתת תגובה דלקתית משפיעה על תפקוד המוח בגיל מבוגר.
אחד המבחנים החשובים שהשתמשנו בהם על העכבר שלנו שעבר שינוי גנטי נקרא מבוך המים של מוריס. במטלה הזו, עכברים ממוקמים בבריכה ענקית עם פלטפורמה חבויה (איור 3). עכברים הם שחיינים טובים באופן טבעי, אולם הם שונאים להירטב ולכן הם ינסו למצוא את הפלטפורמה שעליה יוכלו להישאר יבשים. אנו יכולים להעריך את המהירות שבה הם לומדים היכן נמצאת הפלטפורמה, ואם הם זוכרים את המיקום שלה בימים הבאים או לא – זה אומר לנו כמה טוב המוחות שלהם מתפקדים. במטרה להפוך את הדברים למורכבים יותר, אנו מערבבים צבע לבן במים כך שהעכברים לא יכולים לראות בדיוק היכן נמצאת הפלטפורמה. במקום זאת, הם צריכים להשתמש בארבע צורות צבעוניות על קירות הבריכה כדי לשנן את מיקום הפלטפורמה. אם היינו מסירים את שלט הרחוב מהרחוב שלכם, ככל הנראה עדיין הייתם מזהים היכן אתם גרים בהתבסס על סימני נוף שאתם רואים כל יום, כמו למשל מלונת הכלב בחצר הקדמית של השכן שלכם, או עץ אֶדֶר בפינת הרחוב שלכם. אחרי ימים רבים שבהם העכבר רואה היכן נמצאת הפלטפורמה, אם יש לו מוח בריא הוא מסוגל למצוא את הפלטפורמה החבויה בהתבסס על אותו העיקרון. אנו קוראים למבחן הזה הגיון מרחבי. אם אתם זוכרים, התפרקות של מחסום דם-מוח גורמת לנזק הרב ביותר לאזור במוח שנקרא היפוקמפוס. ההיפוקמפוס אחראי על הגיון מרחבי, כמו גם על יכולות למידה – שתי יכולות קוגניטיביות שלרוב נחלשות עם הגיל.
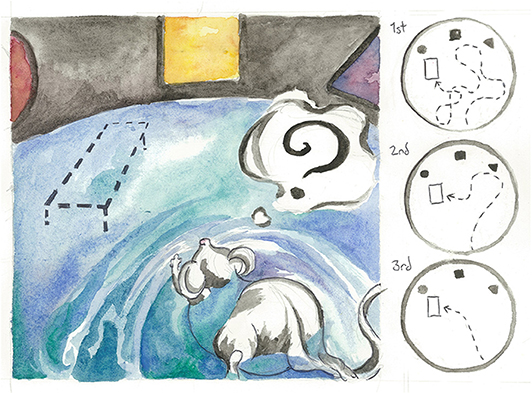
- איור 3 - עכבר מתאמן במבחן המים של מוריס, שבוחן הגיון מרחבי וזיכרון.
- צבע לבן מעורבב לתוך הבריכה כך שהעכבר לא יכול לראות בקלות את מיקום הפלטפורמה. במקום זאת, העכבר צריך להסתמך על צורות צבעוניות על גבי קירות הבריכה כדי לזכור היכן הפלטפורמה מוחבאת. בפאנל הימני אתם יכולים לראות את הלמידה של העכבר במהלך 3 ימים. אומנית: קרלי האוגן.
ראשית, ניסינו את מבחן המים של מוריס על קבוצה של עכברים מבוגרים עם נוקאאוט בקולטן TGF-β, והשווינו את הביצועים שלהם עם קבוצת ביקורת של עכברים מבוגרים שלא עברו נוקאאוט גנטי. אם ההשׁערה שלנו הייתה נכונה, עכברי הנוקאאוט היו צריכים ללמוד את מיקום הפלטפורמה מהר יותר מעכברי הביקורת, והיו צריכים להיות מסוגלים למצוא את הפלטפורמה באופן עקבי בימים הבאים. אולם התברר ששתי קבוצות העכברים היו מבוגרות מדי כדי לשחות כראוי, אז הן לא היו מסוגלות להשלים את המבחן [1]! מדע יכול להיות מתעתע באופן הזה. לעיתים, ישנם סיבוכים בלתי צפויים, ומדענים צריכים לחשוב על דרכים חדשות להתמודד עם המכשולים האלה.
במקום להשתמש בעכברים מבוגרים שלא יכולים לשחות, חזרנו על הניסוי עם עכברים צעירים יותר. כמו קודם, חילקנו את העכברים לשתי קבוצות – קבוצת נוקאאוט שלא היו לה קולטני TGF-β, וקבוצת ביקורת. אולם לעכברים צעירים כמעט ואין אלבומין במוח שלהם. משמעות הדבר היא שהיינו צריכים ליצור דרך מלאכותית לחקות את היבט ההזדקנות הזה. כדי לעשות זאת, השתלנו משאבה זעירה ששאבה אלבומין לתוך המוחות של שתי קבוצות העכברים במשך שבוע. הפעם, כאשר חזרנו על ניסוי מחסום המים של מוריס עם העכברים הצעירים שלנו, התוצאות שלנו היו משמעותיות. גילינו ששאיבת אלבומין לתוך מוחותיהם של עכברי קבוצת הביקורת הצעירים גרמה לתסמינים של הזדקנות – אובדן זיכרון ופעילות מוחית אבנורמלית. מצד אחר קבוצת עכברי הנוקאאוט הצעירים, שלמוח שלהם לא היה קולטני TGF-β שאלבומין יכול להיקשר אליהם, למדו את מיקום הפלטפורמה החבויה די מהר. התוצאות האלה מציעות שחסימת איתות TGF-β יכולה לטפל בנזק שנגרם למוח על ידי אלבומין [1].
טיפול אפשרי להתפרקות של מחסום דם-מוח
לרוע המזל, איננו יכולים (עדיין) לשנות את הגנים של אנשים במטרה לעשות נוקאאוט לקולטני ה-TGF-β שלהם, מאחר שביצוע שינוי גנטי כזה הוא גם לא אתי וגם קשה מאוד. במקום זאת, שאפנו ליצור תרופה שיכולה להשיג את אותו האפקט. קראנו לתרופה הזו IPW. IPW היא מולקולה קטנה שנקשרת לקולטן TGF-β ומונעת ממנו להיות מופעל. אתם יכולים לחשוב על IPW כשוער במשחק כדורגל. כאשר השוער חסר, שחקנים יכולים לבעוט את הכדור לרשת; באותו האופן, כאשר IPW לא נמצאת, אלבומין יכול להיקשר לקולטן TGF-β. אולם כאשר השוער חוסם את הדרך, הכדור לא יכול להיכנס לשער. באותו האופן, IPW חוסמת אלבומין מלהיקשר למטרה שלו, מה שמונע את ההתרחשות של איתות לדלקת.
כדי לבחון את יעילותה של IPW, השתמשנו במבחן אחר עבור עכברים שנקרא מבוך T. כפי שהשם מציע, עכברים ממוקמים במבוך בצורת T. כשהם נעים לאורך החלק האנכי של מחסום ה-T, העכברים צריכים לבחור אם לחקור את הזרוע הימנית או השמאלית של מחסום ה-T (איור 4). עכברים הם חיות סקרניות באופן טבעי, כך שעכברים בריאים ישנו את ביקוריהם בין הזרועות הימנית והשמאלית של המבוך כדי למקסם את החקירה שלהם. מצד שני עכברים מבוגרים יותר שסובלים מאובדן זיכרון שקשור בגיל נוטים לשכוח איזה צד הם כבר חקרו, ולכן לפעמים הם יחקרו את אותה הזרוע פעמים רבות ברצף. ממש כמו במבחן המים של מוריס, מבחני מבוך T בוחנים גם זיכרון וגם הגיון מרחבי, מה שמספק הערכה טובה לתפקוד ההיפוקמפוס. ביצועיהם של עכברים מבוגרים שטופלו באמצעות IPW היו טובים יותר מאלה של העכברים שלא טופלו [1], מה שאומר שחסימת הפעלת קולטן TGF-β משחזרת את הזיכרון של העכברים, ומאפשרת להם לפתור את המבוך ממש כמו עכברים צעירים.

- איור 4 - עכבר חוקר מבוך T.
- עכברים מבוגרים שקיבלו טיפול באמצעות IPW נטו לחקור זרוע שונה של מבוך ה-T בכל פעם שהם מוקמו במבוך, בעוד שעכברי הביקורת שלא קיבלו טיפול לעיתים קרובות שכחו איזו זרוע הם כבר חקרו, ובחרו את אותה הזרוע שוב ושוב. אומנית: קרלי האוגן.
מסקנות
לאן אנו ממשיכים מכאן? בצעדים הבאים שלנו, אנו שואפים להמשיך ולסגור את הפער בין עכברים לבני אדם, תהליך שיכול להיות ארוך ומורכב. צורות תרופת ה-IPW שלנו שאפשר לתת דרך הפה או בזריקה, מדכאות את קולטני ה- TGF-β ברחבי הגוף, אולם מצאנו שמספיק לבצע נוקאאוט לקולטני TGF-β על אסטרוציטים בלבד כדי להשיג את אותו האפקט. ישנן שאלות לא פתורות נוספות, כמו למשל האם ל-IPW יש תופעות לוואי בלתי רצויות, וכיצד אנו יכולים להשתמש בסריקה מוחית כדי לאתר דליפות במחסום דם-מוח במהלך בדיקה רפואית שגרתית. יש לנו המזל לשתף פעולה עם רופאים, כימאים ומהנדסים, בעודנו ממשיכים לפתח את הפתרון. השאלה של כיצד להאט – או אפילו להחזיר לאחור – את תהליך ההזדקנות היא שאלה גדולה, ונדרש יותר מסוג מחקר אחד כדי לענות עליה.
מילון מונחים
מחסום דם-מוח (BBB - Blood-brain Barrier): ↑ ממברנה ששולטת במולקולות שיכולות לחצות ממחזור הדם אל המוח.
היפוקמפוס (Hippocampus): ↑ אזור במוח שחשוב עבור למידה וזיכרון. המשמעות של היפוקמפוס ביוונית היא ”פרסת סוס“, והיא מתייחסת לצורתו המעוקמת.
אלבומין (Albumin): ↑ חלבון בדם שבאופן תקין לא נמצא במוח של אנשים בריאים.
דמנציה (Dementia): ↑ מונח שמשמש לתיאור תסמינים כמו למשל ליקויים בזיכרון, בלמידה ובדיבור.
אסטרוציט (Astrocyte): ↑ תא בצורת כוכב שיוצר חלק ממחסום דם-מוח (”אסטרום“ משמעותו כוכב בלטינית).
נוקאאוט גנטי (Genetic Knockout): ↑ שיטה שמסירה גן מסוים מהדנ”א של אינדיבידואל.
מבוך המים של מוריס (MWM - Morris Water Maze): ↑ מבחן של יכולת למידה. עכברים ממוקמים בבריכה ענקית של מים, והם צריכים למצוא פלטפורמה חבויה.
מבוך T (T-maze): ↑ מבחן לזיכרון. מאחר שעכברים אוהבים לחקור, הם עוברים את הבחינה כדי לראות אם הם מחליפים בין חקירת הזרועות השמאלית והימנית.
הצהרת ניגוד אינטרסים
המחברים VS DK-ו מצהירים על אינטרס כלכלי בעבודה המתארת מאמר זה. המחבר הנוסף מצהיר שהמחקר נערך ללא אינטרסים מסחריים או כלכלים שיכולים להתפרש כניגוד אינטרסים.
מאמר המקור
↑ Senatorov, V. V., Friedman, A. R., Milikovsky, D. Z., Ofer, J., Saar-Ashkenazy, R., Charbash, A., et al. 2019. Blood-brain barrier dysfunction in aging induces hyperactivation of TGFβ signaling and chronic yet reversible neural dysfunction. Sci. Transl. Med. 11:eaaw8283. doi: 10.1126/scitranslmed.aaw8283
מקורות
[1] ↑ Senatorov, V. V., Friedman, A. R., Milikovsky, D. Z., Ofer, J., Saar-Ashkenazy, R., Charbash, A., et al. 2019. Blood-brain barrier dysfunction in aging induces hyperactivation of TGFβ signaling and chronic yet reversible neural dysfunction. Sci. Transl. Med. 11:eaaw8283. doi: 10.1126/scitranslmed.aaw8283
[2] ↑ Bartsch, T., and Wulff, P. 2015. The hippocampus in aging and disease: from plasticity to vulnerability. Neuroscience 309:1–16. doi: 10.1016/j.neuroscience.2015.07.084
[3] ↑ Price, L., Wilson, C., and Grant, G. 2016. “Blood–brain barrier pathophysiology following traumatic brain injury,” in Translational Research in Traumatic Brain Injury, Chapter 4, eds D. Laskowitz and G. Grant (Boca Raton, FL: CRC Press; Taylor and Francis Group). p. 1–25.
[4] ↑ Shlosberg, D., Benifla, M., Kaufer, D., and Friedman, A. 2010. Blood-brain barrier breakdown as a therapeutic target in traumatic brain injury. Nat. Rev. Neurol. 6:393–403. doi: 10.1038/nrneurol.2010.74
[5] ↑ Henemann, U., Kaufer, D., and Friedman, A. 2012. Blood-brain barrier dysfunction, TGFβ signaling, and astrocyte dysfunction in epilepsy. Glia 60:1251–7. doi: 10.1002/glia.22311
[6] ↑ Alvarez, J. I., Katayama, T., and Prat, A. 2013. Glial influence on the blood brain barrier. Glia 61:1939–58. doi: 10.1002/glia.22575
[7] ↑ Cacheaux, L. P., Ivens, S., David, Y., Lakhter, A. J., Bar-Klein, G., Shapira, M., et al. 2009. Transcriptome profiling reveals TGF-beta signaling involvement in epileptogenesis. J. Neurosci. 29:8927–35. doi: 10.1523/jneurosci.0430-09.2009

