תַקצִיר
חיידקים כנגד וירוסים זה אחד הקרבות העתיקים ביותר על פני כדור הארץ. וירוסים מסוימים צריכים לזהם חיידקים כדי להתרבוֹת, אולם חיידקים לא רוצים להזדהם. כיצד חיידקים ששורדים את הזיהום הוויראלי מוודאים שהוא לא יקרה שוב? סוגים רבים של חיידקים פיתחו תהליך שמכונה CRISPR, אשר מסייע להם לזכור וירוסים שהם ראו בעבר. CRISPR גם מאפשר לחיידקים למנוע מווירוסים להרוס אותם. בעוד שלבני אדם אין CRISPR בתאים שלהם, הם מצאו דרכים מלהיבות להשתמש ב-CRISPR במעבדה.
חיידקים כנגד וירוסים: המלחמה הזעירה העצומה ביותר
ככל הנראה שמעתם על חיידקים ווירוסים שיכולים לגרום לאנשים לחלות, ואתם עשויים לדעת על האופן שבו אנשים נלחמים בחיידקים באמצעות אנטיביוטיקה, וכיצד באמצעות חיסונים אנו מוֹנעים זיהומים שנגרמים על-ידי חיידקים או על-ידי וירוסים. אולם חיידקים ווירוסים גם נלחמים זה בזה במשך זמן רב, וחקירת האופן שבו הם נלחמים לימדה אותנו הרבה על האופן שבו אורגניזמים משתנים במהלך הזמן, וגם הובילה לתגלית של כלי מחקר מלהיב במיוחד.
הקרב הזה בין חיידקים ווירוסים הוא על היכול להתרבוֹת. גם חיידקים וגם וירוסים מתרבים על-ידי יצירת העתקים זהים של עצמם, וההוראות איך לעשות זאת מאוחסנות בדנ“א שלהם.
פיצוח קוד הדנ”א
דנ“א הוא מולקולה ארוכה שבנויה משילוב של ארבע מולקולות קטנות יותר: אדנין, תימין, גואנין וציטוזין (בקיצור A, T, G ו-C; איור 1). מולקולות ה-A, T, C ו- G יכולות להיות קשורות יחד בהרבה סדרים שונים כדי ליצור גְּדִיל ארוך אחד. הקומבינציה המסוימת של מולקולות A, T, C ו- Gהיא כמו קוד. גדיל דנ”א אחד לבדו לא יחזיק מעמד זמן רב בתוך התא, ולכן גדילים מתחברים בזוגות לפי חוקים מסוימים. מולקולות A יכולות להתחבר רק עם מולוקלות T ומולקולות C יכולות להתחבר רק עם מולוקולות G, כך ששני הגדילים נעשים בסופו של דבר כמו הפכים אחד של השני. כלומר, שני הגדילים של מולקולת דנ“א הם משלימים. שני הגדילים המשלימים מתלפפים אחד סביב לשני כדי ליצור מבנה שנקרא סליל כפול.
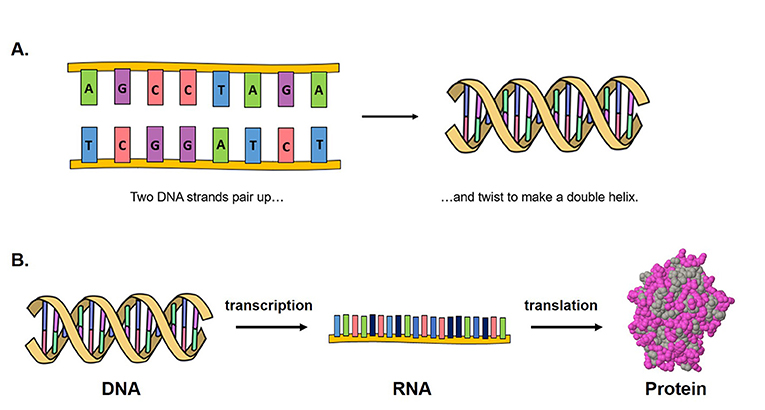
- איור 1 - מבנה הדנ“א וכיצד חלבונים נוצרים מדנ”א.
- (A) גדיל של דנ“א מכיל רצפים של מולקולות (A, T, C ו-G) בסדר מסוים. שני גדילים משלימים של דנ”א מתחברים יחד (A מתאים ל-T ו-C מתאים ל-G) ומתלפפים זה סביב זה ליצירת צורה שמכונה סליל כפול. (B) כדי ליצור חלבון ראשית, מולקולת דנ“א עוברת תהליך שנקרא שעתוק, במטרה ליצור מולקולת רנ”א. מולקולת הרנ“א משתמשת במנגנון התאי כדי ליצור חלבון, תהליך שידוע בשם תרגום. double helix = גדיל כפול transcription = שעתוק translation = תרגום protein = חלבון
חלקים מסוימים של הדנ”א, שנקראים גֶּנִים, מכילים הוראות לבניית חלבונים (איור 1). חלבונים הם המולקולות העיקריות שעושות דברים בתוך התא. חלבונים מסייעים להפוך את המזון שלנו לאנרגיה; הם מזיזים דברים שונים בתוך התאים וביניהם, והם מסייעים לתאים לתקשר. מוצרי החלבון של הגנים והעבודה שהם עושים הם האופן שבו גנים גורמים לתכונות פיזיות, כמו צבע עיניים או סוג שיער חָלָק או מתולתל.
למרות זאת, מרבּית הדנ“א שלנו אינו גנים. הרבה מהחלקים האחרים האלה בדנ”א מסייעים לתאים לדעת מתי ליצור חלבון מסוים, וכמה מהחלבון הזה הם צריכים לייצר.
אבל, מה הקשר של דנ”א לכל זה?
אם כן, עכשיו כשאנו יודעים שדנ“א מקודד חלבונים, אנו יכולים לחשוב כיצד הוא עשוי לאפשר לחיידקים או לווירוסים ליצור עותקים של עצמם. כדי שחיידק יתרבה הוא צריך לייצר כמה חלבונים ומולקולות עבור תא אחר, להעתיק את הדנ”א שלו כך שהתא החדש יכיל את המידע שהוא צריך, והוא גם נדרש לגדול ולהתחלק. וירוס, לעומת זאת, הוא פשוט יותר – קצת דנ“א שעטוף בחלבון. גם חיידקים וגם וירוסים מכילים הוראות ליצירת החלבונים שיסייעו לכל מטלות ההתרבוּת. אז על מה יש להילחם בעצם?
אנו מפספסים חלק אחד חשוב בסיפור הזה – כיצד חלבון נוצר? זה מתרחש עם סיוע של מולקולה שנקראת רנ”א. רנ“א דומה מאוד לדנ”א, אולם יש לה גדיל אחד. חלבונים מיוחדים יכולים לייצר (או “לתעתק”) גרסאות רנ“א של גנים אשר יכולים ”להיקרא“ על-ידי מנגנון תאי ש”מתרגם“ את קוד הרנ”א ובונה את החלבון (איור 1). אתם יכולים לחשוב על ההבדל בין רנ“א לדנ”א באופן הזה: דנ“א הוא כמו חוברת הוראות הפעלה, או שרטוט, או ספר בישול. לא מתבצעים שינויים להעתק של המקור, אולם אם מישהו רוצה לייצר משהו מההוראות האלה, חלקים קטנים מועתקים ונשלחים למקום שבו המוצר יכול להיות מיוצר מהחומרים המתאימים. זה התפקיד של הרנ”א. זהו שלב הרנ“א המתווך אשר גורם בעיות לווירוסים ולחיידקים. חיידקים מכילים הוראות ואת הכלים ליצור חלבונים, אולם לווירוסים יש רק הוראות – לא כלים.
האופן שבו וירוסים מסוימים מפצים על כך הוא באמצעות ”חטיפת“ חיידקים ושימוש בכלים שלהם (איור 2). סוגי הווירוסים האלה נוחתים על החיידק, מתחברים לחלק החיצוני שלו ומזריקים את הדנ”א שלהם אל תוך החיידק. אם החיידק לא מבין שדנ“א הוא ויראלי (כלומר שייך לווירוס) ואינו שייך לו, הוא ימשיך לבצע את ההוראות שבדנ”א הוויראלי וייצר הרבה וירוסים נוספים. החיידק ייצר עותקים של דנ“א ויראלי והרבה חלבונים של וירוסים, ויאפשר לווירוסים החדשים להיות מורכבים בתוכו. לִבְסוֹף, הווירוסים החדשים יפרצו דרך החיידק וייצאו החוצה לזהם חיידקים נוספים [1].
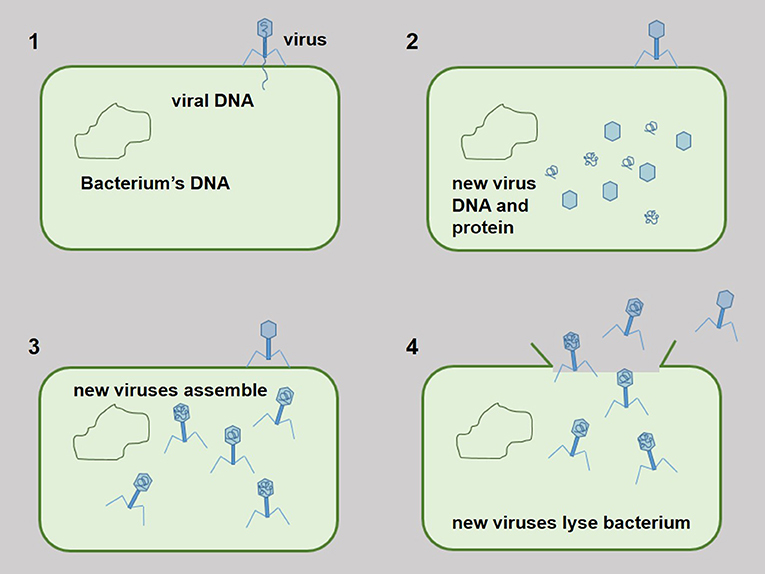
- איור 2 - כיצד וירוסים מתרבים?
- שלב :1 הווירוס מתחבר לחלקו החיצוני של חיידק ומזריק לתוכו את הדנ”א שלו. שלב :2 דנ“א ויראלי וחלבונים חדשים מיוצרים על-ידי החיידק. שלב :3 וירוסים חדשים מורכבים בתוך החיידק. שלב :4 וירוסים חדשים פורצים החוצה מהחיידק והולכים לזהם חיידקים אחרים.
מרבית החיידקים שמזוהמים על-ידי וירוס שמעולם לא ראו, ימותו. אולם מדי פעם החיידק לא מת מהזיהום הוויראלי. זה עשוי לקרות בגלל מוטציה בדנ”א של החיידק הזה. מוטציות הן שינויים ברצפי הדנ“א של גן, כמו טעויות קטנות, והן מתרחשות כל הזמן בחיידקים כשהם מעתיקים את הדנ”א שלהם לדור הבא. חלק מהטעויות האלה הורגות את החיידק, כך שאין לו הזדמנות להעביר את המוטציה לדור הבא. אולם מוטציות אחרות עשויות להצליח להתחמק בלי שיבחינו בהן... עד אשר וירוס פולש אל תוך החיידק! לפתע מתברר שהמוטציה למעשה סייעה לחיידק להילחם כנגד הווירוס. החיידקים המעטים ברי המזל שיש להם מוטציה מועילה הם אלה ששורדים וממשיכים להתרבות, והם יעבירו הלאה את המוטציות המועילות האלה לצאצאים שלהם. הצאצאים האלה מתרבים בתורם, ובסופו של דבר המוטציה המועילה נמצאת ברוב החיידקים באוכלוסייה. היכרות זו של גרסה מועילה של גן לתוך קבוצה שלמה של חיידקים היא דוגמה לאבולוציה.
CRISPR: הגנה על חיידקים באמצעות זכירת וירוסים
בשלב הזה אתם עשויים לתהות כיצד עמידות לווירוסים נראית אצל חיידקים, וזה המקום שבו CRISPR נכנס לתמונה (איור 3). CRISPR הוא קיצור של Clustered Regularly InterSpaced Palindromic Repeats. זה נשמע מסובך מאוד, אבל למעשה זה פשוט התיאור של חלק מהאזורים המיוחדים של דנ“א חיידקי. באזורים אלה ישנם שני סוגים של רצפי דנ”א שמופיעים לסירוגין: חזרות (Repeats) ומרווחים או ספייסרים (Spacers). החזרות הן אותם רצפים שחוזרים שוב ושוב, אולם הרצפים שביניהם – הספייסרים – שונים זה מזה.
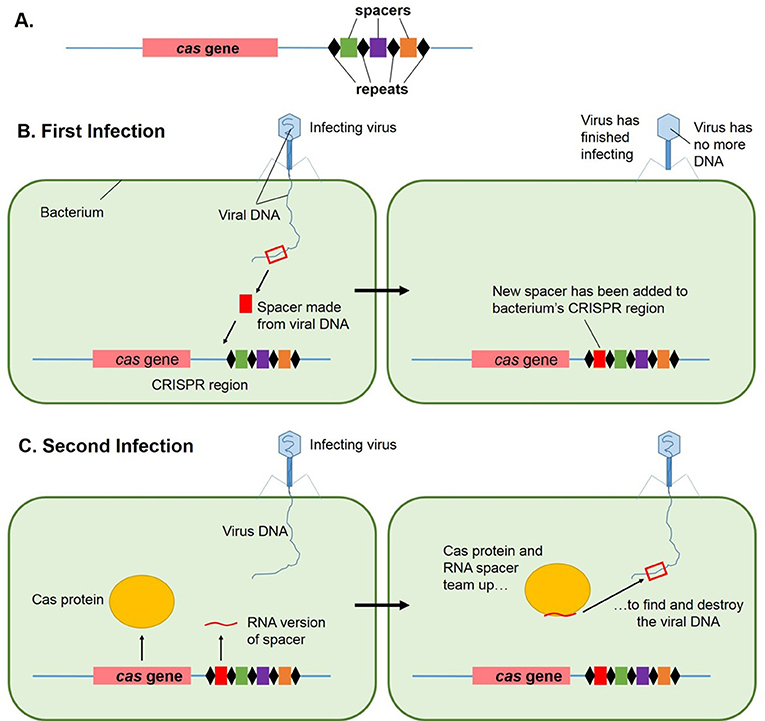
- איור 3 - מהו CRISPR וכיצד הוא פועל?
- (A) המבנה של CRISPR. רצפים קצרים של דנ“א, שנקראים חזרות (Repeats) וספייסרים (Spacers), מסודרים מתבנית מתחלפת. כל רצפי החזרות (יהלומים שחורים באיור) הם זהים, אולם הספייסרים (ריבועים צבעוניים באיור) הם רצפים שונים. גנים בשם cas נמצאים גם הם ליד אזורי ה-CRISPR. (B) בזיהום הראשון, חלק קטן מהדנ”א הוויראלי מועתק והופך ל-ספייסר חדש. הספייסר החדש משולב לתוך ה-CRISPR. (C) בזיהום השני, החיידק מייצר רנ“א מאזור ה-CRISPR. הרנ”א מנחה את חלבון ה-cas לדנ“א הוויראלי, וחלבון ה-cas הורס את הדנ”א הוויראלי.
כאשר מדענים מצאו את אזור הדנ“א המיוחד הזה, הם לא היו בטוחים מה מטרתו. אולם מהר מאוד הם גילו שהספייסרים היו לעיתים קרובות דומים מאד לדנ”א ויראלי. מהיכן הדנ“א הוויראלי הזה הגיע? האם CRISPR יכול לסייע לחיידקים לזהוֹת וירוסים ולהילחם בהם?
בשנת 2007 Rodolphe Barrangou ומעבדתו החליטו לחקור את הרעיון הזה (עובדה נחמדה: Barrangou עבד עבור חברת יוגורט! יצירת יוגורט מחייבת חיידקים, ולפעמים החיידקים האלה מושמדים על-ידי וירוסים. לחברה היה אינטרס לדעת כיצד חיידקים מגינים על עצמם מפני וירוסים [2].( כאשר Barrangou ומעבדתו השוו את אזור ה-CRISPR של אחד מסוגי החיידקים שאינו עמיד לווירוסים עם גרסת ה-CRISPR של חיידק מאותו הזן שֶׁכֵּן עמיד לווירוסים, הם מצאו שההבדל היחיד ביניהם הוא שהאזור שעמיד לווירוסים מכיל ספייסרים נוספים. הם החליטו לערוך ניסוי כדי להבין מהיכן הגיעו הספייסרים הנוספים האלה.
ראשית, הם חשפו לווירוסים את החיידקים שאינם עמידים לווירוסים עד שהחיידקים הפכו להיות עמידים לווירוסים. כאשר הם השוו את אזורי ה-CRISPR של החיידקים העמידים החדשים ושל חיידקים שאינם עמידים, הם מצאו שהיו בדרך כלל בין אחד לארבעה ספייסרים חדשים אצל החיידקים העמידים, ושהספייסרים החדשים האלה היו דומים לדנ”א של וירוסים שאליהם החיידקים נחשפו. זה גרם לחוקרים לחשוב שייתכן כי הספייסרים הגיעו מדנ“א ויראלי.
Barrangou ומעבדתו גם חקרו והכניסו כמה ספייסרים אשר תאמו וירוסים שונים. הם מצאו שכאשר הם מחקו ספייסר מחיידק שעמיד לווירוס, החיידק איבד את עמידותו לווירוס התואם, וכאשר הם הוסיפו ספייסר, החיידק נעשה עמיד לווירוס התואם אפילו אם הוא מעולם לא ראה את הווירוס קודם לכן. Barrangou ומעבדתו הסיקו שהספייסרים שבאזור ה-CRISPR מספקים עמידות לווירוסים על-ידי שמירת חלק מהדנ”א הוויראלי, אשר מאפשר לחיידק “לזכור” את אותם הווירוסים [3].
העמידות (חסינות) לווירוס פועלת בתגובה לזיהום. באופן רגיל, חסינות אינה מועברת לצאצאים אולם עם ה-CRISPR היא כן, מאחר שהחסינות למעשה מקודדת בדנ“א אשר מועבר הלאה לדורות הבאים [4].
מאז ש- Barrangou ערך לראשונה את ניסויי ה-CRISPR, הבנו הרבה דברים על האופן שבו CRISPR פועל כדי למנוע מווירוסים להרוס את התא. החיידק קוצץ חלק קטן מהדנ”א הוויראלי ומוסיף אותו לתוך אזור ה-CRISPR בדנ“א של עצמו. אם הווירוס חוזר, החיידק מייצר רנ”א מאזור ה-CRISPR המסוים לווירוס הזה. עותקי הרנ“א האלה מתחברים בזוגות עם חלק מחלבוני ה-cas (CRISPR-associated). הרנ”א מדריך את חלבון ה-cas לחדור לדנ“א הוויראלי כך שהחלבון יוכל להרוס אותו. אין יותר דנ”א ויראלי, אין יותר וירוסים חדשים. עותקי הרנ“א מתחברים בזוגות עם חלק מחלבוני ה-cas (CRISPR-associated), אשר מיוצרים מגֶנים שנקראים cas genes.
מֵעֵבֶר לחיידקים: CRISPR במעבדה
כאשר המנגנון הזה התגלה, מדענים הבינו במהרה של-CRISPR יכולים להיות שימושים רבים מעניינים ומלהיבים במעבדה [2]. אנשים הבינו שהם יכולים לתת חלבון cas לגרסת הרנ”א של כל חתיכת דנ“א שהם רוצים למצוא, ובסיועו של הרנ”א החלבון יוכל לעשות שינויים בדנ“א. חלבוני cas יכולים לשנות אות אחת, שזה בדרך כלל מספיק כדי לגרום לגן לא לתפקד יותר, או שחלבוני cas יכולים למחוק גן שלם או חלק מסוים של הגן.
זה הופך את CRISPR להיות כלי אדיר לגנטיקה, שהיא המחקר של תכונות מוּרָשוֹת. אחת הדרכים שבהן גנטיקאים מבינים כיצד גנים פועלים היא באמצעות מחיקה או ביטול של פעולת הגנים, ובדיקת ההשלכות של כך על האורגניזם. זה נעשה במשך שנים רבות, אולם CRISPR מאפשר לנו לעשות זאת מהר יותר ובאופן מדויק יותר מאי פעם.
ייתכן שאפשר יהיה גם להשתמש ב-CRISPR כדי לתקן מוטציות מזיקות שגורמות למחלות אצל בני אדם, אולם זה מעלה כמה שאלות אֶתִיּוֹת רציניות. כיצד נחליט מתי להשתמש בטכנולוגיה הזו? האם זה בסדר ליצור שינויים גנטיים שיכולים להיות מוּרָשִׁים למישהו שלא הסכים לשינויים האלה? אנו עדיין רחוקים מאוד משימוש ב-CRISPR בבני אדם, אולם חשוב לשאול את השאלות הללו במוקדם ולא במאוחר.
תרומת הַמְּחַבְּרוֹת
MC כתבה את הטקסט ויצרה את כל האיורים. JJ פיקחה על העבודה והעירה על הטקסט בכל השלבים. שתי המחברות סקרו את הטקסט הסופי.
מילון מונחים
דנ”א (DNA): ↑ חומצה דאוקסיריבונוקלאית. מולקולה ארוכה העשויה משילוב של ארבע מולקולות קטנות יותר (A, C, T, G) אשר מקוֹדדוֹת את כל המידע בתא.
סליל כפול (Double helix): ↑ הצורה שדנ“א יוצר כאשר שני הגדילים המשלימים של המולקולה מתחברים בזוג ומסתלסלים.
חלבון (Protein): ↑ מחלקה של מולקולות גדולות ובעלות מבנה מורכב אשר אחראית על מרבית הפעילות התאית.
רנ“א (RNA): ↑ חומצה ריבונוקלאית (ribonucleic acid), מולקולה של גדיל יחיד שמורכבת ממולקולות A, G, C ו-U. רנ”א יכולה לשמש כשליחה בין הדנ“א והמנגנון התאי שמייצר חלבונים, אולם יש לה גם תפקידים אחרים.
מוטציה (Mutation): ↑ שינוי שחל ברצף הדנ”א של אורגניזם כגון הוספה, החלפה או מחיקה של המולקולות המרכיבות את הדנ“א: A, C, T ו-G.
גן (Gene): ↑ חלק בדנ”א שמקודד הוראות בנייה של חלבון מסוים.
CRISPR: ↑ השם שניתן לאזור מסוים של חלק מהגנומים של חיידקים, אשר מכיל spacer מתחלף ו-repeats שחוזרים על עצמם. זהו גם השם שניתן לתהליך שבאמצעותו חיידקים מגינים על עצמם מזיהומים ויראליים, ושמהּ של טכנולוגיית מעבדה אשר מאפשרת עריכה של גנים.
גנים(cas genes): ↑ גנים שמקושרים ל-CRIPSR וצמודים לאתרי CRISPR של spacers ו-repeats. cas9 הוא גן cas.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Salmond, G. P. C., and Fineran, P. C. 2015. A century of the phage: past, present and future. Nat. Rev. Microbiol. 13:777–86. doi: 10.1038/nrmicro3564
[2] ↑ Zimmer, C. 2015. Breakthrough DNA Editor Born of Bacteria. Quanta Magazine. Available online at: https://www.quantamagazine.org/crispr-natural-history-in-bacteria-20150206/ (accessed November 26, 2017).
[3] ↑ Barrangou, R., Fremaux, C., Deveau, H., Richards, M., Boyaval, P., Moineau, S., et al. 2007. CRISPR provides acquired resistance against viruses in prokaryotes. Science 315:1709–12. doi: 10.1126/science.1138140
[4] ↑ Barrangou, R., and Marraffini, L. A. 2014. CRISPR-Cas systems: prokaryotes upgrade to adaptive immunity. Mol. Cell 54:234–44. doi: 10.1016/j.molcel.2014.03.011
