ملخص
لقد كان تاريخنا البشري حافلًا بالعديد من الاكتشافات الكبرى في مجالي العلوم والتكنولوجيا التي غيّرت مجرى حياتنا، مثل الثورة الصناعية وثورة الإنترنت. أما الثورة القادمة، فقد بدأت بالفعل، بفضل تقنية شاركتُ في اكتشافها تتيح للعلماء تعديل جينات العديد من الكائنات الحية والنباتات، وتُعرف باسم كريسبر (CRISPR). تستطيع هذه التقنية المدهشة تحسين صحة الإنسان، وزيادة إنتاجية المحاصيل الزراعية، ومكافحة تغيّر المناخ، بل إنّها قد تُؤثر حتى في مسار تطوّر الإنسان نفسه. وسأتطرق في هذا المقال إلى آلية عمل تقنية كريسبر، وإلى اكتشافي لنظام محدد من أنظمة كريسبر يُعرف باسم كريسبر-كاس9 (CRISPR-Cas9)، إلى جانب الاستخدامات الحالية والمستقبلية لهذه التقنية.
وأخيرًا، سأناقش أهم التساؤلات الأخلاقية المتعلقة باستخدام تقنيات كريسبر، والإجراءات التي ينبغي على العلماء والمجتمعات اتخاذها لضمان تطبيق هذه التقنية بشكل مسؤول وهادف.
فازت البروفيسورةJennifer Doudna بجائزة نوبل في الكيمياء عام 2020 بالاشتراك مع إيمانويل شاربنتييه، تقديرًا لتطويرهما طريقة لتعديل الجينوم.
مقدمة
تحتوي الخلايا الحية على جزيئات تُسمّى الحمض النووي الرِيبي منقوص الأكسجين، وهي تُعد ≪دليل التعليمات≫ التفصيلي الذي يوضح لكل خلية طريقة عملها، ويُعرف هذا الدليل الكامل باسم الجينوم الخاص بالكائن الحي. أما الأجزاء الصغيرة من هذا الدليل، التي تُعرف باسم الجينات، فهي تُشفّر بروتينات معيّنة تتحكّم في وظائف كل خلية (مثل قدرة خلايا العضلات على الانقباض) وفي صفات الكائن الحي (مثل لون البشرة والعينين). لكن بين الجينات والبروتينات يوجد ≪وسيط≫، وهو عبارة عن جزيء يُعرف باسم الحمض النووي الريبي ، ينقل المعلومات من الحمض النووي الرِيبي منقوص الأكسجين إلى الآلية الخلوية المسؤولة عن تصنيع البروتينات. وعلى عكس الحمض النووي الرِيبي منقوص الأكسجين، يوجد الحمض النووي الرِيبي في جميع أنحاء الخلية، وليس فقط في النواة.
وتستطيع كائنات دقيقة تُعرف بالفيروسات أن تتدخّل في هذه العملية وتُسبّب الأمراض، مثل متحوّر فيروس كورونا - سارس-2 (SARS-CoV-2) المسبّب لجائحة كوفيد-19. تُصيب الفيروسات الخلايا عن طريق إدخال مادتها الوراثية داخل الخلية، ثم توجيه الخلية لإنتاج نُسخ من الفيروس يمكنها الانتشار داخل الكائن الحي، ولا تُصيب الفيروسات البشر والحيوانات فقط، بل يمكنها أيضًا إصابة البكتيريا. بيد أن بعض أنواع البكتيريا تمتلك جهازًا مناعيًا يساعدها على حماية نفسها من الفيروسات؛ فعندما يُهاجم فيروس خلية بكتيرية، تحتفظ البكتيريا بنسخة من الحمض النووي الفيروسي في موقع خاص داخل جينومها يُسمّى كريسبر [1]. يحتوي هذا الجزء من الجينوم البكتيري على عدد من مقاطع الحمض النووي المأخوذة من فيروساتٍ مختلفة (قد يتراوح هذا العدد من بضعة مقاطع إلى مئات)، تفصل بينها تسلسلات متكرّرة من الحمض النووي البكتيري (انظر الشكل 1). وتعمل قطع كريسبر هذه كـنظام ذاكرة يسمح للبكتيريا بالتعرّف بسرعة على الحمض النووي الفيروسي إذا حاول دخولها مرة أخرى، وباستخدام بروتينات خاصة تُسمّى بروتينات كاس، تتمكن البكتيريا ليس فقط من اكتشاف الحمض النووي الغريب بل والتخلّص منه نهائيًا. ويُعرف النظام المتكامل المكوَّن من الحمض النووي الريبي وبروتينات كاس باسم نظام كريسبر-كاس [2].
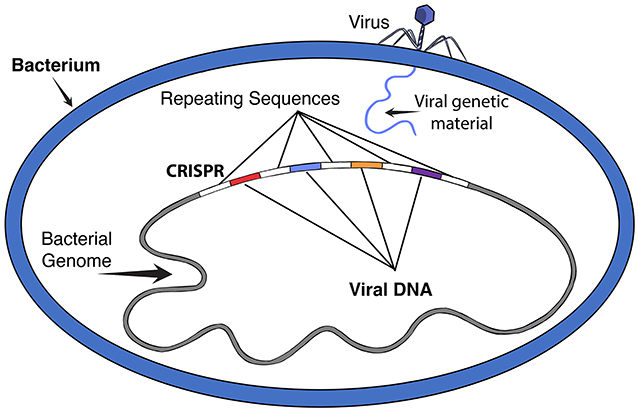
- شكل 1 - كريسبر داخل خلية بكتيرية.
- عندما تهاجم فيروسات خلية بكتيرية، تحتفظ البكتيريا بنسخة من الحمض النووي الفيروسي في موقع خاص داخل جينومها يُسمّى كريسبر. وتنفصل قطع الحمض النووي الفيروسي عن بعضها البعض بتسلسلات متكرّرة من الحمض النووي البكتيري متساوية التباعد. ويعمل هذا المقطع من كريسبر في الجينوم البكتيري كنظام ذاكرة، يسمح للبكتيريا بالتعرف بسرعة على أي إصابات مستقبلية قد تسببها فيروسات مشابهة والاستجابة لها.
كريسبر-كاس9: تقنية ثورية لتعديل الجينات
سمعتُ عن تقنية كريسبر لأول مرة حوالي عام 2006، في ذلك الوقت، بدأ العلماء يدركون أن تقنية كريسبر تمنح البكتيريا مناعة ضد الفيروسات [3]، غير أن آلية حدوث ذلك كانت مجهولة. وعندما بدأتُ العمل مع إيمانويل شاربنتييه، افترضنا أن هذه الآلية تنطوي على بروتين يعمل على تقطيع الحمض النووي الفيروسي، أو ≪شطره≫ إلى أجزاء.
لقد كنا نعلم بوجود بروتين يُسمّى كاس9، يُعرف بتعاونه مع نظام كريسبر، لكن وظيفته ظلت غير معروفة آنذاك [4]. وهكذا بدأ تعاون بين مختبرينا، بقيادة طالبين موهوبين هما مارتن جينيك وكريستوف شيلنسكي، لدراسة هذا البروتين الغامض كاس9.
كنا نعرف أن بروتين كاس9 يجب أن يجد بطريقةٍ ما الحمض النووي الفيروسي المحدد، وكانت نظريتنا تفترض أنه في حالة ربط بروتين كاس9 بجزء من الحمض النووي الريبي الذي يتطابق مع الحمض النووي الفيروسي، فقد يتحدان معًا، ويؤدي هذا النظام إلى توجيه بروتين كاس9 إلى الموقع الصحيح في الجينوم. لذلك، جمعنا بروتين كاس9 مع حمض نووي ريبي يتطابق مع جزء من تسلسل كريسبر (ويُعرف باسم crRNA) لنرى إن كان سيتمكّن من قطع تسلسل الحمض النووي الرِّيبي منقوص الأكسجين المستهدف الذي أردنا تغييره، لكن لم يحدث شيء. فلم يدفعنا هذا إلى الاستسلام، بل أخذنا في الاعتبار احتمال أن يكون ثمة جزء مفقود من اللغز. وجاء الحل على شكل قطعة إضافية من الحمض النووي الريبي كان مختبر إيمانويل يعمل عليها، تُسمى الحمض النووي الريبي المُنشِّط العابر لكريسبر (tracrRNA) [5]. فدمجنا جزيء tracrRNA مع جزيء crRNA وبروتين كاس9 وأعدنا التجربة، وهذه المرة، نجح المركب في استهداف قطعة محددة من الحمض النووي الرِيبي منقوص الأكسجين وقطعها (انظر الشكل 2). لقد اكتشفنا أن نظام كريسبر-كاس9 الطبيعي هو نظام قطع للحمض النووي الرِيبي منقوص الأكسجين موجه بواسطة حمضين نوويين ريبيين، حيث يلزم وجود قطعتين مختلفتين من الحمض النووي الريبي لتقطيع الحمض النووي الفيروسي.
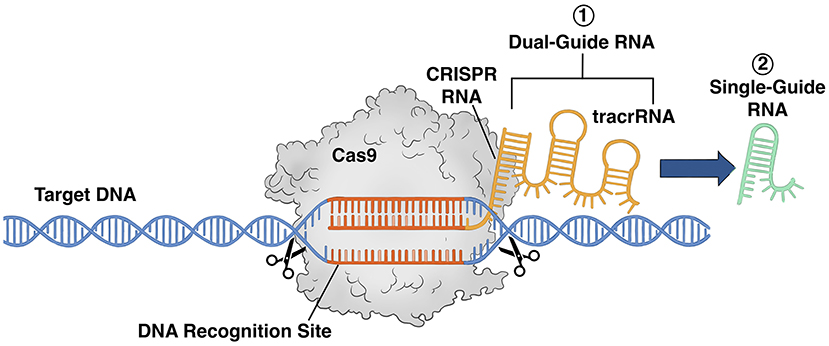
- شكل 2 - نظام كريسبر-كاس9.
- (1) كان نظام القطع الأصلي كريسبر-كاس9 الذي طورناه يحتوي على بروتين يُسمّى كاس9 يحمل قطعتين من الحمض النووي الريبي (هما crRNA وtracrRNA)، وكان نظام الحمض النووي الريبي ثنائي التوجيه هذا قادرًا على التعرّف على جزء محدد من الحمض النووي الرِيبي منقوص الأكسجين المستهدف وقطعه. (2) بعد ذلك عملنا على تصميم هاتين القطعتين من الحمض النووي الريبي الخاصتين بالنظام ثنائي التوجيه وتبسيطهما وحولناهما إلى قطعة واحدة تُسمّى الحمض النووي الريبي أحادي التوجيه. وقد حوّل هذا الابتكار نظام كريسبر-كاس9 إلى نظام قادر على التعرّف على أي قطعة من أي حمض نووي يثير اهتمام العلماء وقطعه.
وبعد ذلك، ركّزنا جهودنا على تبسيط هذه العملية، وذلك بتحديد الأجزاء الأساسية في كلٍ من جزيئي crRNA وtracrRNA، وتطوير نظام أكثر كفاءة وانسيابية. لقد دمجنا الأجزاء الأساسية في قطعة واحدة مصمّمة من الحمض النووي الريبي، مما حوّل النظام إلى نظام قطع للحمض النووي موجّه بواسطة حمض نووي ريبي واحد (انظر الشكل 2) [2, 6]. وقد كان هذا الإنجاز غاية في الأهمية، لأن إنتاج قطعة واحدة مطلوبة من الحمض النووي الريبي في المختبر أسهل بكثير من الجمع بين قطعتين مختلفتين بشكل موثوق. وللتعمق أكثر في معرفة نظام كريسبر-كاس9، يمكنك مشاهدة هذا الفيديو.
ساهمت دراسات إضافية من عدة مجموعات بحثية في كشف بنية بروتين كاس9 وتوضيح تفاصيل إضافية لعملية القطع. وقد خلصت إلى أن مركّب كريسبر-كاس9، عندما يصل إلى الموقع الصحيح على جزيء الحمض النووي الرِيبي منقوص الأكسجين المكوَّن من شريطين ملتفين معًا، فإنه يبدأ أولًا بفصل هذين الشريطين. ثم تلتصق القطعة الخاصة بالحمض النووي الريبي من نظام كريسبر بالتسلسل المطابق في الحمض النووي الرِيبي منقوص الأكسجين. وبعد ذلك، يستخدم المركّب ≪مقصات جزيئية≫ صغيرة لقطع كلا الشريطين من الحمض النووي الرِيبي منقوص الأكسجين (لمعرفة المزيد عن بنية بروتين كاس9 وعملية القطع، يُرجى مشاهدة هذا الفيديو). وبمجرد أن يُقطع الحمض النووي الرِيبي منقوص الأكسجين، تُفعَّل آليات إصلاحه داخل الخلية. ويستفيد العلماء من قدرة كريسبر على استهداف موقع محدد في الحمض النووي الرِيبي منقوص الأكسجين لإجراء عملية القطع والإصلاح، بحيث يمكنهم حذف أي جزء منه أو تغييره أو استبداله، وتُعرَف هذه العملية باسم تعديل الجينات أو تعديل الجينوم.
وبعد اكتشافنا الأولي وتبسيط نظام كريسبر-كاس9 لتعديل الجينات، طوّرنا العديد من الأنظمة الأخرى التي تحتوي على أنواع مختلفة من بروتين كاس، وبذلك توسّع مجال تقنية كريسبر-كاس إلى حدٍ كبير. فيمكن إجراء تعديل الجينات باستخدام أنظمة كريسبر-كاس في جميع الخلايا الحية، بما في ذلك الإنسان والحيوانات والكائنات الدقيقة والنباتات، مما يجعلها تقنية ≪متعددة المجالات≫ بحيث لا تؤثر فقط على البحث العلمي الأساسي، بل تمتلك أيضًا إمكانات كبيرة في مجالات الطب والزراعة وحتى مكافحة تغيّر المناخ.
تقنية كريسبر وعلاقتها بصحة الإنسان
يمكن أن يُسهم تعديل الجينات باستخدام تقنية كريسبر في تحسين صحة الإنسان بعدة طرق (انظر الشكل 3)، منها علاج الأمراض. وثمة أكثر من 7,000 مرض وراثي بشري، تنتج عن أخطاء في جينات محددة ويمكن أن تنتقل من الوالدين إلى الأبناء، وتشمل: فقر الدم المنجلي، حيث يتغير شكل خلايا الدم الحمراء فلا تستطيع حمل الأكسجين بشكل صحيح؛ والتليف الكيسي، حيث يؤدي الإفراز غير الطبيعي للمخاط إلى تلف الرئتين؛ ومرض هنتنغتون، حيث يؤدي تراكم بروتين غير طبيعي إلى تلف خلايا الدماغ.
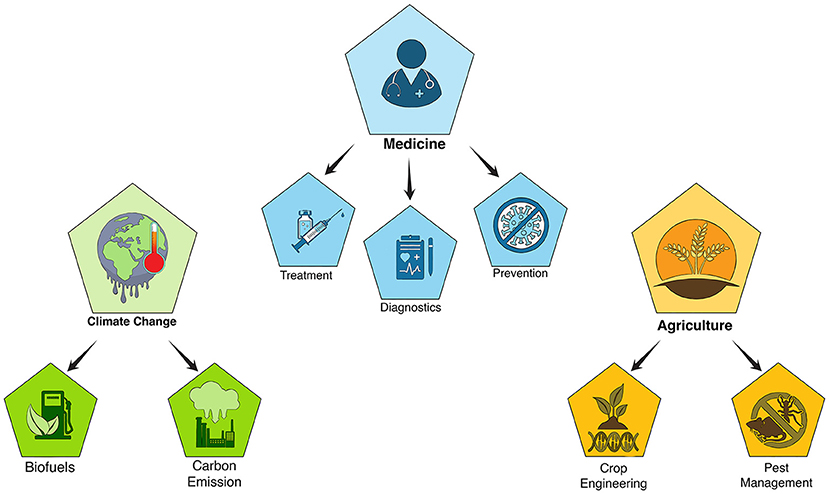
- شكل 3 - أمثلة على تطبيقات كريسبر.
- تقنيات تعديل الجينات باستخدام كريسبر لها تطبيقات في مجالات متعددة، منها الطب والزراعة ومكافحة تغيّر المناخ.
وإذا أجرينا تعديلًا للجينات الطافرة لدى الأشخاص المصابين بهذه الأمراض، فقد نتمكن من تصحيح الأخطاء ومنع حدوث الأمراض. وقد حقق استخدام تقنية كريسبر بالفعل نجاحات ملحوظة في معالجة الاضطرابات الوراثية، بعلاج مريض مصاب بفقر الدم المنجلي (لمعرفة المزيد من المعلومات، اطلع على هذا المقال) أو شخص يعاني من مرض بصري يُسمى عمى ليبر الخلقي، (لمعرفة المزيد من المعلومات، اطلع على هذا المقال). كما يمكن استخدام تقنية كريسبر لعلاج الأمراض غير الوراثية -مثل الإيدز- حيث يتضرر جهاز المناعة لدى الشخص، بسبب فيروس يُعرف باسم HIV، ويمكن لتقنية كريسبر استهدافه لإزالة حمضه النووي الرِيبي منقوص الأكسجين من خلايا المريض [7]. ويُعدّ السرطان مثالًا آخر مهمًا، حيث يمكن استخدام تقنية كريسبر لتعزيز قدرة خلايا الجهاز المناعي في الجسم على استهداف خلايا السرطان وقتلها [8].
وأحد التطبيقات الأخرى لها هو الوقاية من الأمراض قبل ظهورها، وهو مجال في الطب يُعرف باسم الطب الوقائي، يمكنه أن يحد من الكثير من معاناة البشر وأن يحافظ على الموارد القيّمة، مثل التمويل والمواد، التي كان من الممكن استخدامها لعلاج الأمراض. ويمكن استخدام تقنية كريسبر لتعديل بعض الجينات المرتبطة بالأمراض بطريقة إيجابية عن طريق إدخال طفرات ≪جيدة≫ تمنع تطوّر المرض في المستقبل، فيمكن -مثلًا- تطبيق الطب الوقائي المعتمد على تقنية كريسبر للوقاية من أمراض القلب [9]، ومرض الزهايمر [10]، ومنع انتشار الأمراض المُعدية. كما يمكن استخدام تقنية كريسبر لتشخيص المرضى وعلاجهم بسرعة عن طريق اكتشاف الحمض النووي الرِيبي منقوص الأكسجين لفيروسات (مثل SARS-CoV-2) في المرضى أو في الحيوانات [11, 12]. ويساعد هذا الاكتشاف المبكر الأطباء على اتخاذ الإجراءات اللازمة لمنع انتشار المرض، مثل تطبيق إرشادات العزل المبكر. كما أن استخدام تقنية كريسبر في القضاء على الكائنات المسببة للأمراض لدى الأشخاص المصابين قد يُسهم في الحدّ من انتشار العدوى [13].
وقد تُستخدم تقنية كريسبر لتعديل الجينات أيضًا في مكافحة الأمراض التي تنتقل من الحيوانات إلى الإنسان، فعلى سبيل المثال، تنتقل بعض الأمراض مثل الملاريا إلى البشر عن طريق البعوض. ويستطيع العلماء -باستخدام تقنية كريسبر- تعديل جينات خلايا البويضات والحيوانات المنوية في البعوض بحيث يصبح نسلها غير قادر على إصابة الإنسان بالملاريا [14]، ويعني هذا إمكانية تعديل مجموعات كاملة من البعوض لتصبح غير ضارة بالبشر. ويُعرف هذا النهج باسم تعديل الجينوم في الخلايا التناسلية، وهو يتجاوز تعديل جينات فرد واحد كما ذكرنا سابقًا، إذ يتيح لنا استخدام تقنية كريسبر لتعديل الجينات عبر أجيال متعددة من الكائنات الحية.
استخدامات أخرى لتقنية كريسبر
يمكن أيضًا استخدام تقنيات تعديل الجينات المعتمدة على كريسبر لتعديل جينات النباتات، مما يعزز من القيمة الغذائية للمحاصيل [15] أو تعديل الأطعمة مثل الفول السوداني لتقليل مسببات الحساسية. ومن الممكن كذلك تحسين صفات محددة في المحاصيل لزيادة كمية الغذاء المحصودة أو لتعزيز قدرة النباتات على مقاومة الأمراض أو الحشرات أو الجفاف أو درجات الحرارة القصوى. ولمكافحة آفات المحاصيل الزراعية مباشرةً، يمكننا الاستعانة بتقنية كريسبر لتعديل جينات الحشرات بحيث نُقلّل من قدرتها على إتلاف النباتات [16]، إذ تسعى إحدى الاستراتيجيات إلى إشاعة العقم في مجتمع الحشرات الضارة، ما يجعلها عاجزة عن التكاثر.
وبعيدًا عن الزراعة، يمكن تطبيق تقنيات كريسبر للتصدي لتغيّر المناخ؛ وأحد التوجهات المحتملة لتحقيق ذلك هو هندسة كائنات حية مثل الطحالب وراثيًا بحيث تنتج الوقود الحيوي الذي يمكن استخدامه لتشغيل المنازل والسيارات، أو لإزالة ثاني أكسيد الكربون من الجو عبر امتصاصه. وقد يكون من الممكن أيضًا تعديل جينومات الميكروبات لتوجيه تفاعلها مع النباتات بحيث تخزِّن ثاني أكسيد الكربون بدل إطلاقه في الهواء.
لا يزال الطريق أمامنا طويلًا
رغم إحراز تقدّم كبير في تطبيق تقنية كريسبر في العديد من المجالات، لا يزال الطريق أمامنا طويلًا لمعالجة بعض التحديات والقيود. فعلى سبيل المثال، تُعد آلية توصيل تقنيات كريسبر إلى الخلايا المستهدفة إحدى المشكلات الرئيسية الحالية، خاصةً عند استخدامها مع البشر [17]؛ فمن الصعب ضمان وصول مركّبات كريسبر–كاس إلى الخلايا الصحيحة وليس إلى خلايا أخرى غير مستهدفة بالعلاج. ولتحسين عملية التوصيل، يعكف الباحثون على دراسة أنظمة كريسبر أخرى غير نظام كريسبر–كاس9 المُشار إليه في هذا المقال. فقد تبيّن -مثلًا- أن بعض الفيروسات أيضًا تمتلك أنظمة كريسبر–كاس خاصة بها [18] تحتوي على بروتينات كاس أصغر حجمًا، مما قد يجعل توجيهها إلى الخلايا المحددة أسهل. كما نعمل على اكتشاف بروتينات كاس جديدة وتعديل البروتينات المعروفة لتحسين أدائها، كأن تصبح أكثر كفاءة في تحديد تسلسلات الحمض النووي الرِيبي منقوص الأكسجين المطابق وأكثر دقة في قطعها.
ويمكننا أيضًا تصميم بروتينات كاس قادرة على الكشف عن الحمض النووي الريبي وقصه بدلًا من الحمض النووي الرِيبي منقوص الأكسجين [19]، وهو ما سيكون مفيدًا في مكافحة الفيروسات التي تمتلك الحمض النووي الريبي كمادتها الوراثية.
إضافةً إلى ذلك، يمكننا تحسين جزيئات crRNA المُوجِّهة التي تحملها بروتينات كاس، حيث نَتَّبِع في ذلك زاوية مختلفة لمعالجة هذه التحديات، عن طريق تحديد أفضل تسلسلات جزيء crRNA لكل استخدام على حدة. تمثل كل هذه المجالات آفاقًا بحثية قد تؤدي إلى تطورات ثورية في مجالات حيوية مثل الرعاية الصحية وإنتاج الغذاء.
الاعتبارات الأخلاقية
لقد أثبتت تقنية كريسبر أنها قوية وفعّالة للغاية، وأنها قد تغيّر طريقة تعاملنا مع الطبيعة ومع بعضنا البعض. ومع ذلك، يجب أن نتوخى الحذر دائمًا وأن نتحلى بالقدر اللازم من المسؤولية عند التعامل مع تقنية بهذا القدر من التأثير. فتخيّل -مثلًا- أن يكون لدينا القدرة على تصميم ≪بشر محسّنين≫ بصفات وقدرات محددة، أو على تعديل العديد من الحيوانات والنباتات من حولنا بكفاءة عالية. قد يؤدي ذلك إلى تغييرات جذرية في مسار التطور الطبيعي. للاطلاع على مزيد من المعلومات حول المسؤولية الأخلاقية المرتبطة بتقنية كريسبر، يُمكن الرجوع إلى القسم الأخير من هذه الورقة البحثية.
في عام 2015، كنتُ أول من دعا إلى فرض حظر عالمي على جميع أنشطة تقنية كريسبر المتعلقة بتعديل الجينوم البشري في الخلايا التناسلية، وذلك بعد أن اضطلع عالِم صيني بتعديل جينومات توأم في مرحلة الأجنة. وكانت هذه الدعوة بمثابة موقف شخصي ضد الاستخدام غير المسؤول لتقنية كريسبر. ومنذ ذلك الحين، بُذلت العديد من الجهود الملموسة الأخرى لضمان الاستخدام المسؤول لهذه التقنية [20].
وكمجتمع بحثي، يجب أن نحرص على أن يكون تطبيقنا لتقنية كريسبر آمنًا ونافعًا للجميع، وينبغي للعلماء أن يساهموا في توعية الجمهور وفهمه لاستخدامات تقنية كريسبر، إلى جانب التأكيد على أهمية وضع إرشادات أخلاقية واضحة، تتضمن تحديد الحالات التي يُعد فيها استخدام تقنية كريسبر في البشر آمنًا بما فيه الكفاية. كما ينبغي لنا سنّ سياسات وتشريعات تضمن الالتزام بهذه الإرشادات [21]. ومن الضروري أن نتوخى الحذر وأن نتجنّب استخدام هذه التقنية المؤثرة قبل وضع الأسس الأخلاقية اللازمة لها. فإذا واصلنا التصرف بعقلانية ومسؤولية، فإن تقنية كريسبر قد تُسهم في بزوغ عصر جديد من الفوائد الإيجابية طويلة الأمد لجنسنا البشري.
نصائح للعلماء الصغار
لقد كانت العلوم بالنسبة لي طوال حياتي رحلة اكتشاف وسعيًا للإجابة عن أسئلة لم نجد لها إجابات بعد، حيث أتعامل دائمًا مع الأسئلة العلمية بروح من الدهشة والفضول، إذ أن تجربة بسيطة في المختبر قد تُنتج معلومة جديدة أكون أنا أول شخص يكتشفها في العالم.
إن الأمر أشبه بتقشير طبقات البصلة، حيث نكشف طبقة تلو الأخرى من حقائق العالم من حولنا، وأجد في ذلك إثارة ومتعة لا توصفان.
لقد نشأتُ في بيئة متواضعة جدًا، فلم يكن في أسرتي أيّ عالم، وخلال طفولتي ومسيرتي التعليمية، واصلت اتباع فضولي والسير وراء ما يثير اهتمامي الحقيقي، حتى في أحلك الأوقات. وهذا ما أنصح به الجيل القادم من العلماء: قد لا تعرف إلى أين سيقودك فضولك، لكن ثابر واتّبعه على أي حال! فأنا بالتأكيد لم أكن أعلم أن افتتاني المبكر بتقنية كريسبر سيقود يومًا إلى ابتكار يغيّر العالم ويترك أثرًا في مختلف فروع العلم.
فاعلم يا عزيزي أن الإصرار هو السبيل إلى التغلب على الخوف؛ فكلٌّ منّا، في مرحلةٍ ما، يساوره الشكّ فيما إذا كان سينجح في مسعاه، أو ما إذا كنا سنُحرِج أنفسنا في خضم هذا السعي. وتلك المخاوف طبيعية تمامًا، ولا يسعنا تجاهلها، ولكن يمكننا السيطرة عليها من خلال البحث عن مصادر الدعم والمضيّ قدمًا بكل بساطة. وحين تجد نفسك مضطرًا إلى اتخاذ قرارات صعبة أو تشعر بالقلق حيال الخطوة التالية، تذكّر أن تتقبل احتمالية النجاح واحتمالية الفشل، فشغفك هو ما سيرشدك إلى الاتجاه الصحيح. وأيّ شخص يمكنه أن يجد في نفسه الشجاعة الكافية لاتخاذ تلك الخطوة الحاسمة، حتى وإن كانت مخيفة،
وربما تكون أنت أيضًا شغوفًا بالإجابة عن الأسئلة المرتبطة بالعالم الطبيعي. إن كان ذلك يثير اهتمامك، فأنا أشجّعك على متابعة مسيرتك في مجال العلوم، فالعلماء الشباب اليوم يمتلكون أدوات قوية للغاية مثل تقنية كريسبر، وهذا ما يجعل عملنا في المجال العلمي مليئًا بالإثارة والتحدي في آنٍ واحد (انظر الشكل 4).

- شكل 4 - مستقبل العلم.
- ستستمر التقنيات العلمية مثل كريسبر في التطوّر والتحسّن الآن وفي السنوات القادمة، وستصبح أكثر إتاحةً للعلماء حول العالم. إن الاحتمالات التي يحملها المستقبل تجعل طريق العالِم الشاب مليئًا بالإثارة، لكنها في الوقت ذاته تحمّله مسؤولية عظيمة؛ فعلى الباحثين أن يلتزموا بأن يكون لعملهم أثر إيجابي على البشر وعلى العالم الطبيعي الأوسع الذي نُشكّل جزءًا منه.
فمسؤوليتنا كعلماء هي أن نحرص على استخدام هذه الأدوات بحكمة، حتى يكون لعملنا أثر إيجابي على حياة الإنسان وعلى البيئة التي نعيش فيها.
مواد إضافية
- للتعرّف أكثر على تقنية كريسبر وتأثيراتها الأخلاقية، يمكنك زيارة صفحة معهد الجينوميات المبتكرة التابع للأستاذة Doudna التي تحتوي على العديد من الموارد والفيديوهات: https://innovativegenomics.org/what-is-crispr/.
- ولمعرفة المزيد حول كيفية استخدام تقنية كريسبر لتعديل الجينات، يمكنك مشاهدة هذا الفيديو.
مسرد للمصطلحات
الحمض النووي الرِيبي منقوص الأكسجين (DNA) (DNA): ↑ هو دليل التعليمات الخاصّ بالخلايا الحيّة.
الجينوم (Genome): ↑ هو جميع المعلومات الوراثية للكائن الحي.
الجين (Gene): ↑ هو جزء من الحمض النووي الريبي منقوص الأكسجين يحدد وظيفة أو صفة معينة في الكائن الحي.
الحمض النووي الريبي (RNA): ↑ هو نسخة متحركة من الحمض النووي الريبي منقوص الأكسجين تؤدي دور ≪الوسيط≫ بينه وبين البروتينات.
الجهاز المناعي (Immune System): ↑ هو النظام الذي يساعد الكائنات الحية على الحفاظ على صحتها ومكافحة الأمراض.
كريسبر (CRISPR): ↑ هو نظام موجود في الجينوم البكتيري يساعد البكتيريا على مقاومة العدوى الفيروسية، وهو اختصار لعبارة ≪التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد≫.
نظام كريسبر-كاس (CRISPR-Cas System): ↑ هو نظام داخل البكتيريا يستخدم الحمض النووي الريبي لكريسبر وبروتينات كاس (المرتبطة بكريسبر) لاكتشاف الحمض النووي الفيروسي وإزالته.
تعديل الجينوم في الخلايا التناسلية (Germline Genome Editing): ↑ هو تعديل الجينات في خلايا البويضة والحيوانات المنوية للوالدين بحيث تنتقل الجينات المُعدلة إلى نسلهم.
الوقود الحيوي (Biofuels): ↑ هو وقود يُصنع من النباتات أو الطحالب أو مخلفات الحيوانات.
إقرار تضارب المصالح
يعلن المؤلفون أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
شُكر وتقدير
أود شكر أور رافاييل على إجراء المقابلة التي استند إليها هذا المقال وعلى مشاركتي في تأليفه، كما أتوجه بالشكر إلى أفياد ساجفيتش على توفير الأشكال.
إفصاح أدوات الذكاء الاصطناعي
تم إنشاء النص البديل (alt text) المرفق بالأشكال في هذه المقالة بواسطة "فرونتيرز" (Frontiers) وبدعم من الذكاء الاصطناعي، مع بذل جهود معقولة لضمان دقته، بما يشمل مراجعته من قبل المؤلفين حيثما كان ذلك ممكناً. في حال تحديدكم لأي خطأ، نرجو منكم التواصل معنا.
المراجع
[1] ↑ Sorek, R., Kunin, V., and Hugenholtz, P. 2008. CRISPR—a widespread system that provides acquired resistance against phages in bacteria and archaea. Nat. Rev. Microbiol. 6:181–186. doi: 10.1038/nrmicro1793
[2] ↑ Makarova, K. S., Haft, D. H., Barrangou, R., Brouns, S. J., Charpentier, E., Horvath, P., et al. 2011. Evolution and classification of the CRISPR–Cas systems. Nat. Rev. Microbiol. 9:467–477. doi: 10.1038/nrmicro2577
[3] ↑ Barrangou, R., Fremaux, C., Deveau, H., Richards, M., Boyaval, P., Moineau, S., et al. 2007. CRISPR provides acquired resistance against viruses in prokaryotes. Science 315:1709–1712. doi: 10.1126/science.1138140
[4] ↑ Haft, D. H., Selengut, J., Mongodin, E. F., and Nelson, K. E. 2005. A guild of 45 CRISPR-associated Cas protein families and multiple CRISPR/Cas subtypes exist in prokaryotic genomes. PLoS Comput. Biol. 1:e60. doi: 10.1371/journal.pcbi.0010060
[5] ↑ Deltcheva, E., Chylinski, K., Sharma, C. M., Gonzales, K., Chao, Y., Pirzada, Z. A., et al. 2011. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature 471:602–607. doi: 10.1038/nature09886
[6] ↑ Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., and Charpentier, E. 2012. A programmable dual-RNA–guided DNA endonuclease in adaptive bacterial immunity. Science 337:816–821. doi: 10.1126/science.1225829
[7] ↑ Ebina, H., Misawa, N., Kanemura, Y., and Koyanagi, Y. 2013. Harnessing the CRISPR/Cas9 system to disrupt latent HIV-1 provirus. Sci. Rep. 3:1–7. doi: 10.1038/srep02510
[8] ↑ Mollanoori, H., Shahraki, H., Rahmati, Y., and Teimourian, S. 2018. CRISPR/Cas9 and CAR-T cell, collaboration of two revolutionary technologies in cancer immunotherapy, an instruction for successful cancer treatment. Hum. Immunol. 79:876–882. doi: 10.1016/j.humimm.2018.09.007
[9] ↑ Rezaei, H., Farahani, N., Hosseingholi, E. Z., Sathyapalan, T., and hossein Sahebkar, A. 2020. Harnessing CRISPR/Cas9 technology in cardiovascular disease. Trends Cardiovasc. Med. 30:93–101. doi: 10.1016/j.tcm.2019.03.005
[10] ↑ Bhardwaj, S., Kesari, K. K., Rachamalla, M., Mani, S., Ashraf, G. M., Jha, S. K., et al. 2021. CRISPR/Cas9 gene editing: New hope for Alzheimer’s disease therapeutics. J. Adv. Res. 40:207–21. doi: 10.1016/j.jare.2021.07.001
[11] ↑ Kaminski, M. M., Abudayyeh, O. O., Gootenberg, J. S., Zhang, F., and Collins, J. J. 2021. CRISPR-based diagnostics. Nat. Biomed. Eng. 5:643–656. doi: 10.1038/s41551-021-00760-7
[12] ↑ Hou, T., Zeng, W., Yang, M., Chen, W., Ren, L., Ai, J., et al. 2020. Development and evaluation of a rapid CRISPR-based diagnostic for COVID-19. PLoS Pathog. 16:e1008705. doi: 10.1371/journal.ppat.1008705
[13] ↑ Ding, R., Long, J., Yuan, M., Jin, Y., Yang, H., Chen, M., et al. 2021. CRISPR/Cas system: a potential technology for the prevention and control of COVID-19 and emerging infectious diseases. Front. Cell. Infect. Microbiol. 11:639108. doi: 10.3389/fcimb.2021.639108
[14] ↑ Hammond, A., Galizi, R., Kyrou, K., Simoni, A., Siniscalchi, C., Katsanos, D., et al. 2016. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nat. Biotechnol. 34:78–83. doi: 10.1038/nbt.3439
[15] ↑ Jaganathan, D., Ramasamy, K., Sellamuthu, G., Jayabalan, S., and Venkataraman, G. 2018. CRISPR for crop improvement: an update review. Front. Plant Sci. 9:985. doi: 10.3389/fpls.2018.00985
[16] ↑ McFarlane, G. R., Whitelaw, C. B. A., and Lillico, S. G. 2018. CRISPR-based gene drives for pest control. Trends Biotechnol. 36:130–133. doi: 10.1016/j.tibtech.2017.10.001
[17] ↑ Lino, C. A., Harper, J. C., Carney, J. P., and Timlin, J. A. 2018. Delivering CRISPR: a review of the challenges and approaches. Drug Deliv. 25:1234–1257. doi: 10.1080/10717544.2018.1474964
[18] ↑ Pausch, P., Al-Shayeb, B., Bisom-Rapp, E., Tsuchida, C. A., Li, Z., Cress, B. F., et al. 2020. CRISPR-CasΦ from huge phages is a hypercompact genome editor. Science 369:333–337. doi: 10.1126/science.abb1400
[19] ↑ East-Seletsky, A., O'Connell, M. R., Knight, S. C., Burstein, D., Cate, J. H., Tjian, R., et al. 2016. Two distinct RNase activities of CRISPR-C2c2 enable guide-RNA processing and RNA detection. Nature 538:270–273. doi: 10.1038/nature19802
[20] ↑ The Royal Society, National Academy of Medicine, & International Commission on the Clinical Use of Human Germline Genome Editing. 2020. Heritable Human Genome Editing. Washington, DC: National Academy Press.
[21] ↑ Baylis, F., Darnovsky, M., Hasson, K., and Krahn, T. M. 2020. Human germline and heritable genome editing: the global policy landscape. CRISPR J. 3:365–377. doi: 10.1089/crispr.2020.0082
