ملخص
يصفه البعض بأنه ترياق سحري. ويشير إليه البعض الآخر على أنه معجزة، فما هو؟ الإيماتينيب هو عقار يُستخدم لعلاج نوع من سرطان الدم. وفي الوقت الراهن، يبقى المرضى الذين يتناولون الإيماتينيب على قيد الحياة فترة متوسطها 30 عامًا. ويعني هذا أن معظمهم يمكنه العيش المدة نفسها التي يعيشها أي شخص آخر. وهذا أمر مدهش! ففي الثمانينيات، كان من المتوقع أن يعيش مريض السرطان من 3 إلى 5 سنوات فقط. لك أن تتخيل التأثير المدمر لهذه المعلومة على المريض وعائلته! ولكن، كيف طوّرنا عقار إيماتينيب؟ ولماذا يُعد إيماتينيب دواءً معجزة؟ ولماذا تُعتبر القصة وراء هذا العقار مميزة للغاية؟ للإجابة عن هذه الأسئلة، علينا السفر بالزمن إلى الماضي. يصف لنا هذا المقال الاكتشاف المذهل لعقار إيماتينيب، الذي هو الترياق السحري لعلاج سرطان الدم، والجهود التي بذلها العلماء الذين يقفون وراء هذا الاكتشاف، والدروس التي استفدناها من تطوير هذا العقار.
مقدمة
منذ اكتشاف الحمض النووي -وهو الشفرة الوراثية التي تنظّم حياة كل خلية وموتها- ازدهر التقدم في مجال الطب. وبصفتنا علماء، فإننا نفهم الأمراض بصورة أفضل، ومن ثمّ يمكننا تطوير علاجات أفضل.
السرطان مرض خطير. وعلى مدى عقود من الزمان، استخدم الأطباء عقاقير سيئة لعلاج السرطان. تُعد بعض عقاقير علاج السرطان سيئة لأنها لا تميز بين الخلايا السرطانية والخلايا السليمة، وبالتالي تقتل كليهما. ويعني هذا أن المرضى قد تعتّل صحتهم أثناء العلاج. أما إيماتينيب فهو العقار الأول المتاح للمرضى المصابين بنوع نادر من السرطان يؤثر على خلايا الدم. وفي هذا المقال، سنأخذك معنا في جولة للتعرُّف على النجاح الباهر لعقار إيماتينيب.
لنتحدث قليلًا عن سرطان الدم. ما هو ابيضاض الدم النقوي المزمن؟
عندما تذهب إلى الطبيب، فإنك تخبره عن أعراضك وتتوقع أن يتوصل إلى تشخيص ويصف لك علاجًا لتتحسن. في عام 1845، كان لدى الطبيبان جون بينيت في إدنبرة ورادولف ويرشو في برلين مرضى مصابين بأحد أمراض الدم. لم يعرف الطبيبان ماهية المرض، فلم يكن مذكورًا في كتبهما. وقد كانا أول من يصف أعراض هذا المرض الجديد. لقد كان سرطان الدم المعروف حاليًا باسم ابيضاض الدم النقوي المزمن [1, 2].
توجد في الدم ثلاثة أنواع من الخلايا: خلايا الدم الحمراء (كريات الدم الحمراء) التي تحمل الأكسجين للأنسجة والفضلات -مثل ثاني أكسيد الكربون- إلى الرئتين، وخلايا الدم البيضاء (كريات الدم البيضاء) التي تساعد في حمايتنا من العدوى، والصفائح الدموية (لويحات الدم) التي تبني ضمادة طبيعية لغلق الجروح. ويكون الدم -لدى المرضى المصابون بابيضاض الدم النقوي المزمن- مليئَا بالخلايا السرطانية التي تشغل كل المساحة التي تشغلها عادةً الأنواع المفيدة من خلايا الدم (شكل 1). إن هذا إلى حدٍ كبيرٍ هو كل ما كان معروفًا عن هذا المرض حتى عام 1956.
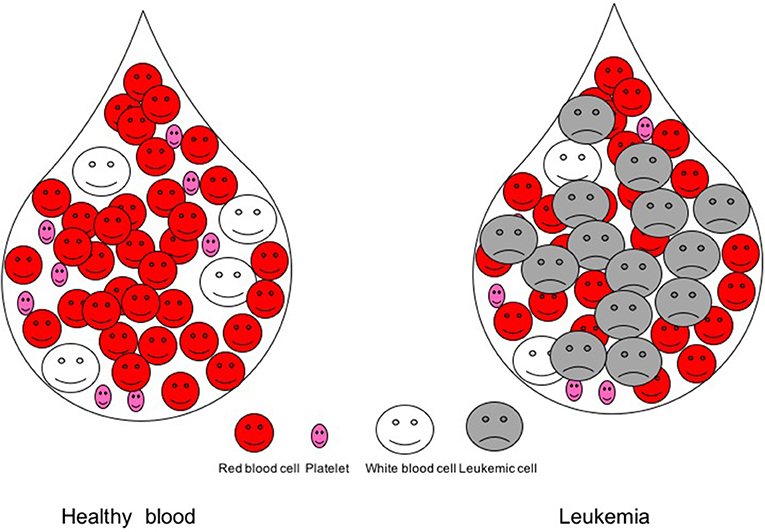
- شكل 1 - قطرة دم في شخص سليم وفي مريض مُصاب بابيضاض الدم.
- في قطرة دم الشخص السليم، ثمة الملايين من خلايا الدم الحمراء ومئات الآلاف من الصفائح الدموية وآلاف من خلايا الدم البيضاء. أما في دم المريض المُصاب بابيضاض الدم، تظهر الخلايا السرطانية -التي تُسمى الخلايا الابيضاضية- وتزاحم خلايا الدم الأخرى.
ما سبب الخلل الوظيفي في خلايا الدم؟
لم يبدأ العلماء في فهم ما حوّل خلايا الدم إلى خلايا سرطان ابيضاض الدم النقوي المزمن إلا في أواخر الخمسينيات من القرن الماضي. وفي عام 1953، اكتشف الأطباء روزاليند فرانكلين وجيمس واتسون وفرنسيس كريك الحمض النووي، وهو الشفرة الوراثية التي توجد فيها جميع المعلومات حول حياة الخلية [3]. وقد أدى اكتشاف الحمض النووي إلى تطوير مجالات وأساليب بحثية جديدة، ساعدت العلماء في نهاية المطاف على فهم كيفية تعبئة الحمض النووي في خلايانا وكيف يوجه الخلايا إلى ما يجب القيام به. ومع ذلك، إذا تحولت الخلية إلى خلية سرطانية، فلا بد أن شيئًا ما يحدث داخل الخلية ليجعلها هكذا!
وفي عام 1956، اكتشف الطبيبان جو تجو وألبرت ليفان أن الحمض النووي مُعبأ في 46 كروموسومًا (شكل 2). وبدأ العلماء في استخدام أساليب جديدة لعرض الكروموسومات وتحليلها ومقارنة كروموسومات الخلايا المأخوذة من أشخاص أصحاء بتلك المأخوذة من مرضى مصابين بأمراض مختلفة. وعلى هذا النحو، عرف العلماء أن ثمة علاقات بين الكروموسومات الشاذة والأمراض البشرية المختلفة. فقد اكتشفوا -مثلًا- أن الأطفال المصابين بمتلازمة داون لديهم نسخة إضافية من الكروموسوم 21. وحدّد عالمان -هما الطبيبان بيتر نويل وديفيد هنجرفورد وجود علاقة بين الشذوذ الكروموسومي وابيضاض الدم النقوي المزمن. فقد لاحظا وجود كروموسوم صغير غريب المظهر في الخلايا السرطانية المأخوذة من مريضين مصابين بهذا المرض. فهل كانت هذه محض مصادفة؟ للإجابة عن هذا السؤال، حلّل العالمان خمسة مرضى آخرين مصابين بالمرض نفسه ووجدا هذا الكروموسوم الصغير بصورة غير عادية في هؤلاء المرضى أيضًا. سرعان ما أُطلق على هذا الكروموسوم الصغير كروموسوم فيلادلفيا، على اسم المدينة التي اكتُشف فيها (شكل 3).
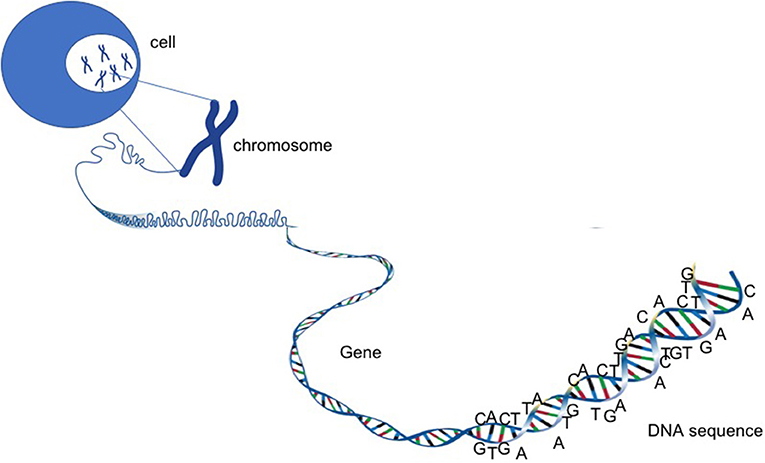
- شكل 2 - الكروموسومات والجينات والحمض النووي.
- الحمض النووي هو مادة طويلة جدًا ومتشابكة تشبه كرة الصوف. ويحتوي على جميع المعلومات اللازمة لحياة الخلية وموتها. وداخل الخلايا البشرية، يُنظّم الحمض النووي إلى 46 كروموسومًا. تُحمل كل معلومة في قسم مختلف من الكروموسومات. تُسمى هذه الأقسام الجينات. وكل جين هو عبارة عن وحدة تحمل شفرة بروتين له وظيفة محددة.
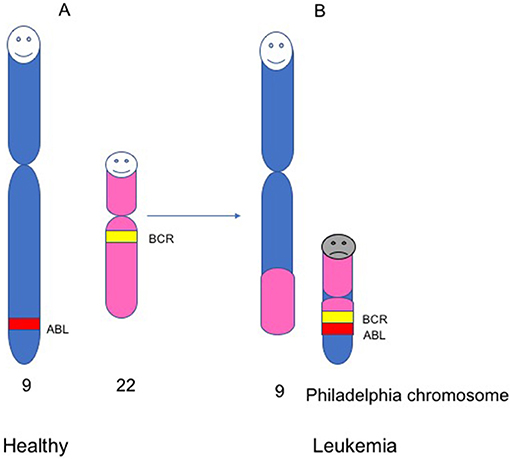
- شكل 3 - كروموسوم فيلادلفيا.
- يحمل الأشخاص الأصحاء 23 زوجًا من الكروموسومات (46 كروموسومًا في مجموعها). (A) الكروموسومان رقما 9 و22 لدى الأشخاص الأصحاء، وجينان داخل هذين الكروموسومين، هما ABL وBCR. (B) لدى المرضى المصابون بابيضاض الدم، ثمة تغيير في بنية الكروموسومين 9 و22. أثناء هذا التغيير، تندمج قطعة من الكروموسوم 22 مع قطعة من الكروموسوم 9. يؤدي هذا إلى ظهور كروموسوم صغير يُسمى كروموسوم فيلادلفيا، يندمج فيه الجينان BCR وABL لتكوين جين جديد، يُعرف باسم BCR-ABL.
هيا بنا نلقي نظرة فاحصة على كروموسوم فيلادلفيا
في العقود التي تلت اكتشاف كروموسوم فيلادلفيا، أصبح العلماء قادرين على دراسة تنظيم الكروموسومات وبنيتها من خلال المجهر. وقد سمح هذا لهم بفهم أي قطع من الحمض النووي كانت ملتصقة ببعضها البعض في كروموسوم فيلادلفيا. ورأت الدكتورة جانيت رولي، وهي عالمة أحياء في جامعة شيكاغو، أن الأمر شبيه بترتيب أحجية الصور المقطوعة. فقد حلّلت رولي لي خلايا مأخوذة من تسعة مرضى مصابين بابيضاض الدم النقوي المزمن واكتشفت أن كروموسوم فيلادلفيا يتكوّن من قطعة من الكروموسوم 9 ملتصقة بالكروموسوم 22 (شكل 3) [4]. ولما كان كل كروموسوم يتكوّن من مئات الجينات، فمن المحتمل أن يكون الاندماج بين الكروموسومين 9 و22 قد أدى إلى اندماج جينين معًا. ولكن أي جينين؟ لقد استغرق الأمر 10 سنوات أخرى حتى يجيب العلماء عن هذا السؤال. وكانت نتيجة جميع هذه الدراسات أن مرضى ابيضاض الدم النقوي المزمن لديهم جين يُسمى BCR-ABL، ناجم عن اندماج الجين BCR في الكروموسوم 22 والجين ABL في الكروموسوم 9 (شكل 3).
الجينات السيئة هي السبب في وجود البروتينات السيئة
لماذا يُعد الجين BCR-ABL سيئًا؟ في عام 1990، عرف علماء من جامعة كاليفورنيا وظيفة جين الاندماج BCR-ABL. تحتوي الجينات على المعلومات التي تحتاجها الخلية لإنتاج البروتينات. وتؤدي البروتينات العديد من الوظائف في الخلايا وتساهم في نمو الخلية وموتها. يُعد النمو والوفاة أمران بالغا الأهمية، لذلك يلزم تنظيم البروتينات التي تؤدي دورًا في التحكم في نمو الخلية وموتها تنظيمًا دقيقًا. تقع مسؤولية تنظيم النمو الطبيعي للخلايا على عاتق البروتينات التي تعمل مثل إشارات المرور. فعندما تكون الإشارة خضراء، تعرف الخلايا أن بإمكانها النمو. وعندما تكون الإشارة حمراء، تفهم الخلايا أن عليها التوقف عن النمو.
وينتج الجين BCR-ABL بروتينًا يؤدي إلى إضاءة الإشارة الخضراء باستمرار ويطلب من الخلايا أن تنمو. ولدى مرضى ابيضاض الدم النقوي المزمن، تفقد خلايا الدم السيطرة على نموها وتنمو بسرعة كبيرة، وهو أمر سيء للمرضى لأن الخلايا السرطانية تزاحم خلايا الدم السليمة والفعالة (شكل 1).
لذلك، بحلول عام 1990، عرف العلماء أن الجينين BCR وABL يندمجان معًا في كروموسوم فيلادلفيا ويكوّنان بروتينًا شاذًا مسؤولًا عن النمو السريع لخلايا الدم، يتسبب في ابيضاض الدم النقوي المزمن. وتعني حقيقة أن ابيضاض الدم النقوي المزمن ناجم عن خلل وظيفي في بروتين واحد أن مطوري الأدوية كان لديهم هدف واحد يتطلعون إليه لعلاج ابيضاض الدم النقوي المزمن: وهو أن عليهم إيقاف بروتين BCR-ABL وتحويل إشارة المرور من الأخضر إلى الأحمر.
من العلوم الأساسية إلى اكتشاف العقاقير
لسوء الحظ، لم يكن من السهل إيقاف بروتين مثل BCR-ABL في التسعينيات. فثمة مئات البروتينات المشابهة لبروتين BCR-ABL في خلايانا. والسؤال هو كيف يمكننا إيجاد طريقة لإيقاف بروتين BCR-ABL دون إيقاف جميع البروتينات الأخرى، مما قد يتسبب في قتل المرضى؟
عندما عرف العلماء المزيد عن بنية بروتين BCR-ABL والبروتينات المشابهة، أدركوا أن هذه البروتينات مختلفة قليلًا عن بعضها البعض وعن بروتين BCR-ABL. وقد كانت هذه التفاصيل أساسية لتصميم دواء مضاد لبروتين BCR-ABL.
وقد أجرى طبيب أمريكي، هو الدكتور بريان دروكر، بعض التجارب في المختبر لاختبار أدوية ممكنة لعلاج ابيضاض الدم النقوي المزمن. ووجد عقارًا واحدًا بدا واعدًا للغاية. وعندما أضاف العقار إلى الخلايا المُصابة بابيضاض الدم النقوي المزمن، توقفت عن النمو. والأهم من ذلك، أنه عندما أضاف العقار إلى الخلايا السليمة، لم يحدث شيء. ويعني هذا أن العقار آمن ولا يؤذي الخلايا السليمة. وقد كان هذا بالضبط ما يبحث عنه الدكتور دروكر! وبمساعدة طبيب بريطاني هو الدكتور جون جولدمان شجّع الدكتور دروكر شركات الأدوية على إنتاج هذا العقار، الذي يمكنه إيقاف بروتين BCR-ABL.
وصول عقار إيماتينيب إلى المرضى المصابين بابيضاض الدم النقوي المزمن
بعد ذلك بعامين -في عام 2001- تناول بعض المرضى المصابين بابيضاض الدم النقوي المزمن العقار في تجربة سريرية. يستخدم العلماء التجارب السريرية لاختبار العقاقير الجديدة على عدد صغير من المرضى. ويخضع فيها المرضى لمراقبة عن كثب وتُجرى اختبارات الدم، وإذا كان ثمة أي سبب للاعتقاد بأن العقار سام أو لا يعمل، يمكن للأطباء إيقاف العلاج بسرعة. وقد وجد الطبيب دروكر وزملاؤه أن الدواء قتل خلايا الدم السرطانية في جميع مرضى ابيضاض الدم النقوي المزمن تقريبًا [5]. وقد كانت هذه الاستجابة مذهلة. فقد كانت هذه هي المرة الأولى التي يلاحظ فيه الأطباء مثل هذه الاستجابة بإعطاء دواء واحد فقط مضاد للسرطان لمرضاهم، بدلًا من العديد من الأدوية السيئة المختلفة!
وقد استمر فريق الدكتور دروكر في متابعة المرضى لعدة سنوات. وبعد خمسة أعوام، لا يزال المرضى بدون أي خلايا سرطانية في دمائهم (شكل 4). وقد كانت هذه النتائج مثيرة للإعجاب!
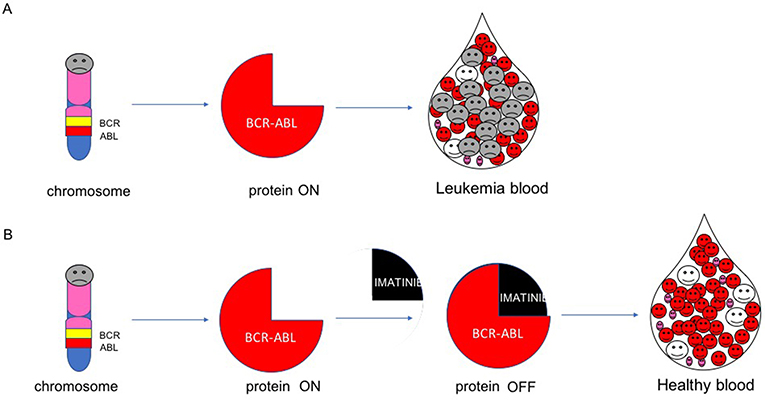
- شكل 4 - آلية عقار إيماتينيب.
- (A) يحمل جين BCR-ABL شفرة بروتين BCR-ABL. وعندما ينشط بروتين BCR-ABL، فإنه يجعل الخلايا الابيضاضية تواصل النمو. (B) يوقف عقار إيماتينيب بروتين BCR-ABL ويقتل الخلايا الابيضاضية.
الخاتمة
كان إيماتينيب اكتشافًا رائدًا، ليس فقط بسبب النتائج التي حققها وإنقاذه حياة الآلاف من المرضى، بل أيضًا بسبب طريقة تطوير هذا العقار وما تعلُّمه العلماء من تطويره. فقد علّم عقار إيماتينيب العلماء أن فهم بيولوجيا المرض -أي سبب «الخلل الوظيفي» في الخلية- قد يؤدي إلى التعرُّف على كيفية علاج المرض وشفائه. ومنذ ذلك الحين، يُستخدم هذا المنهج لتطوير عقاقير لأنواع السرطان الأخرى، مثل بعض أشكال سرطان المبيض والجلد والرئة. ولقد استغرق الأمر 41 عامًا منذ اكتشاف بروتين BCR-ABL حتى تطوير عقار إيماتينيب. غير أن التقدم العلمي يؤدي إلى تسريع وتيرة تطوير الأدوية. وبصفتنا علماء، نأمل أن يؤدي هذا التقدم بسرعة إلى قصص نجاح، مثل قصة الإيماتينيب. فترقبوا ذلك!
مسرد للمصطلحات
الحمض النَّووي الرِّيبي منقوص الأكسجين (DNA): ↑ هو مادة طويلة جدًا ومتشابكة تشبه كرة الصوف. وهو المادة التي تحمل جميع المعلومات اللازمة لحياة الخلية وموتها.
إيماتينيب (Imatinib): ↑ هو مثبط دوائي لبروتين BCR-ABL. فهو يرتبط ببروتين BCR-ABL ويوقف تشغيله.
ابيضاض الدم النقوي المزمن (Chronic myeloid leukemia (CML)): ↑ هو سرطان الدم. ويكون الدم -لدى المرضى المصابون بابيضاض الدم النقوي المزمن- مليئَا بالخلايا السرطانية التي تشغل كل المساحة التي تشغلها عادةً خلايا الدم الفعالة.
الكروموسومات (Chromosomes): ↑ هي بِنى مكونة من حمض نووي ملفوف. وداخل الخلايا البشرية، يُنظّم الحمض النووي إلى 46 كروموسومًا. يحتوي كل كروموسوم على مئات الجينات.
كروموسوم فيلادلفيا (Philadelphia chromosome): ↑ هو كروموسوم صغير شاذ تندمج فيه قطعة من الكروموسوم 22 مع قطعة من الكروموسوم 9.
الجينات (Genes): ↑ هي الوحدة الأساسية للحمض النووي. وكل جين يحمل شفرة بروتين له وظيفة محددة.
البروتينات (Proteins): ↑ هي اللبنات الأساسية التي يتكوّن منها كل شيء في الجسم.
إقرار تضارب المصالح
يعلن المؤلفون أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
المراجع
[1] ↑ Pray, L. 2008. Gleevec: the breakthrough in cancer treatment. Nat. Educ. 1:37.
[2] ↑ Mughal, T. I., Radich, J. P., Deininger, M. W., Apperley, J. F., Hughes, T. P., Harrison, C. J., et al. 2016. Chronic myeloid leukemia: reminiscences and dreams. Haematologica 101:541–58. doi: 10.3324/haematol.2015.139337
[3] ↑ Watson, J., and Crick, F. 1953. A structure for deoxyribose nucleic acid. Nature 171:737–8. doi: 10.1038/171737a0
[4] ↑ Rowley, J. D. 1973. A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature 243:290–3. doi: 10.1038/243290a0
[5] ↑ Druker, B. J, Talpaz, M., Resta, D. J., Peng, B., Buchdunger, E., Ford, J. M., et al. 2001. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N. Engl. J. Med. 344:1031–7. doi: 10.1056/NEJM200104053441401
