ملخص
تخيّل ابتلاع بعض الماء وأنت تسبح في بحيرة، شعور مزعج، أليس كذلك؟ ولكن هذا لا يُقارن بالموقف نفسه في البحر. إذا ما ابتلعت فجأة بعض قطرات المياه في البحر، فستسرع للبحث عن كوب ماء للتخلص من هذا الطعم المالح في فمك. ولكن هل فكرت يومًا في السبب وراء ملوحة ماء البحر؟ في هذه المقالة، سندخل عالم البحار المالحة ونعرّفك على أسرارها التي لم تكتشفها بعد. ما مصدر الملح في البحر؟ ما مكوناته وكيف يتم قياس درجة الملوحة؟ وأخيرًا، لماذا ينبغي لنا الاهتمام بملوحة البحر؟
ما الملح؟
لا يمكن اختصار الملح في هذا المسحوق الأبيض على طاولة الطعام الذي نضيفه إلى أطباقنا لجعلها لذيذة، بل هو أكبر من ذلك. فدعنا نتعمق في الموضوع إذَا. في البحر، 97% من الملح عبارة عن أيونات (ذرات أو جزيئات ذات شحنة كهربائية) مثل الصوديوم (Na+)، والكلوريد (Cl-)، والكبريت () (الشكل 1).
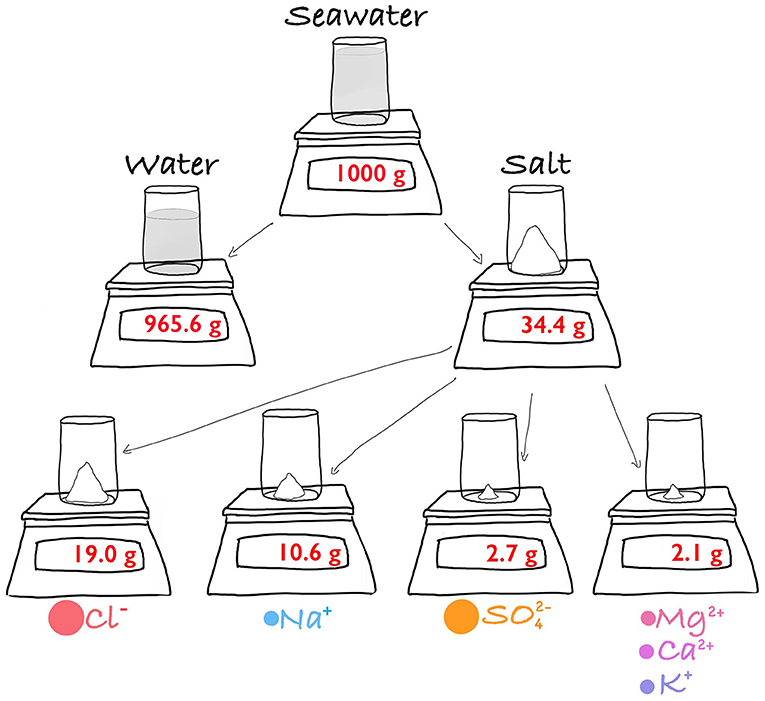
- شكل 1 - ماذا يوجد في كيلو واحد (1000 جم) من مياه البحر؟ يتكون الكيلو في الغالب من مياه (956.6 جم).
- والباقي (أكثر بقليل من 34 جم) عبارة عن مجموعة من الأملاح. والكلوريد (Cl-) والصوديوم (Na+) هما الملحان السائدان، حيث يمثلان 86% من إجمالي الأملاح. وجزء كبير مما تبقى من الأملاح عبارة عن كبريت () ومغنيسيوم (Mg2+), وكالسيوم (Ca2+) وبوتاسيوم (K+).
ويستمد البحر أغلب الملح من عملية اسمها التجوية الصخرية الكيميائية (الشكل 2A).
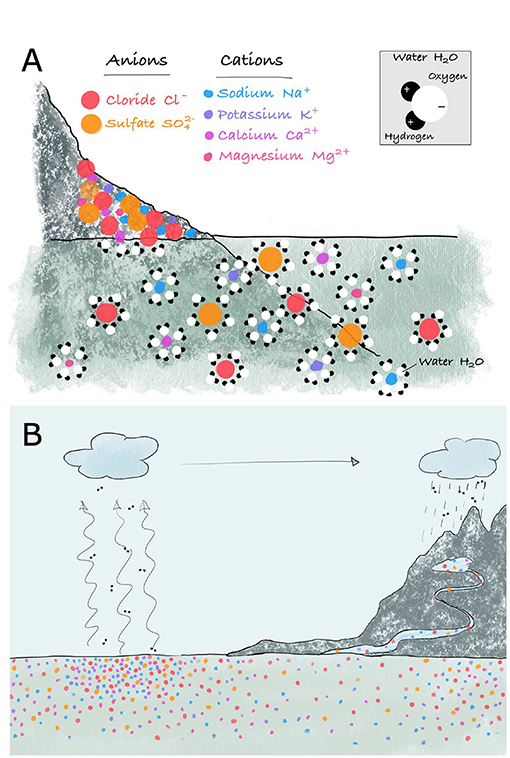
- شكل 2 - (A) تتكوّن الصخور من خليط من الأنيونات والكاتيونات.
- تتكوّن جزيئات الماء من شحنة موجبة ضعيفة على جانب وأخرى سالبة ضعيفة على الجانب الآخر. يمكن أن تحيط جزيئات الماء بأيونات الصخرة، فتنجذب الشحنات المختلفة لبعضها وتنعزل الأيونات عن بعضها. وهذا يذيب الصخرة في عملية اسمها التجوية الصخرية الكيميائية. (B) تنتقل الأملاح في نهاية جريانها إلى البحر. تكون الملوحة في أعلى مستوى في منطقة البحر المفتوح حيث تتبخر المياه تاركة خلفها الأملاح المذابة. تحتوي الأنهار على مستويات ملوحة منخفضة، أما مياه السواحل فهي متوسطة الملوحة.
يتفاعل مزيج ماء المطر والأكسجين (O2) وثاني أكسيد الكربون (CO2) في الهواء مع المعادن داخل الصخور ويذيبها. يمكنك ملاحظة هذه العملية في الأماكن التي أدت فيها مياه الأمطار إلى تمليس أسطح الصخور أو على نقوش المباني الحجرية أو التماثيل التي فقدت أشكالها الأصلية.
تتكوّن جزيئات الماء من ذرات الهيدروجين والأكسجين. وشحنة الهيدروجين في جزيء الماء موجبة قليلاً، في حين أن شحنة الأكسجين سالبة قليلاً. وهذا يجعل الماء مذيبًا ممتازًا، ما يعني أنه مادة يمكنها إذابة الأيونات. تحتوي الصخور والمعادن على خليط من الأيونات، ويمكن تقسيمها إلى أيونات ذات شحنة سالبة (أنيونات) وأيونات ذات شحن موجبة (كاتيونات). ونظرًا لأن الشحنات المختلفة تتجاذب، تحيط جزيئات المياه بالأيونات وتعزلها عن بعضها (الشكل 2A). لهذا السبب، على الرغم من أن مياه النهر ليست ذات مذاق مالح، فهي تحتوي على الملح في الواقع، ولكن تركيزه منخفض للغاية.
لماذا مياه البحر مالحة؟
تتدفق الأنهار إلى البحر في نهاية جريانها، وتحمل معها الأملاح المذابة نتيجة التجوية الصخرية (الشكل 2B). وعندما تتبخر مياه البحر في الهواء، تترك خلفها الأملاح.
تهبط المياه المتبخرة في النهاية في شكل أمطار (أو جليد) فوق الأرض. وتتكرر هذه العملية وتمدّ البحر بالمزيد من الملح.
ولكن هذا مجرد جزء من القصة، وإلا لزادت درجة ملوحة البحار تدريجيًّا، لتصبح في النهاية فائقة الملوحة لدرجة تعجز معها عن إذابة أي أملاح أخرى. صحيح أن مياه البحر مالحة، ولكنها ليست فائقة الملوحة. جرّب ذلك بنفسك، حاوِل معرفة مقدار ملح المائدة الذي يمكن أن يذوب في لتر واحد من الماء. سيكون أكثر بكثير مما يحدث في البحر، وهو حوالي 35 جم في اللتر الواحد تقريبًا. لذلك، لا بد من وجود عمليات أخرى تزيل الملح ببطء من البحر. يُطلق علماء البحار على هذه العمليات اسم "حوض" الملح، تمامًا كما يزيل حوض مطبخك المياه المتدفقة من الصنبور.
يُزال الملح ببطء من البحر عن طريق عدة عمليات. عندما تتبخّر المياه في البحيرات الساحلية الضحلة، يمكن أن يتسبب ذلك في زيادة تركيزات الملح كثيرًا لدرجة أنه يترسّب ويتجمّع على قاع البحر. وهذه هي الطريقة المستخدمة لجمع الملح البحري لاستخدامه في أطعمتنا. يمكن أيضًا أن ينقل رذاذ البحر الملح ببطء من البحر إلى البرّ. ثم يتبخر الماء في الرذاذ ويتبقى الملح على البرّ. يُزال الملح أيضًا ببطء من البحر عبر المياه التي تتسرّب من الشقوق في قاع البحر بالقرب من التلال البركانية تحت الماء.
ولكن بشكل عام، تبقى أيونات الملح في البحر لمدة أطول بآلاف المرات (عدة ملايين السنين) من المدة التي تظل فيها جزيئات الماء (آلاف السنين)، ما يجعل مياه البحر أكثر ملوحة من مياه النهر.
قياس درجة الملوحة
في كل أنحاء العالم، يتم قياس درجة ملوحة البحار ملايين المرات يوميًّا. لنطّلع الآن على سبب أهمية هذه العمليات وكيفية القيام بها. تتأثر كثافة مياه البحر بملوحتها ودرجة حرارتها. وكلما زاد الملح المُذاب في المياه، زادت كثافتها: ففي حين يكون وزن لتر واحد من المياه العذبة عند 10 درجات مئوية 1,000 جم، فإن لترًا واحدًا من مياه البحر عند درجة الحرارة نفسها يكون وزنه 1,026 جم. وتؤثر الاختلافات في درجة حرارة البحر وملوحته بين الأعماق والمواقع على تيارات البحر (لمعرفة المزيد حول هذا، اقرأ مقالة Frontiers for Young Minds هذه). وإذا أردنا فهم أثر البحار على الطقس المحلي والمناخ العالمي وتوزيع الموارد مثل الثروة السمكية، فعلينا فهم دوران البحر، ولذلك تلعب الملوحة دورًا مهمًا.
ولكن قياس درجة الملوحة ليست مهمة سهلة. فالملح، كما ذكرنا سابقًا، ليس مادة واحدة بل مزيجًا. في بداية استكشاف البحار، كانت تتبخر كميات محددة من مياه البحر، وكان يتم وزن الأملاح المتبقية. في القرن التاسع عشر، أحرز الجيولوجي الدانمركي فورشهامر بعض التقدم وحدّد تركيزات الأملاح الفردية [1]، وهي عملية تستغرق وقتًا طويلاً جدًا، حتى لعينة مائية واحدة. وبعد قيامه بقياس العينات المرسلة من المستكشفين من العالم أجمع، اكتشف أن الكميات النسبية للأملاح المختلفة في مياه البحر كانت شبه متماثلة دائمًا، وقد باتت الأمور أسهل بفضل هذا الاكتشاف؛ إذ دلّ ذلك على قدرة العلماء على قياس ملح واحد فقط، مثل أيون الكلوريد (Cl-)، الموجود بتركيزات عالية والذي يسهل قياسه. يمكن بعد ذلك حساب درجة الملوحة من خلال الضرب في الثابت الذي اشتقه فورشهامر: 1.812. يقترب هذا الرقم كثيرًا من التقديرات الحديثة (1.815) [2]، وهذا أمر رائع بالنظر إلى المعدات البسيطة التي استخدمها فورشهامر، إذ لم تتوفّر له حتى الإضاءة الكهربائية.
في الستينيات من القرن العشرين، تم تطوير معدات إلكترونية لتقييم درجة الملوحة بقياس مدى قدرة عينة مياه البحر على توصيل الكهرباء. وهذا هو أساس الأجهزة المعاصرة لقياس درجة الملوحة، والتي يمكن تركيبها على طائرات درون اسمها عوامات Argo تُطلق في البحر لإرسال البيانات عبر الأقمار الصناعية (لقراءة المزيد حول ذلك، اقرأ مقالة Frontiers for Young Minds هذه). وطائرات الدرون هذه الموجودة تحت البحر تشتمل على مجموعة من المستشعرات التي يمكنها قياس الضغط (لتحديد العمق)، ودرجة الحرارة، والتوصيل الكهربائي (لمعرفة درجة الملوحة). وتتحرك هذه الطائرات مع تيارات البحر ويمكنها التحكم تلقائيًّا في مدى طفوها. وعندما تغرق وترتفع، تجمع قياسات حول خصائص مياه البحر لتمكين العلماء من إنشاء خرائط لملوحة البحار (الشكل 3).
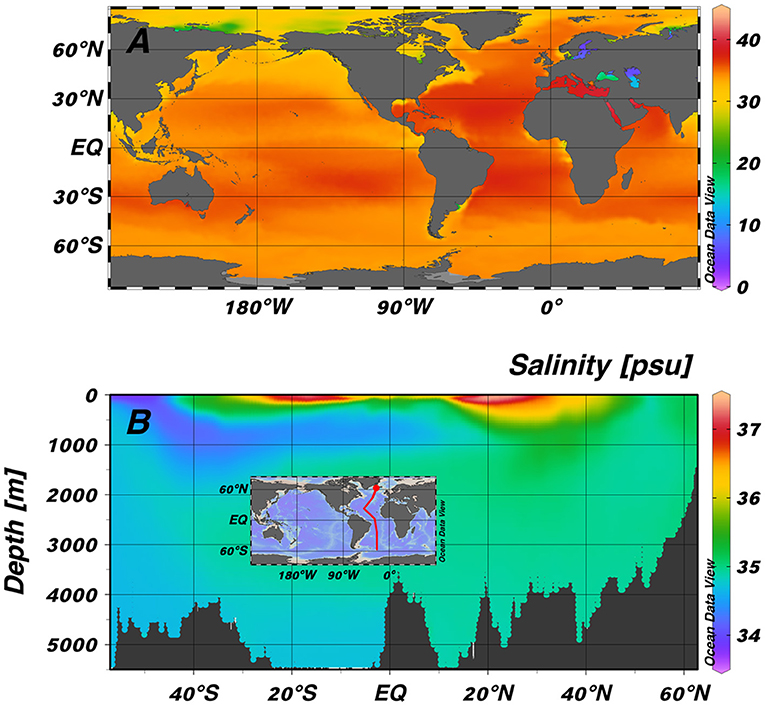
- شكل 3 - (A) درجة حرارة سطح البحار حول العالم: تشير الألوان الحمراء الداكنة إلى أعلى درجات الملوحة، وتوجد غالبًا في المناطق الاستوائية حيث يؤدي الطقس الحار إلى زيادة التبخّر.
- (B) جزء في المحيط الأطلسي (الخط الأحمر على الخريطة)، يوضح مدى تغيّر درجة الملوحة باختلاف العمق. توجد أعلى درجات الملوحة في المياه السطحية في المناطق الاستوائية (على جانبي خط الاستواء). في المياه العميقة (أقل من 500 متر)، تكون درجة الملوحة أقل قليلاً منها عند السطح (تم الحصول على البيانات من "أطلس محيطات العالم"، إصدار 2018).
للقصة بقية
بعد ما قرأت كل هذه التطورات العلمية، قد تظنّ أننا حللنا لغز ملوحة البحار، ولكن هذا ليس صحيحًا. على الرغم من الفائدة الكبيرة لفكرة فورشهامر حول التركيب الثابت لمياه البحر، فهناك اختلافات صغيرة ولكنها قابلة للقياس في تركيب الملح بين مناطق البحر المختلفة. وعلى الرغم من صغر هذه الاختلافات، فهي مهمة إذا ما أردنا وصف خصائص مياه البحر بدقة. ولذلك، يحاول العلماء حاليًا تحديث طرق حساب ملوحة البحر، مع الانتباه إلى أن الأملاح في مياه البحر ليست ثابتة على الإطلاق [3]. وبعد مرور أكثر من 150 عامًا، ما زلنا نكتشف المزيد. فما زالت بجعبة الأملاح أسرار أكثر مما تتخيل. لذا خذ هذا في الاعتبار في المرة القادمة التي تفاجئك فيها موجة وتبتلع بعض المياه المالحة.
شُكر وتقدير
تم نشر هذه المقالة بمنحة من مؤسسة Smed مُقدّمة إلى AWV ومنحة أخرى مُقدّمة إلى CS من صندوق الأبحاث المستقل في الدانمرك (IRFD) ورقمها 9040-00266B. تم تصميم الأشكال وإنشاؤها بمساعدة بيرنيل راسموسن.
مسرد للمصطلحات
الأيون (Ion): ↑ ذرة أو جزيء به شحنة لأنه اكتسب إلكترونات أو فقدها. الأيونات ذات الشحنة الموجبة (Na+) تُسمّى الكاتيونات والأيونات ذات الشحنة السالبة (Cl-) تُسمّى الأنيونات.
الإذابة (Dissolve): ↑ عندما تحاط جزيئات مادة بجزيئات سائل، مثل أيونات الملح في الماء.
المذيب (Solvent): ↑ سائل يمكنه إذابة مادة صلبة أو غازية، والماء مذيب ممتاز.
التركيز (Concentration): ↑ كمية مادة ما في حجم معين من سائل أو غاز، على سبيل المثال، فإن 34 جم ملح في لتر ماء يحتوي على تركيز ملح يعادل 34 جم/لتر.
التبخر (Evaporation): ↑ عندما ترتفع درجة حرارة جزيئات الماء بدرجة كافية للانفصال عن بعضها، فيتحول السائل إلى غاز.
درجة الملوحة (Salinity): ↑ تركيز الملح كمقياس لمدى ملوحة مياه البحر.
الترسّب (Precipitate): ↑ عندما تعجز جزيئات مادة سائلة (الماء على سبيل المثال) عن إبقاء جزيئات مادة أخرى منفصلة عن بعضها، فتتحوّل إلى الحالة الصلبة (مثل بلورات الملح).
الكثافة (Density): ↑ كتلة حجم معين لمادة غازية أو سائلة أو صلبة، وتتأثر كثافة ماء البحر بالمياه ودرجة حرارتها وتركيز المواد المذابة فيها.
إقرار تضارب المصالح
يعلن المؤلفون أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
إفصاح أدوات الذكاء الاصطناعي
تم إنشاء النص البديل (alt text) المرفق بالأشكال في هذه المقالة بواسطة "فرونتيرز" (Frontiers) وبدعم من الذكاء الاصطناعي، مع بذل جهود معقولة لضمان دقته، بما يشمل مراجعته من قبل المؤلفين حيثما كان ذلك ممكناً. في حال تحديدكم لأي خطأ، نرجو منكم التواصل معنا.
المراجع
[1] ↑ Forchammer G. 1865. On the composition of sea-water in the different parts of the ocean. Philos. Transact. R. Soc. London 155:203–62. doi: 10.1098/rstl.1865.0004
[2] ↑ Millero F. J. 2010. History of the equation of state of seawater. Oceanography 23:18–33.
[3] ↑ McDougall, T. J., Jackett, D. R., Millero, F. J., Pawlowicz, R., and Barker, P. M. 2012. A global algorithm for estimating absolute salinity. Ocean Sci. 8:1123–34. doi: 10.5194/os-8-1123-2012
