ملخص
تحتاج السحب إلى جسيمات صغيرة كي تتكون في السماء؛ ويمكن أن تأتي تلك الجسيمات من الأرض مباشرًة، (على سبيل المثال، من البراكين أو التلوث الناتج عن المخلفات الصناعية) أو يمكنها أن تتكون في السماء عندما تجتمع الجزيئات اللزجة معًا. ومن شأن زيادة عدد الجسيمات في السماء أن تجعل السحب أكثر بياضًا، وتعكس السحب الأكثر بياضًا قدرًا أكبر من أشعة الشمس؛ مما يؤدي إلى تبريد مناخ الأرض. إذن الجسيمات الموجودة في السماء تؤثر على السحب، مما يؤثر بدوره على الاحتباس الحراري؛ وبالتالي، من المهم أن نفهم كيف تتكون تلك الجسيمات. ولدراسة ذلك، قمنا بقياس سرعة تكون الجسيمات عندما أضفنا كميات من غازات لزجة يمكن التحكم بها في خزان بأحد مختبرات سيرن للأبحاث، حيث استخدمنا نتائج عمليات المحاكاة الحاسوبية لاكتشاف أي الغازات أهم لتكوين الجسيمات في أماكن مختلفة من الغلاف الجوي، وسيساعد هذا البحث العلماء في فهم كيفية تأثير الجسيمات في مناخ الأرض.
الجسيمات المُعلّقة في الهواء
يتكون الهواء من أصغر الجسيمات التي نعرفها وتكون مستقرة بمفردها: مثل الذرات والجزيئات؛ وبالرغم من ذلك، يحمل الهواء حولنا أيضًا العديد من الجسيمات الدقيقة: كتل من الأشياء صغيرة للغاية بحيث لا يمكن رؤيتها. وعلى غرار المواد الصلبة والسائلة الأخرى، تتكون الجسيمات الدقيقة في الهواء من العديد من الجزيئات المرتبطة معًا عن طريق الجذب الكهربائي.
والجسيمات خفيفة للغاية لدرجة أنها تتحرك مع الهواء، بل إنها تسقط على الأرض ببطء بسبب الجاذبية، لكن الهواء المتحرك يحركها أكثر وأقوى من الجاذبية التي تجذبها للأسفل. هذا وتدور الجسيمات وتتحرك بفعل الرياح، ويمكنها أن تنتقل لمسافات بعيدة، حتى يمكن أن تكون عابرة للقارات، قبل السقوط على الأرض؛ فعندما يكون هناك الكثير من الجسيمات في الهواء، تجعل السماء تبدو ضبابية، لذا تصعب الرؤية على مسافات بعيدة.
وبالقرب من الأرض، أكبر الجسيمات الموجودة في الهواء تكون عادًة الغبار أو حبوب اللقاح، وأصغرها عبارة عن عناقيد مكونة من بضعة جزيئات أصغر عدة مرات من الغبار أو حبوب اللقاح. يتكون الدخان أيضًا من الجسيمات، وجسيمات الدخان أكبر من عناقيد الجزيئات لكنها أصغر من الغبار؛ وعندما تنتج الجسيمات عن نشاط بشري، نسميها تلوثًا، وعلى الرغم من ذلك، فإن تلوث الهواء يمكن أن يتكون أيضًا من جزيئات منفردة من غازات سامة.
الجسيمات في السماء مهمة للغاية لسببين أساسيين؛ أولًا، إن تنفس الكثير منها خطير للغاية، فأبخرة عوادم السيارات، على سبيل المثال، يمكنها أن تسبب السرطان شأنها شأن التدخين، والسبب الثاني لأهمية الجسيمات هو أنها ضرورية لتكوين السحب.
تكوين السحب
جميع السحب بينها أشياء مشتركة، سواء كانت طبقات رمادية كبيرة، أو كتلًا بيضاء هشة، أو خطوطًا في السماء بسبب الطائرات؛ والأهم من ذلك، أنها تتكون من قطيرات صغيرة من الماء تُسمى "قطيرات السحب"، تتكون هذه القطيرات عندما يتصاعد الهواء الساخن من سطح الأرض ثم يبرد ببطء. وعلى غرار الجسيمات، تتسم قطيرات الماء بصغرها المتناهي، لدرجة أنها لا تسقط على الأرض (إلا عندما تُمطر السحب)، حيث يدفعها الهواء المتصاعد المحيط بها إلى الأعلى، وتجذبها الجاذبية إلى الأسفل، وينتهي بها الأمر طافية في أنحاء السماء.
وفي السماء، إذا لم تجد قطيرات الماء سطحًا تلتصق به، وإذا لم تكن باردة للغاية (-38 درجة مئوية)، فستتحول إلى غاز. أما في حالة وجود أحد الأسطح، فيمكن أن يسيل الماء (يصبح سائلًا) أو يتجمد على السطح، كما هو الحال على الأرض، مع ذلك لا توجد أسطح كبيرة وواضحة في السماء، وبالتالي، من أجل تكوين قطرة سحاب، نحتاج إلى جسيم صغير له سطح صغير يمكن للماء أن يلتصق به، حيث يعمل الجسيم بمثابة ركيزة للقطيرة، ولكي ينجح تكوين القطيرة، يجب أن يكون طول الجسيم حوالي 50 نانومترًا: أي حوالي واحد على ألف من سُمك الشعرة. يوضح الشكل 1 من أين تأتي تلك الجسيمات الموجودة في الغلاف الجوي.
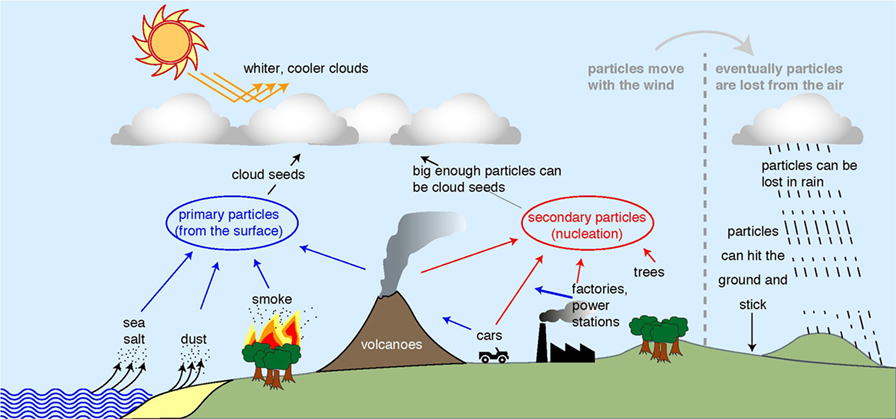
- شكل 1 - من أين تأتي الجسيمات الموجودة في الغلاف الجوي (الجزء الأيسر ومنتصف الشكل) وكيف يتم التخلص منها (أقصى اليمين).
- تأتي جسيمات الغبار، ورذاذ البحر، والدخان مباشرًة من الأرض (الأسهم الزرقاء)، بينما يمكن لجزيئات الغاز أيضًا أن تلتصق ببعضها البعض لتكوين الجسيمات (الأسهم الحمراء). إذا كانت هناك جسيمات أكثر في السماء، فستصبح السحب أكثر بياضًا، لذا تعكس أشعة شمس أكثر إلى الفضاء. مُقتبس من المخطط الأصلي لـ Jasper Kirkby.
إذا كانت الجسيمات الموجودة في السماء أقل، فستكون القطيرات أقل في كل سحابة مما يجعل السحب داكنة أكثر، وترتفع درجة حرارة الأشياء الداكنة بسهولة أكبر من الأشياء الساطعة: على سبيل المثال، حاول لمس سيارة سوداء (بحرص) عندما يكون الطقس مشمسًا، ثم حاول لمس سيارة بيضاء.
إذا كانت السحب داكنة، فسترتفع درجة حرارة الأرض لأن السحب الداكنة يمكن أن ترتفع درجة حرارتها بسهولة، ويمكن أن يؤثر ذلك على درجة حرارة الأرض تأثيرًا كبيرًا، لأن السحب تغطي في المتوسط أكثر من نصف سطح الكرة الأرضية.
عندما نلوث الغلاف الجوي بالدخان على سبيل المثال، نغير عدد الجسيمات في السماء، وهذا يغير من سطوع السحب: أي تُصبح أكثر بياضًا، وتعكس قدرًا أكبر من أشعة الشمس، وترتفع درجة حرارتها بشكل أقل، وقد ساهم ذلك في تقليل الاحتباس الحراري الذي شهدناه خلال المئة عام الماضية الناتج عن الغازات الدفيئة مثل ثاني أكسيد الكربون ربما بمقدار النصف، وربما بمقدار الربع؛ والتأثيرات التي قد تطرأ على درجة حرارة الأرض بسبب الجسيمات غير مؤكدة، حيث نحتاج إلى فهم تلك الجسيمات بشكل أفضل لكي نفهم أي نوع من الاحتباس (أو التبريد) ستسببه [1].
تكوين الجسيمات
يتكون الهواء في الغالب من جزيئات النيتروجين والأكسجين، لكن ثمة العديد من الجزيئات الأخرى التي تطفو في الهواء، فبعض الجزيئات التي يتكون منها الهواء أكثر لزوجة من غيرها. (للشرح المفصل، انظر المربع 1). الماء لزج بعض الشيء، لكن بعض الجزيئات لزجة للغاية لدرجة أنه يمكنها تكوين جسيمات من خلال الالتصاق ببعضها البعض، بدون السطح الذي يحتاجه الماء، ونُسمي عملية الالتصاق معًا التنوي.
المربع 1. لماذا تكون بعض الجزيئات أكثر قدرة على الالتصاق من غيرها.
لماذا تلتصق بعض الجزيئات ببعضها؟
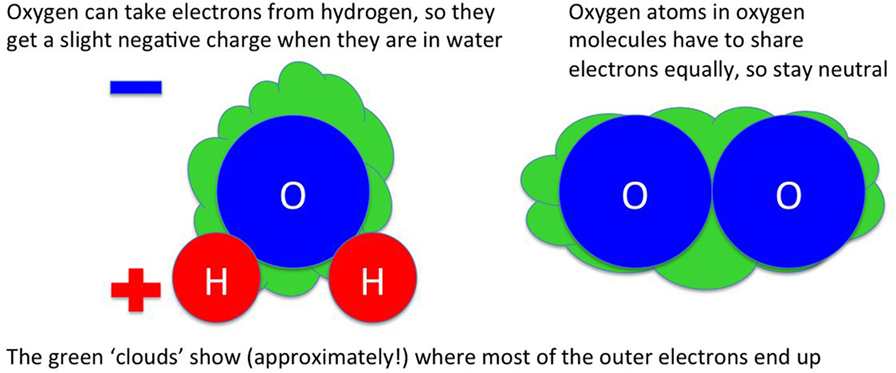
لقد وصفت بعض الجزيئات في هذا المقال بأنها "أكثر لزوجة" من غيرها مما يعني في الواقع أن بعض الجزيئات تنجذب بقوة أكبر إلى جزيئات أخرى بفعل قوى كهربية؛ وتتكون جميع الذرات من نواة صغيرة للغاية وبعض الإلكترونات الموجودة خارج النواة، تعتمد طريقة تموضع الإلكترونات وترتيبها حول الذرة على نوع الذرة [ففي الماء (H2O)، على سبيل المثال، يعتمد الأمر على ما إذا كانت ذرة هيدروجين أم ذرة أكسجين]. في جزيء مثل الماء، تتشارك الذرات في الإلكترونات؛ فإذا كانت الذرات في الجزيء من النوع نفسه [مثل جزيء الأكسجين (O2)، فستتشارك الذرات الإلكترونات بالتساوي]. أما إذا كانت الذرات مختلفة، فتكون عادًة بعض أنواع الذرات أفضل من غيرها في اجتذاب الإلكترونات نحوها، ففي الماء، يجذب الأكسجين الإلكترونات نحوه أفضل من الهيدروجين، لذا تنتظم الإلكترونات غالبًا حول ذرة الأكسجين: أي أن مشاركة الإلكترونات ليست متساوية.
الشحنة الكهربية للإلكترونات سالبة؛ ولأن معظم الإلكترونات في الماء تنتظم حول ذرة الأكسجين، وليس ذرتي الهيدروجين، تنتقل الشحنة السالبة إلى ذرة الأكسجين، بينما تكون شحنة ذرتي الهيدروجين موجبة، ويمكن لذرة الأكسجين في جزيء ماء واحد أن تجذب ذرتي الهيدروجين من جزيء آخر، لأن الشحنات المتنافرة تنجذب إلى بعضها، مما يجعل الماء أكثر لزوجة من الجزيئات المتماثلة مثل الهيدروجين (H2) أو الأكسجين (O2)، حيث تتم مشاركة الإلكترونات بالتساوي.
كلما كان الجزيء أكثر لزوجة، زادت احتمالية تحوله إلى الحالة السائلة أو الصلبة بدلًا من الحالة الغازية، مما يفسر لماذا يكون الماء في الحالة السائلة في درجة حرارة الغرفة، بينما الأكسجين والهيدروجين غازات. ويتميز حمض الكبريتيك والجزيئات التي تتكون من تيربينات (كما سنعرف لاحقًا) بأنهما أكثر قدرة على الالتصاق ببعضهما البعض. ففي الغلاف الجوي، يلتصقان معًا في بادئ الأمر، ثم تلتصق بهما الماء لاحقًا لتكوين قطيرات السحاب.
كما رأينا في الشكل 1، تأتي حوالي نصف الجسيمات التي تعمل بمثابة ركائز سحب في السماء من الأرض، مثل السخام، أو الغبار، أو حبوب اللقاح، وهي ما نسميها جسيمات أساسية. يتكون النصف الأخر من الجسيمات عن طريق عملية التنوي، عندما تتكتل الغازات الأكثر لزوجة في السماء معًا [2]. هذا وتتمحور الدراسة التي نشرناها مؤخرًا حول الغازات الموجودة في السماء وتلتصق ببعضها لتكوين الجسيمات التي تعمل بمثابة ركائز للسحب.
ما كنا نعرفه بالفعل حول تكوين الجسيمات
ربما يكون أفضل جزيء لتكوين الجسيمات في السماء هو حمض الكبريتيك، ويُستخرج حمض الكبريتيك من البراكين، أو العوالق البحرية، أو احتراق الوقود الحفري، وجزيئات حمض الكبريتيك جيدة للغاية في الالتصاق بالماء كما أنها أيضا جيدة في الالتصاق ببعضها البعض، مما يعني أنه يمكنها أن تصنع جسيمات في السماء وتلتصق بالماء، من أجل تكوين ركائز لقطيرات السحاب.
على الرغم من ذلك، لا تُوجد في الغالب كمية كافية من حمض الكبريتيك لتكوين جسيمات كبيرة بما يكفي للعمل بمثابة ركائز لقطيرات السحب، إذ يبلغ قطر جزيء حمض الكبريتيك حوالي نصف نانومتر فقط، لذا فأنت تحتاج إلى الكثير من الجزيئات لإنتاج جسيم يبلغ قطره 50 نانومترًا (كبير بما يكفي لتكون ركيزة)، وعندما يلتصق جزيئين من حمض الكبريتيك معًا، يمكنهما الانفصال مرة أخرى، ومن غير المحتمل تمامًا أن يزداد حجم عنقود مكون من جزيئين إلى حجم ركيزة سحب.
يمكن لبعض الجزيئات الأخرى إيقاف جزيئات حمض الكبريتيك من التفكك عن طريق ربط كتلة حمض الكبريتيك الصغيرة ببعضها، ويمكن أن تلتصق جزيئات حمض الكبريتيك ببعضها، لكن ثمة جزيئات أخرى تلتصق بها أفضل، كما يمكن أن تمنع تلك الجزيئات العنقود من التفكك لمدة طويلة بما يكفي لكي تصطدم به جزيئات حمض كبريتيك أكثر، وتلتصق به وتجعله أكبر، حيث إنه يقل احتمال تفكك الجسيمات الأكبر، لأن الكثير من الجزيئات تكون محاصرة داخل الجسيم، لذا لا يتسنى لها الهرب. يوضح الشكل 2 هذه الآلية.
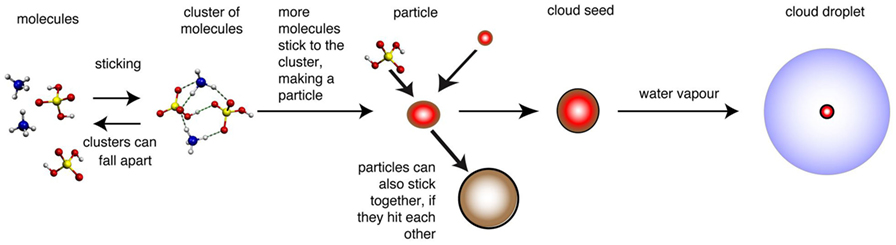
- شكل 2 - كيف يمكن للجزيئات أن تلتصق معًا لكي تصبح ركائز سحب.
- عندما تجتمع بعض الجزيئات القليلة الأولى (الأعواد والكرات على يسار الرسم)، تكون النتيجة عنقود من الجزيئات، تُظهر الخطوط المتقطعة في العنقود القوى التي تجذب الجزيئات وتسحبها معًا وهذا العنقود غير مستقر تمامًا ويمكن أن يتفكك مرة أخرى، وإذا اصطدمت جزيئات أخرى بالعنقود، فيمكن أن تلتصق به، وإذا ازداد حجم العنقود ليصبح أكبر من أن يتفكك، نسميه جسيمًا (الكرة الحمراء)، ثم يمكن للجسيمات الأكبر أن تعمل بمثابة ركائز لقطيرات السحب، ويمكن تقليل عدد الركائز إذا التصقت الجسيمات الصغيرة بالجسيمات الأكبر (الكرة البنية). مُقتبس من المخطط الأصلي لـ Jasper Kirkby.
دراستنا: ماذا يجعل جزيئات حمض الكبريتيك تلتصق ببعضها؟
الأمونيا مادة لاصقة جيدة لجزئيات حمض الكبريتيك [3]، وهي سامة مثل حمض الكبريتيك، لكن لديك القليل منها داخل جسمك. وهي المسؤولة عن رائحة البول. ومن خلال البيانات التي جمعناها في دراستنا، تشير تقديراتنا إلى أن ثلثي الجسيمات الموجودة في الغلاف الجوي والمكونة من حمض الكبريتيك تطلبت أيضًا وجود الأمونيا لربط جزيئات الحمض معًا.
تأتي المواد اللاصقة الأخرى لجزئيات حمض الكبريتيك من الأشجار [4]، حيث تبعث الأشجار، وخاصة أشجار الصنوبر، جزئيات نطلق عليها التيربينات، الموجودة في مزيل الطلاء (التربنتين)، وتُكسب التيربينات غابات الصنوبر رائحة منعشة - أفضل من رائحة البول! وبعد بعض التفاعلات الكيميائية مع الأشياء الأخرى الموجودة في الهواء، تكون هذه الجزيئات أيضًا مادة لاصقة جيدة. ومن خلال دراستنا، تشير التقديرات إلى أن حوالي واحد من كل خمسة جسيمات في الغلاف الجوي يتشكل بوجود تيربينات مثل الصمغ؛ وفي بعض الحالات، لا تُعد الجزيئات ذات الصلة بالتيربينات مادة لاصقة جيدة فحسب، بل يمكنها تكوين جسيمات دون الحاجة إلى حمض الكبريتيك نهائيًا [5].
يوجد أمر أخير قمنا بدراسته، ضروري لتشكل الجسيمات في الجو: "الأشعة الكونية." وهي جسيمات دون ذرية (متناهية الصغر في الحقيقة) تأتي من الفضاء الخارجي وترتطم بكوكب الأرض طوال الوقت، ويمكن أن تتصادم الأشعة الكونية مع حمض الكبريتيك أو الجزيئات الأخرى الموجودة في الغلاف الجوي وتجعلها أكثر قدرة على الالتصاق ببعضها البعض، حيث يحدث ذلك من خلال طرد الإلكترونات خارج الجزيئات التي تتصادم معها. وتتركها موجبة الشحنة. ويمكن أن ترتبط الإلكترونات بعد ذلك بجزيئات أخرى، وتجعلها سالبة الشحنة؛ وتمامًا مثل انجذاب الشحنات، يمكن أن تنجذب أيضًا الجزيئات المشحونة كهربيًا إلى بعضها البعض داخل الجسيم، حيث يساعد ذلك على إبقاء الجسيمات معًا دون تفككها [6]، وقد سمحت لنا دراستنا، بتقدير مدى أهمية الأشعة الكونية في تشكيل الجسيمات داخل الهواء الجوي، بشكل أفضل من أي وقت مضى.
كيف توصلنا إلى هذا كله؟
عادة ما يختبر العلماء أفكارهم من خلال إجراء التجارب؛ لدينا مختبر خاص في سويسرا، يمكننا فيه إجراء تجارب لتشكيل جسيمات، حيث تُجرى هذه التجارب في مركز كبير للأبحاث يُسمى "مختبر سيرن"، وفي المكان نفسه يوجد مصادم الهدرونات الكبير (LHC)، الذي يمثل تجربة أكبر حيث يُفكك "الجسيمات دون الذرية" المرتبطة معًا (المماثلة تمامًا للأشعة الكونية)؛ يقوم العلماء بإجراء تجربة مصادم الهدرونات الكبير في محاولة لمعرفة كيف بدأ الكون وماذا يوجد داخل الذرات التي نتكون منها، وتُسمى تجربتنا المصغرة CLOUD، اختصارًا لعبارة الأشعة الكونية الباعثة للقطرات الموجودة في الهواء.
حيث تُجرى تجربة CLOUD [1] (http://cloud.web.cern.ch/) داخل خزان معدني كبير، يبلغ طوله وعرضه حوالي ٣ أمتار، مملوء بالهواء، وفي الخزان (الموضح بالشكل 3)، نخلط غازات نعتقد بأنها ستشكل الجسيمات، ونقيس مدى سرعة تشكل الجسيمات التي تظهر لنا. هذا ويوجد في الغلاف الجوي جميع أنواع الغازات، ومن الصعب معرفة أي من هذه الغازات يُشكل الجسيمات وأي منها لا يُشكلها.

- شكل 3 - يوضح تجربة كلاود (CLOUD) التي تُجرى في مختبر سيرن.
- يُغطى الخزان (الموجود في منتصف الصورة) بمواد عازلة لمنع تغير درجة الحرارة، وتحافظ القوالب الخرسانية (الموجودة في خلفية الصورة) على إبقاء الجسيمات دون الذرية بالداخل، بعيدًا عن العلماء الذين يعملون في المبنى. التقط الصورة Antti Onnela.
يُعد الخزان الخاص بنا خزانًا مميزًا؛ نظرًا لأنه نظيف للغاية: إذ يتكون الهواء فيه صناعيًا من خلال خلط النيتروجين والأكسجين السائلين، ويتم غلق الخزان بإحكام لمنع التلوث الخارجي من الدخول، ونضع عددًا قليلًا من الغازات فحسب، ونعرف بالضبط مقدار كل غاز وضعناه، فيمكننا ذلك من قياس مدى تفاعل كل غاز.
باستخدام تجربة CLOUD، يمكننا أيضًا معرفة كيف تساعد الأشعة الكونية في تشكيل جزيئات تلقيح السحب، من خلال نقل المزيد من الجسيمات دون الذرية الصغيرة، المستمدة من التجارب الأخرى التي أجريت في مختبر سيرن، إلى الخزان الخاص بنا، ولهذه العملية تأثير مماثل لنقل الأشعة الكونية إلى الخزان الخاص بنا. فعلى غرار الأشعة الكونية، تجعل الجسيمات دون الذرية الجزيئات أكثر قدرة على الالتصاق، ويمكننا معرفة مقدار الجسيمات المتكونة عند استخدام هذه الأشعة الكونية الصناعية، ويساعدنا ذلك في فهم التغيير الذي تحدثه الأشعة الكونية في تشكيل الجسيمات.
في الغلاف الجوي، يكون عدد جسيمات الأشعة الكونية في الارتفاعات الشاهقة (مثلًا على متن طائرة أو في قمم الجبال) أكثر من تلك الموجودة على مستوى سطح الأرض، نظرًا لأن الهواء يمتصها. لذلك، فمن خلال استخدام جسيمات إضافية مستمدة من التجارب الأخرى التي أجريت في سيرن، يمكننا محاكاة بيئات مرتفعة في الغلاف الجوي، وهذا هو السبب الرئيس وراء ضرورة إجراء تجربة CLOUD في مختبر سيرن، فبمجرد قياس مدى ارتباط الغازات معًا في تجربة CLOUD، سنستخدم النتائج التي توصلنا إليها في محاكاة حاسوبية للجسيمات الموجودة بالغلاف الجوي. هذه مجموعة من الصيغ الرياضية لجميع العمليات الموضحة في الشكل 1، مسجلة في برنامج حاسوبي كبير [7]، حيث يوضح لنا هذا البرنامج (الشكل 4) مقدار الغازات المتفاعلة عند جميع النقاط في الطبقة السفلية من الغلاف الجوي (أي على ارتفاع أقل من حوالي 20 كم). بالاستفادة من هذه البيانات المتعلقة بمقدار الغازات، يمكننا بعد ذلك استخدام النتائج المستمدة من تجارب CLOUD لمعرفة مقدار الجسيمات التي تتشكل في الثانية الواحدة، أو في اليوم؛ وبمجرد الحصول على الجسيمات في المحاكاة الخاصة بنا، نقوم بنمذجة كيفية نموها أو ارتباطها ببعضها البعض لتكوين ركائز السحب، وكيف يتم فقدانها على الأرض. وهذا يوضح لنا مدى أهمية الطرق المختلفة التي يمكن أن تتكون بها الجسيمات عند جميع مستويات الغلاف الجوي.
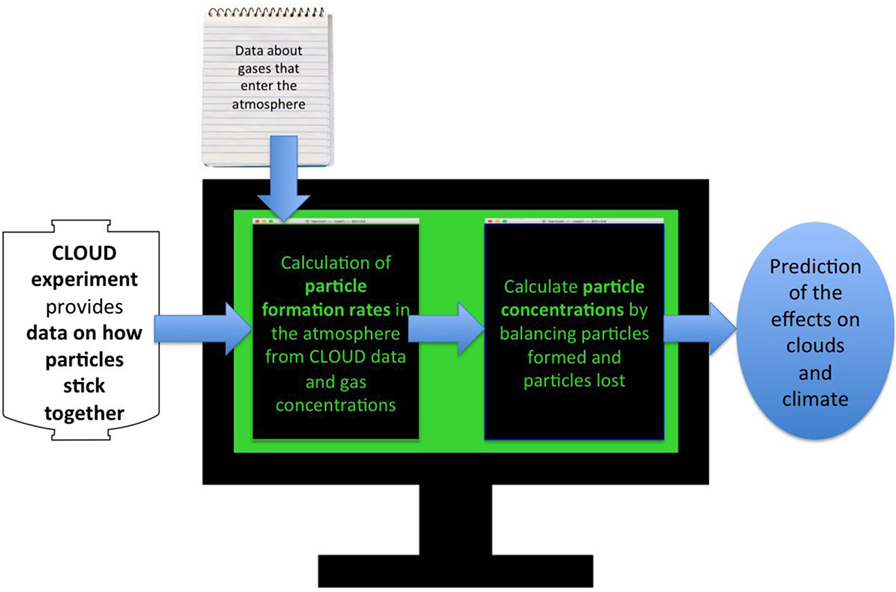
- شكل 4 - يوضح رسمًا بيانيًا يشرح المحاكاة الحاسوبية الضرورية لتحويل التجارب في CLOUD إلى توقعات حول آثار تشكل الجسيمات على مناخ كوكب الأرض.
- يجمع برنامج الحاسوب نتائجنا حول كيفية ارتباط الجزيئات معًا، بتقديم تقديرات عن مقدار الغازات القادرة على الالتصاق الموجود في كل مكان في الغلاف الجوي. دعونا نكتشف مقدار الجسيمات المتكونة في فترة زمنية معينة في كل جزء من الغلاف الجوي، ثم نحسب مقدار الجسيمات المفقودة في ذلك الوقت، حيث إنها إما ترتبط معًا أو تسقط على الأرض، ويتيح لنا تحقيق التوازن بين تشكيل الجسيمات وفقدها حساب مقدار الجسيمات الموجودة في كل جزء من الغلاف الجوي، حيث يمكننا بعد ذلك معرفة كيف يمكن لإضافة الجسيمات أن تؤثر على سطوع السحب في ذلك المكان: يؤدي استخدام العديد من ركائز السحب إلى تكون سحب أكثر سطوعًا؛ وبهذه الطريقة، يمكننا معرفة مقدار الطاقة التي تعكسها الشمس، وما يعنيه كل هذا بالنسبة لمناخ الأرض.
ما معنى ذلك كله؟
قبل مئتي عام، كان هناك حوالي نصف مقدار حمض الكبريتيك الموجود حاليًا في الغلاف الجوي؛ ويرجع هذا غالبًا إلى إحراق كمية كبيرة من الفحم في المائتي عام الماضية، لذلك، يمكن أن يكون السبب المسؤول عن تكوين ركائز السحب الآن مختلفًا قليلًا عما كان في المائتي عام الماضية. فقبل أن نبدأ في حرق المزيد من الفحم، لا بد أن انبعاث التيربينات من الأشجار كان له دور أكثر أهمية في تكوين ركائز السحاب، ولعبت الكبريتات دورًا أقل أهمية [8].
لذلك، في المستقبل، عند التوقف عن حرق الفحم الملوث، سيعود انبعاث التيربينات من الأشجار ليلعب دورًا أكثر أهمية مرة أخرى، وفي بعض الأماكن، سيكون لدينا القليل من الحمض لتكوين ركائز السحب، وسيكون مقدار ركائز السحب أقل بشكل عام. ومن المحتمل أن تحتوي السحب على القدر نفسه من الماء، ولكن بعدد أقل من القطيرات. كما أنه من المحتمل أن تطلق السحب الماء الموجود بها في صورة أمطار، وتجعل السحب أكثر قتامة مما يؤدي بدوره إلى ارتفاع درجة حرارة الكوكب، كما ناقشنا سابقًا [1]. هذا وتقدم دراستنا تقديرًا لمدى أهمية الجزيئات المستمدة من الأشجار، مقارنة بالأمونيا، في تكوين جسيمات ركائز السحب، وستساعد هذه المعلومات العلماء على تقدير حجم التغيير وقيمة الاختلاف الذي سيحدثه تنظيف الهواء في مناخنا.
مسرد للمصطلحات
العنقود (Cluster): ↑ عدد صغير من الجزيئات المرتبطة معًا. يمكن أن تتحول العناقيد إلى جسيمات غلاف جوي إذا اصطدمت بها جزيئات أكثر أو ارتبطت معها.
الغاز الدفيء (Greenhouse gases): ↑ غاز موجود في الغلاف الجوي يمتص الطاقة من الشمس، مثل ثاني أكسيد الكربون، والجزيئات التي تحتوي على أكثر من ذرتين من المرجح أنها غازات دفيئة.
التنوي (Nucleation): ↑ في سياق هذا المقال، التنوي يعني تكوين جسيمات في السماء من خلال جزيئات الغاز التي تلتصق ببعضها، ويُسمى أيضًا ”تكوين الجسيمات الثانوية” أو ”تكوين الجسيمات الجديدة”.
ركائز سحب (Cloud seed): ↑ جسيم موجود في الغلاف الجوي يمكن للماء أن يتكثف حوله لتكوين قطيرة سحاب، وعادًة ما يبلغ قطر ركائز السحب 50 نانومترًا على الأقل.
الجسيم الأساسي (Primary particle): ↑ جزيء في الغلاف الجوي قادم مباشرًة من الأرض، بدلًا من أن يتكون بالتنوي، وغالبًا نرى أمثلة على الجسيمات الأساسية في الغلاف الجوي ومنها الدخان (السخام)، والغبار، وملح البحر.
التيربينات (Terpenes): ↑ جزيئات تنبعث من الأشجار، الصيغية الكيميائية لها هي C10H16، ويُؤدي تفاعل تلك الجزيئات مع الأكسجين إلى إنتاج الجزيئات التي تُكون الجسيمات.
الأشعة الكونية (Cosmic rays): ↑ جسيمات دون الذرية عالية الطاقة تصطدم بالأرض من الفضاء الخارجي.
مختبر سيرن (CERN): ↑ تمثل المنظمة الأوروبية للأبحاث النووية موطنًا لتجربة CLOUD والتجارب العديدة الأخرى التي تتضمن جسيمات دون ذرية، حيث تستخدم أكبر التجارب التي أجريت في مختبر سيرن جسيمات دون ذرية مستمدة من مصادم الهدرونات الكبير (LHC).
الجسيمات دون الذرية (Subatomic particle): ↑ جسيمات أصغر من الذرات؛ من الجسيمات دون الذرية الأكثر شيوعًا: البروتونات، والنيوترونات، والإلكترونات، وتتكون الذرات من هذه الجسيمات دون الذرية، ويمكن أن تحتوي الأشعة الكونية على جسيمات دون ذرية أكثر غرابة، على سبيل المثال البيانات أو الميونات.
الارتفاع (Altitude): ↑ الارتفاع عن مستوى سطح الأرض.
إقرار تضارب المصالح
يعلن المؤلفون أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
مقال المصدر الأصلي
↑ Dunne, E. M., Gordon, H., Kürten, A., Almeida, J., Duplissy, J., Williamson, C., et al. 2016. Global atmospheric particle formation from CERN CLOUD measurements. Science 354:1119-24. doi: 10.1126/science.aaf2649
المراجع
[1] ↑ Stocker, T. F., Qin, D., Plattner, G-K., Tignor, M., Allen, S. K., Boschung, J., et al., eds. 2013. Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the IPCC. Cambridge, UK: Cambridge University Press.
[2] ↑ Merikanto, J., Spracklen, D. V., Mann, G. W., Pickering, S. J., and Carslaw, K. S. 2009. Impact of nucleation on global CCN. Atmos. Chem. Phys. 9:8601–16. doi: 10.5194/acp-9-8601-2009
[3] ↑ Kulmala, M., Pirjola, U., and Mäkelä, J. M. 2000. Stable sulphate clusters as a source of new atmospheric particles. Nature. 404:66–9. doi: 10.1038/35003550
[4] ↑ Went, F. W. 1960. Blue hazes in the atmosphere. Nature. 187:641–3. doi: 10.1038/187641a0
[5] ↑ Kirkby, J., Duplissy, J., Sengupta, K., Frege, C., Gordon, H., and Williamson, C., et al. 2016. Ion-induced nucleation of pure biogenic particles. Nature. 533:521–6. doi: 10.1038/nature17953
[6] ↑ Kirkby, J., Curtius, J., Almeida, J., Dunne, E., Duplissy, J., Ehrhart, S., et al. 2011. Role of sulphuric acid, ammonia and galactic cosmic rays in atmospheric aerosol nucleation. Nature. 476:429–33. doi: 10.1038/nature10343
[7] ↑ Spracklen, D. V., Pringle, K. J., Carslaw, K. S., Chipperfield, M. P., Mann, G. W., et al. 2005. A global off-line model of size-resolved aerosol microphysics: I Model development and prediction of aerosol properties. Atmos. Chem. Phys. 5:2227–52. doi: 10.5194/acp-5-2227-2005
[8] ↑ Gordon, H., Sengupta, K., Rap, A., Duplissy, J., Frege, C., and Williamson, C., et al. 2016. Reduced anthropogenic aerosol radiative forcing caused by biogenic new particle formation. Proc. Natl. Acad. Sci. U.S.A. 113:12053–8. doi: 10.1073/pnas.1602360113
