ملخص
قد تكون جروح الجلد مثل الكشط والجروح القطعية مؤلمة إلا إنها سريعًا ما تلتئم بشكل كامل. وتظل أسوأ احتمالية قائمة في أنها قد تترك ندبة في جسدك. وعلى الجانب الآخر، عند إصابة المخ، فعادة ما تخلف هذه الإصابة إعاقات تصاحب المرء بقية حياته. فأين مكمن الاختلاف في المخ، وكيف يمكنه أن يعالج نفسه؟ تواجه خلايا المخ تحديات خاصة حين تصاب بارتجاج أو سكتة دماغية على سبيل المثال. ولكي يستطيع المخ مواجهة هذه التحديات، يتبنى استراتيجية بارعة للتعامل مع الإصابات.
المخ حساس وضعيف للغاية
يشكل المخ والحبل الشوكي سويًا ما نسميه الجهاز العصبي المركزي. هل تساءلت يومًا وأنت تنظر إلى الهيكل العظمي: لم المخ والحبل الشوكي هما العضوان الوحيدان في أجسامنا المغلفان بالعظام؟ صحيح أن الرئتين والقلب أيضًا في مأمن بفضل القفص الصدري. ولكن حينما تنظر إلى الجمجمة، تجد أنها عبارة عن علبة عظمية بها بعض الثقوب التي تسمح للأعصاب بالخروج من المخ. وللجهاز العصبي طبيعة فريدة مقارنة بكثير من الأعضاء الأخرى، إذ إنه لا يتمدد ولا ينقبض مثلما يفعل القلب والرئتان والأمعاء. وطالما أنه ليس كثير الحركة، فمن الطبيعي للجهاز العصبي المركزي أن يكون مغلفًا بالعظام. ولكن، لماذا يتمتع الجهاز العصبي المركزي بهذه الحماية المشددة؟ الإجابة ببساطة هي لأنه في غاية الحساسية والضعف.
برأيك أي من أعضاء جسدك تتعرض للإصابة بشكل أكثر من غيرها؟ على الأرجح، جلدك. حاول أن تتذكر مرة حين وقعت و فُتح جلدك وكان به جرح قطعي لفترة من الزمن. إذا كانت هذه الإصابة قد حدثت من فترة ليست بالقصيرة، فربما لم تعد ترى مكان الجرح على جلدك. أو ربما ترك هذا الجرح ندبة، ولكن في الأساس استطاع جلدك أن يعالج نفسه ويلتئم بشكل أقرب للكمال. ولكن لسوء الحظ يختلف الأمر اختلافًا جذريًا حين نتحدث عن المخ والحبل الشوكي. فإذا أصيب المخ، فقد يرافقك بعض الضرر الناجم عن هذه الإصابة بقية حياتك.
لماذا لا يستطيع المخ أن يعالج نفسه مثلما يفعل الجلد؟
الخلايا العصبية لا تجدد نفسها
تستمر خلايا الجلد في الانقسام، حيث تموت هذه الخلايا وتُولد خلايا جديدة كليًا على مدار الوقت حتى بدون التعرض للإصابة. وبعد الإصابة، يقوم الجلد بتكوين مجموعة من الخلايا الجديدة ويستخدمها في عملية شفاء الجرح. وعلى الجانب الآخر، فإن الخلايا العصبية في المخ، والتي يطلق عليها أيضًا العصبونات، لا تجدد نفسها. فهي لا تنقسم على الإطلاق. وهناك استثناءات نادرة جدًا لهذه القاعدة، حيث يوجد مكانان خاصان فقط في المخ يمكنهما تكوين خلايا عصبية جديدة. إلا أن المخ في أغلب مناطقه لا يستطيع أن يستعيد الخلايا العصبية الميتة. وهذا الأمر على وجه التحديد مثير للقلق لأن الخلايا العصبية خلايا غاية في الحساسية، وتموت تحت جميع الأسباب والظروف. فعندما يرتطم رأسك وتصاب بالارتجاج، تموت الخلايا العصبية. وحين يكون هناك خلل في تدفق الدم إلى المخ والذي يسمى سكتة دماغية، تموت الخلايا العصبية. وتموت الخلايا العصبية أيضًا عندما تواجه تغيرًا في وظائفها، وهو ما يحدث في الأمراض التي يطلق عليها الأمراض العصبية التنكسية؛ مثل مرض باركنسون (الشلل الرعاش) وألزهايمر.
ولكن ها هي الأخبار الجيدة. فلأن فقد الخلايا العصبية عادة ما يكون أمرًا مستديمًا، يعمل العلماء حاليًا على استراتيجيتين من شأنهما مساعدة المخ بعد الإصابات. وإحدى هاتين الطريقتين هي حماية الجهاز العصبي مباشرة بعد حدوث الضرر. قد يكون هذا الضرر سكتة دماغية أو ارتجاجًا خطيرًا أو أي نوع من الإصابات. وعليه، فلو استطعنا بطريقة ما الحد من عدد الخلايا العصبية التي تموت مباشرة بعد الإصابة، فسيمكننا إذن خفض نسبة الضرر إلى الحد الأدنى. وللمساعدة في عملية الشفاء بعد الإصابة ووقوع الضرر، يحاول بعض العلماء استخدام الخلايا الجذعية كعلاج لفقد الخلايا العصبية في المخ1. والخلايا الجذعية هي خلايا أولية غير ناضجة لم تتحول إلى خلايا “متخصصة” بعد. وتتميز هذه الخلايا بقدرتها على التطور وإنتاج خلايا عصبية جديدة إذا قام العلماء بمعالجتها بجزيئات خاصة. ويشبه هذا الأمر طلاب المرحلة الابتدائية الذين لم يصيروا أطباء أو سبّاكين بعد، ولكن لديهم القدرة على امتهان أي مهنة في المستقبل إذا حصلوا على التدريب الصحيح. ويعتبر التحدي الأكبر في عملية استبدال الخلايا العصبية الميتة بالخلايا الجذعية هو أن يندمج هذا الوافد الجديد في شبكات المخ الموجودة أو يتأقلم معها على نحوٍ صحيح. فالخلايا العصبية الجديدة لا يمكنها البقاء هكذا وحدها في المخ، وإنما نحن بحاجة لجعلها قادرة على أن تكوّن روابط مع باقي الخلايا والقيام بالعمل الذي تقوم به جميع الخلايا العصبية؛ ألا وهو معالجة الإشارات.
الخلايا العصبية تواجه صعوبات في إعادة إنماء الأجزاء التالفة
بالنظر إلى تركيبة العصبون (أو الخلية العصبية)، نلاحظ أن به جسم الخلية والعديد من الأذرع التي يستخدمها في التواصل مع باقي الخلايا العصبية (الشكل 1، يسارًا). ويطلق على هذا الذراع الطويل جدًا والذي يرسل الإشارات إلى باقي الخلايا العصبية اسم المحور العصبي، ويمكن أن تكون المحاور العصبية طويلة للغاية. وإذا تضرر المحور العصبي وهو في طريقه إلى خلية أخرى، فسيموت الجزء المتضرر من المحور العصبي (الشكل 1، يمينًا)، بينما يمكن أن تنجو الخلية العصبية نفسها بالجزء المتبقي من الذراع. وتكمن المشكلة في أن الخلايا العصبية في الجهاز العصبي تواجه أوقاتًا عصيبة وهي تسعى لاستعادة نمو المحاور العصبية من الأجزاء المتبقية. ولكن لماذا لا تعاني خلايا الجلد من مثل هذه المشكلة؟ تمتاز خلايا الجلد بتركيبة أكثر بساطة. ولأنها قادرة على تكوين الخلايا الجديدة، فهي لا تواجه هذه المشكلة و ليست مضطرة إلى إصلاح أجزاء من خلاياها.
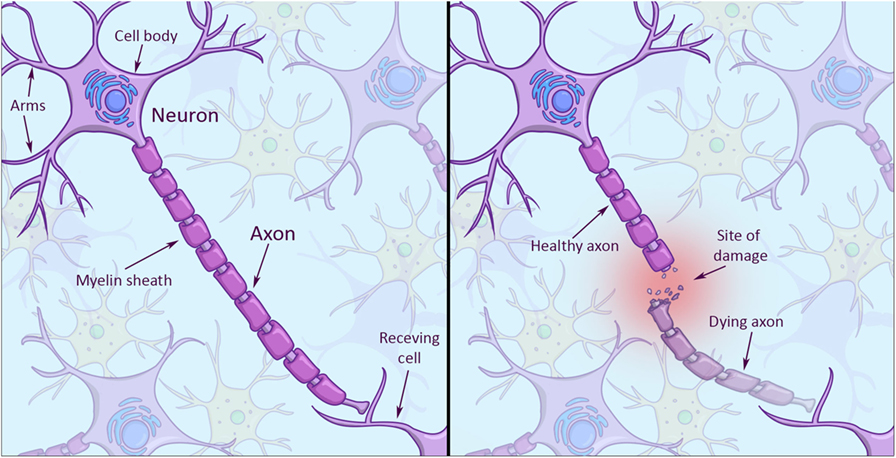
- شكل 1 - اليسار: تركيبة خلية الدماغ.
- لاحظ الأذرع التي تشبه الفروع الممتدة من جسم الخلية (في أعلى الركن الأيسر) تستقبل هذه الأذرع الإشارات الواردة. يعرف هذا الذراع الطويل الذي يمتد حتى أسفل اليسار بالمحور العصبي، وهو الذي يرسل الإشارات إلى الخلية المستقبلة. يغلف هذا المحور العصبي بالغمد المياليني (باللون البنفسجي الداكن)، وهو يساعد على انتقال الإشارات بسرعة عبر المحور العصبي إلى الخلية المستقبلة. اليمين: حين يصاب المحور العصبي، تموت نهاية الطرف وتترك جذع المحور العصبي. تواجه الجذوع صعوبات في رحلة النمو بعد الإصابة.
إذن، لمَ تعاني الخلايا العصبية المتضررة من صعوبة في إعادة إنماء المحاور العصبية؟
أولًا، لأنها بحاجة إلى التحفيز. هناك جزيئات خاصة يمكنها المساعدة في تنشيط النمو في الخلايا العصبية. ويتكون الكثير من هذه الجزيئات المحفزة عندما تكون الخلايا العصبية نشطة. لذلك، إذا أبقيت مخك نشطًا، فمن المرجح أن تنمو الخلايا العصبية. وهذا ينطبق على الحالتين: بعد الإصابة وفي حالة المخ السليم.
ثانيًا، تواجه المحاور العصبية بيئة معادية مليئة بإشارات “إيقاف” جزيئية تمنع “المرور” الى المحاور العصبية. وتمثل بعض إشارات الإيقاف هذه جزءًا من الغمد أو الغلاف الموجود حول المحاور العصبية المجاورة، والتي يطلق عليها الغمد المياليني (الشكل 1، يسارًا). وبعض إشارات الإيقاف هي جزء من ندبة تُبنى كجدار واقٍ حول الإصابة في محاولة للحيلولة دون انتشار الضرر.
هذه الندبات تصنع بواسطة خلايا في المخ تسمى الخلايا النجمية (نسبة إلى شكلها الذي يشبه النجوم). وتسعى الخلايا النجمية التي تقوم بصنع هذه الندبات في حقيقة الأمر للمساعدة، ولكنها تطلق أيضًا موادًا كيميائية داخل بيئتها، وهو ما يتسبب في صعوبة نمو المحاور العصبية (الشكل 2).
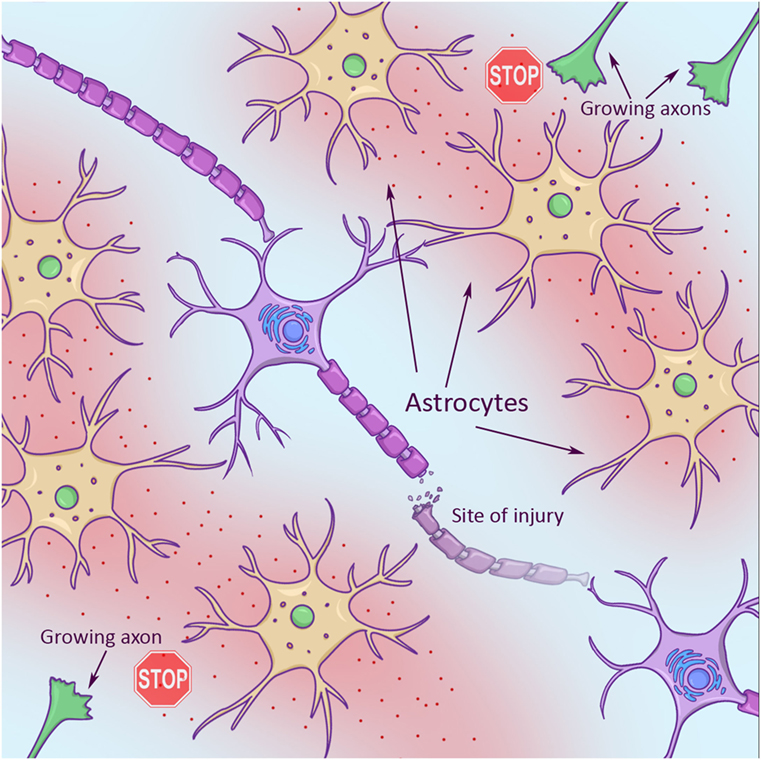
- شكل 2 - المحاور العصبية النامية (باللون الأخضر في الركن أعلى اليمين والركن أسفل اليسار) التي تبحث عن هدف جديد من الخلايا للاتصال بها تواجه أوقات صعبة في بيئة الإصابة. ويرجع هذا جزئيًّا إلى الخلايا الداعمة التي تشبه النجمة (الخلايا النجمية، باللون الأصفر) والتي تطلق موادًا كيمياوية (بالأحمر). وقد تتسبب هذه المواد الكيماوية في إيقاف عملية نمو المحور العصبي.
ولكن توجد أخبار جيدة فيما يتعلق بهذه الجزئية أيضًا. حيث يعمل العلماء على تطوير استراتيجيات لتحفيز الخلايا العصبية المصابة على النمو باستخدام جزيئات نمو خاصة، وللتخلص من إشارات الإيقاف للمحاور العصبية لتصبح بيئة الإصابة أكثر دعمًا لنمو الخلية العصبية [1].
الاستجابة المناعية للمخ تختلف عن الاستجابة المناعية للجلد
تلعب الاستجابة المناعية دورًا حيويًا في أي نوع من أنواع عمليات الشفاء والإصلاح بعد الإصابة. وفي الجلد المصاب، تندفع الخلايا المناعية من الدم نحو موقع الإصابة وتساعد الخلايا المناعية المقيمة في تنظيف بقايا الخلايا الميتة. وبعد الانتهاء من عملية التنظيف، تموت الخلايا المناعية وتتوقف عن المحاربة. ويوجد في المخ خلايا مناعية متخصصة ومقيمة أيضًا، وتصبح نشطة حين تستشعر الخطر أو الضرر. والمشكلة العامة في المخ هي أن الخلايا المناعية النشطة لا تعرف متى تتوقف عن المحاربة. فإذا استمرت في إطلاق المواد الكيميائية السامة لفترات زمنية طويلة، فبإمكانها أن تسبب ضررًا أكبر من الفائدة، حيث تقتل بفعلها هذا الخلايا العصبية السليمة. ولهذا السبب، يحاول العلماء فهم ما يحرك الخلايا المناعية في المخ وما يجعلها تتوقف، كما يحاولون الوصول إلى طريقة تعديل استجابة هذه الخلايا المناعية لتصبح أكثر مساعدة ودعمًا بدلًا من الضرر الذي تسببه [2].
كيف يمكن للمخ أن يعالج نفسه إذن؟
قد تصاب بالإحباط حين تقرأ عن القيود المفروضة على الخلايا العصبية مقارنة بخلايا الجلد، إذ كيف لعضو بأهمية المخ أن يكون غير مستعد للأحداث التي تسبب الضرر؟ الحقيقة أن الجهاز العصبي المركزي يتميز باستراتيجية فائقة لمعالجة نفسه والتي تختلف تمامًا عن الاستراتيجيات التي تتبناها الأعضاء الأخرى في هذا الشأن. صحيح أن المخ لا يمكن أن يعود لسابق عهده قبل الإصابة والضرر، إلا أنه سيحاول دائمًا تعويض الخسائر التي لحقته. فالخلايا العصبية في المخ قادرة على تغيير اتصالاتها ببعضها البعض. وتسمى هذه العملية اللدونة، وهي تساعد المخ على التأقلم مع فقد الخلايا العصبية. لننسى لوهلة الخلايا الميتة، لأن مسؤولية اللدونة تقع بالكامل على عاتق الخلايا النّاجية. ولكن كيف تعمل؟
نظرًا لأن الوظيفة الأساسية للخلايا العصبية هي إرسال الإشارات، تتميز الخلايا العصبية بقدرتها الفائقة على استشعار “الأماكن الحرة” أو الخلايا العصبية الأخرى التي يمكنها الاتصال بها. وبصرف النظر عن نمو أذرع جديدة للاتصال بالخلايا الجديدة، يمكن للخلايا العصبية أن تعدل أيضا من قوة الاتصالات القائمة مع الخلايا العصبية الأخرى (الشكل 3). إذ يمكن للخلايا العصبية إما أن تقوي من تلك الاتصالات أو تضعفها، وينتج عن ذلك شبكة جديدة كلية من الاتصالات داخل المخ.
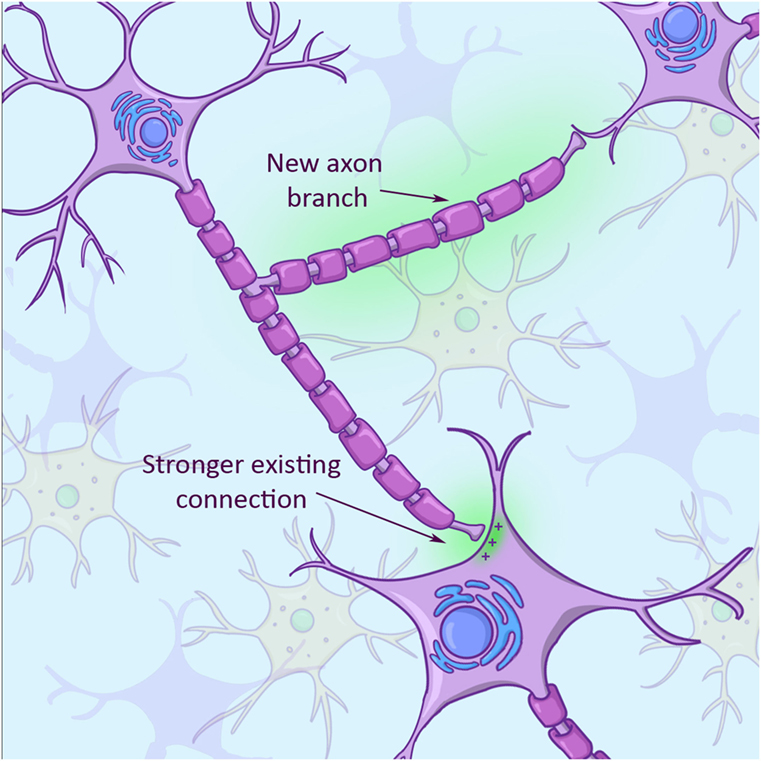
- شكل 3 - في استجابتها للإصابة، تستطيع خلايا المخ التأقلم مع الأذرع الجديدة النامية، (فرع المحور العصبي بخلفية خضراء)، وتستطيع التأقلم أيضًا من خلال زيادة أو إنقاص قوة الاتصالات القائمة بالفعل (الاتصال بين المحور العصبي والخلية المستقبلة بخلفية خضراء في أسفل اليمين).
تساق عملية اللدونة العصبية وتدار من خلال الأنشطة التي نقوم بها. فبعد حدوث السكتات الدماغية أو إصابات الدماغ، يمكن للناس التحسن إلى حد معين من خلال الخضوع للعلاج الطبيعي. ولا يرجع هذا التحسن في الأساس إلى عملية نمو الخلايا العصبية الجديدة كما تعلمنا مما سبق، ولكن لأن هؤلاء المرضى يواصلون تحفيز عملية اللدونة ولذلك يقومون ببناء اتصالات جديدة بين الخلايا العصبية الناجية داخل أمخاخهم.
ولكن لسوء الحظ، فإن عملية اللدونة كآلية شفاء لها قيود وحدود لا تستطيع تجاوزها. فهي تعتمد بالكامل على الخلايا الناجية، لذلك كلما زاد عدد الخلايا الناجية كان الأمر أفضل. وإذا تعرض شخص ما لإصابة دماغية أو سكتة دماغية خطيرة والتي تتسبب في قتل عدد كبير من الخلايا الدماغية، فإن هذا يعني وجود عدد أقل من الخلايا الناجية التي يمكن أن تدخل في عملية اللدونة مقارنة بما هو الحال بعد حدوث ارتجاج خفيف في المخ. فكلما كان هناك خلايا ناجية أكثر للقيام بعملية اللدونة، ازدادت فرص حدوثها. وهذا هو السبب في أن الإصابات الخطيرة في الجهاز العصبي المركزي عادةً ما تنتهي بإعاقات دائمة. ولأن عواقب هذه الإصابات الخطيرة شديدة ووخيمة، يعمل العلماء بجد واجتهاد للوصول إلى وسيلة تقي الخلايا العصبية من الموت، ويسعون إلى استبدال الخلايا الميتة بالخلايا الجذعية، لمساعدة الخلايا العصبية المصابة على النمو مرة أخرى، ولتحفيز عملية اللدونة.
مسرد للمصطلحات
الحبل الشوكي (Spinal Cord): ↑ جزء من الجهاز العصبي المركزي يسكن في العمود الفقري - ذلك الهيكل العظمي الموجود على طول الظهر. والحبل الشوكي هو المسؤول الأساسي عن التقاط كل أنواع المشاعر من جسمك وإرسالها للمخ لمعالجتها، بالإضافة إلى إرسال أوامر الحركة من المخ إلى الأذرع والأقدام.
العصبون أو الخلايا العصبية (Neurons): ↑ وهي الخلايا العصبية داخل المخ التي تستقبل الإشارات التي ترسلها باقي الخلايا العصبية وتعالجها ومن ثم ترسل إشارات جديدة لخلايا عصبية مختلفة. وهذه الشبكة من الخلايا العصبية المترابطة هي أساس كل العمل الذي يقوم به الجهاز العصبي المركزي، حتى تتمكن من التفكير والحركة والشعور بالأشياء.
ارتجاج المخ (Concussion): ↑ يحدث ارتجاج المخ حين يرتطم رأسك بشدة مما يسبب ارتطام المخ بالجمجمة. وإذا كنت قد تعرضت لارتجاج شديد بالمخ، فإنك قد ترى النجوم أمام عينيك، وربما لا تتذكر اليوم الذي أنت فيه، بل وربما تشعر بالغثيان.
السكتة الدماغية (Stroke): ↑ تحدث السكتة الدماغية عندما يكون هناك خلل في تدفق الدم إلى منطقة في المخ. فتموت الخلايا العصبية في هذه المنطقة سريعًا إذا توقفت عن استقبال الأشياء الحيوية كالسكر والأكسجين من الدم.
الأمراض العصبية التنكسية (Neurodegenerative Diseases): ↑ يشير المصطلح إلى الأمراض التي تتسبب في موت الخلايا العصبية (أو تسوء حالتها، بمعنى أنها تموت) لأنها غير قادرة على التغلب على التحديات التي تواجهها. وأغلب هذه التحديات هي عمليات كيميائية معقدة.
الخلايا الجذعية (Stem Cells): ↑ هي خلايا غير ناضجة لم تتطور إلى خلايا جلدية “متخصصة” أو إلى خلايا عصبية أو إلى أي خلايا في الجسم بعد. لدى هذه الخلايا القدرة على النمو داخل أي خلية في جسمك، والجزيئات التي تواجهها في رحلة نموها هي التي تحدد “الوظيفة” المستقبلية لها. يمكنها أن تتحول إلى أي خلية متخصصة، بما في ذلك الخلايا العصبية، إذا عالجها العلماء بجزيئات معينة.
الغمد المياليني (Myelin Sheath): ↑ هو الغطاء الدهني الذي يغلف المحاور العصبية للمساعدة في انتقال الإشارات عبر المحاور العصبية بأسرع ما يمكن. فعلى سبيل المثال، هذا الغطاء هو ما يجعلك تتصرف بسرعة حين تجرح نفسك، مثل أن تسحب يدك سريعًا قبل لمس سطح موقد ساخن.
الخلايا النجمية (Astrocytes): ↑ ترجع تسميتها بالخلايا النجمية إلى شكلها الذي يشبه النجوم. وهي الخلايا الداعمة في المخ والتي تختلف تمامًا عن الخلايا العصبية. وهي تدعم الخلايا العصبية بطرق متنوعة، مثل طرد الجزيئات الضارة بعيدًا.
الاستجابة المناعية (Immune Response): ↑ وهي رد فعل جسمك تجاه الإصابات. تقوم الاستجابة المناعية بإرسال الخلايا المتخصصة، بعضها من مناطق الإصابة والأخرى من مجرى الدم لتساعد على التنظيف والإصلاح.
اللدونة (Plasticity): ↑ وهي قدرة الخلايا العصبية على تغيير اتصالاتها لخلايا عصبية أخرى. اللدونة هي عملية بناء الخلايا العصبية لأذرع جديدة للاتصال بالخلايا العصبية الأخرى، أو ببساطة هي إضعاف أو تقوية اتصال قائم مع خلية عصبية أخرى.
إقرار تضارب المصالح
يعلن المؤلفون أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
هامش
[1] ↑ http://www.eurostemcell.org/commentanalysis/stem-cell-therapies-and-neurological-disorders-brain-what-truth
المراجع
[1] ↑ Silver, J., Schwab, M. E., and Popovich, P. G. 2015. Central nervous system regenerative failure: role of oligodendrocytes, astrocytes, and microglia. Cold Spring Harb. Perspect. Biol. 7(3):a020602. doi: 10.1101/cshperspect.a020602
[2] ↑ Loane, D. J., and Kumar, A. 2015. Microglia in the TBI brain: the good, the bad, and the dysregulated. Exp. Neurol. 275(Pt 3):316–27. doi: 10.1016/j.expneurol.2015.08.018
