ملخص
تخيّل وجود مختبر صغير داخل صندوق يمكنه تصنيع الأدوية مباشرةً في المستشفيات التي يُعالَج فيها المرضى، والأجمل من ذلك أن هذه الأدوية ستكون مصمَّمة بدقة بحيث تعالج كل مريض حسب حالته الخاصة! هذه الفكرة التي تبدو وكأنها من نسج الخيال هي جوهر مشروع جديد يُسمّى نانوسبريسو (NANOSPRESSO). ستتكوّن هذه الأدوية من ≫شاحنات توصيل≪ مجهرية تُعرَف باسم الجسيمات النانوية، يمكنها -بمجرد حقنها في الجسم- أن تنقل الدواء مباشرةً إلى الخلايا التي تحتاجه. أما الأدوية داخل هذه الجسيمات فستتكوّن من جزيئات تعليمات تُسمّى الأحماض النووية، وهي تخبر الخلايا بالطريقة الصحيحة لإصلاح المشكلات الخلوية الدقيقة التي تسبّب المرض. وسيكون إنتاج الأدوية باستخدام تقنية نانوسبريسو أسرع وأكثر مرونة من تصنيعها في المصانع، ما يجعل هذه الطريقة مفيدة جدًا لعلاج الأمراض النادرة التي لا تُنتَج لها أدوية حاليًا.
ومن هنا، قد تُحدِث تقنية نانوسبريسو ثورة في طريقة علاج الأمراض، بإتاحة العلاجات المتقدّمة والمخصّصة لعدد أكبر من الناس حول العالم.
من أين نحصل على أدويتنا؟
هل سبق لك أن شعرت بالمرض واحتجت إلى تناول دواء لنزلة برد أو عدوى؟ ربما وصف لك الطبيب حينها بعض الحبوب أو دواءً سائلًا، واضطر والداك لشرائه من الصيدلية. في الوقت الحاضر، يتأكد الصيادلة من صرف الدواء الصحيح الذي وصفه الطبيب، لكنهم في الواقع لا يصنعون الأدوية بأنفسهم؛ إذ يُنتَج معظمها في مصانع دوائية ضخمة ثم تُشحن إلى الصيدليات والمتاجر والمستشفيات حول العالم.
لكن الأمور لم تكن دائمًا على هذا النحو. هل تعلم أنه في الماضي كانت الأدوية تُحضَّر في الصيدلية نفسها؟ فمنذ وقتٍ ليس ببعيد، كان الصيادلة يخلطون المكوّنات يدويًّا لتحضير الدواء المناسب لكل مريض على حدة، وفقًا لوصفة الطبيب. تُعرَف هذه العملية، التي تُنتِج علاجات مخصَّصة، باسم التركيب الدوائي. ومع تقدّم العلوم الطبية وازدياد الطلب على الأدوية، انتقلت عملية تطوير الأدوية وتصنيعها إلى مصانع كبيرة تُسمّى شركات الأدوية. وقد طوّرت هذه الشركات طرقًا لإنتاج الأدوية بكميات ضخمة، مما جعلها أرخص ثمنًا، وضمن توفّرها دائمًا في الصيدليات والمستشفيات لتلبية حاجة المرضى.
صناعة الأدوية بكميات ضخمة ليست الحل الأمثل في جميع الأحوال
تؤدّي المصانع الدوائية عملًا رائعًا في إنتاج الأدوية الشائعة التي تناسب الجميع، مثل اللقاحات ومسكنات الألم، إلا أن هذه الطريقة تسبّب بعض المشكلات أيضًا؛ فالغرض من الأدوية المُصنَّعة بكميات كبيرة أن تعالج أكبر عدد ممكن من الناس، إلا أن استجابة كل شخص للدواء تختلف عن الآخر؛ فالعلاج الذي ينجح مع شخص قد لا يكون فعّالًا بالقدر نفسه مع شخص آخر. وتتجلى هذه الحقيقة في الأمراض المعقّدة مثل السرطان، أو في الحالات التي تتطلّب علاجًا مخصَّصًا بناءً على الخصائص الفريدة لكل مريض. وعندما تُنتَج الأدوية في عدد محدود من المصانع الكبرى فقط، فقد يحدث نقص في هذه الأدوية إذا واجهت تلك المصانع مشاكل في الإنتاج أو نقصًا في المواد أو تأخيرًا في الشحن. وأخيرًا، فإن إنتاج الأدوية وشحنها بهذا الحجم الكبير يستهلك الكثير من الطاقة والموارد، مما يؤدي إلى تفاقم التلوّث والنفايات في البيئة.
والأمر الأكثر إثارة للقلق هو وجود حالات نادرة تُعرَف باسم الأمراض النادرة، لا تتوافر لها أدوية فعّالة حتى الآن. فتطوير دواء جديد لهو أمر مكلف للغاية، ولهذا تميل شركات الأدوية إلى التركيز على الأمراض الشائعة التي تصيب أعدادًا كبيرة من المرضى؛ إذ ليس من المجدي اقتصاديًّا أن تنفق الشركات ملايين الدولارات لتطوير علاج لا يحتاجه سوى عدد قليل من الأشخاص.
ويعني هذا أن المرضى الذين يعانون من أمراض نادرة غالبًا ما لا تتوفر لهم أي خيارات علاجية، رغم وجود ما يقارب سبعة آلاف مرض نادر معروف تؤثّر مجتمعة على أكثر من ٣٠٠ مليون شخص حول العالم [1, 2]!
وقد بدأ العلماء -في الآونة الأخيرة- في العمل على طريقة جديدة لصنع الأدوية تشبه إلى حد كبير عملية التركيب الدوائي ويُطلَق على هذا النهج الجديد اسم نانوسبريسو، ويهدف إلى إنتاج أدوية مخصَّصة محليًّا داخل المستشفيات نفسها حيث يحتاجها المرضى بدلًا من الاعتماد على المصانع الضخمة.
إذن، ما هي تقنية نانوسبريسو؟
ربما شاهدت من قبل إحدى آلات المشروبات الغازية الرائعة، التي تختار فيها مشروبك المفضل مثل الكولا أو سبرايت، ثم تضيف نكهات حسب ذوقك مثل الكرز أو الفانيليا أو الليمون لتصنع مشروبك الشخصي. أو ربما يستخدم والداك آلة قهوة يضعان فيها كبسولة صغيرة من النوع الذي يفضلانه، فتحضّر لهما كوبًا طازجًا من القهوة بالطريقة التي يفضلانها. هذه هي الفكرة الأساسية وراء تقنية نانوسبريسو، وهي عبارة عن طريقة جديدة لإنتاج كميات صغيرة من الأدوية المخصّصة داخل المستشفى نفسه. ويأتي اسم ≫نانوسبريسو≪ من كلمتين: نانو وتعني بالإنجليزية ≫جزيئات دقيقة≪، و اسبريسو وهو نوع من القهوة يُحضَّر بسرعة باستخدام آلة خاصة، في إشارة إلى أن هذا النظام يصنع بسرعة جزيئات نانوية دقيقة تحتوي على الدواء الدقيق الذي يحتاجه كل مريض بحسب حالته المرضية الخاصة.
بيد أن صنع الأدوية أكثر تعقيدًا بكثير من تحضير فنجان إسبريسو في المنزل أو خلط النكهات في مشروب غازي؛ فالأدوية التي تُنتجها تقنية نانوسبريسو تُصنع من الأحماض النووية وهي جزيئات من الحمض النووي الريبوزي أو الحمض النووي الريبوزي منقوص الأكسجين تحمل التعليمات التي تخبر خلايا الجسم بكيفية إنتاج البروتينات. تُعد البروتينات اللبنات الأساسية في الجسم، فهي مسؤولة عن كل شيء، من حركة العضلات إلى مقاومة العدوى. لكن عندما تُنتج الخلايا كميات زائدة أو ناقصة من بعض البروتينات، أو عندما لا تعمل بعض البروتينات بشكل صحيح، يمكن أن تظهر الأمراض. ويمكن تصميم أدوية الأحماض النووية خصيصًا لتزويد الخلايا بالتعليمات الصحيحة لإنتاج البروتين المهم المفقود. وفي الحالات التي تُنتِج فيها الخلايا بروتينًا معيبًا يسبّب أحد الأمراض، يمكن لهذه الأدوية أن تلتصق بالتعليمات الجينية الخاطئة في خلايا المريض و≫تمنعها≪ قبل أن تنتج البروتين المسبّب للمشكلة (انظر الشكل 1).
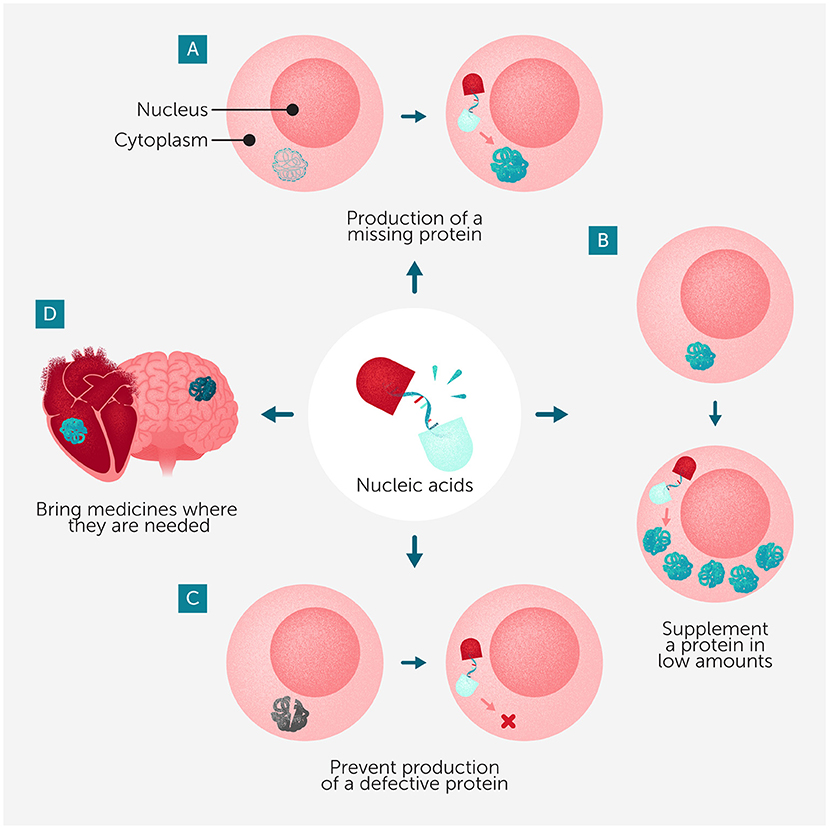
- شكل 1 - يمكن تصميم أدوية الأحماض النووية التي تُنتَج باستخدام تقنية نانوسبريسو بحيث تؤدي الوظائف التالية: (A) مساعدة الخلايا على إنتاج بروتين مهم لا تستطيع إنتاجه بصورة طبيعية.
- (B) مساعدة الخلايا على زيادة إنتاج بروتين لا تُنتجه بكميات كافية. (C) منع الخلايا من إنتاج بروتين غير صحيح أو معيب قد يسبّب مشكلات صحية. (D) كما يمكن تصميم أدوية قائمة على تقنية نانوسبريسو لتوصيلها بدقّة إلى الأعضاء التي تحتاجها داخل الجسم.
إيصال الأحماض النووية إلى الخلايا مهمة صعبة
ليس من السهل إدخال أدوية الأحماض النووية إلى داخل الخلايا؛ فالأحماض النووية عادةً أكبر حجمًا بكثير من الأدوية التقليدية، كما أنها تحمل شحنة سالبة، وهذان العاملان يجعلان المرور عبر الغشاء الخارجي الواقي للخلية أمرًا صعبًا عليها. كما أن الأحماض النووية رقيقة وسريعة التحلّل داخل الجسم.
ومن دون حماية، ستتلف هذه الأدوية قبل أن تتمكّن من الوصول إلى الخلايا المطلوبة. ولكي تنجح هذه الأدوية في مهمتها، كان على العلماء أولًا أن يجدوا طريقة لتغليف الأحماض النووية بحيث تتمكّن من الوصول بأمان إلى هدفها داخل الجسم.
وإحدى الطرق لحل هذه المشكلة هي تغليف الأحماض النووية داخل جسيمات نانوية، وهي جزيئات دقيقة للغاية من صنع الإنسان يمكنها حمل الدواء وحمايته [3, 4]. تُعد هذه الجسيمات النانوية مثل شاحنات توصيل تنقل الدواء بأمان داخل الجسم إلى المكان المطلوب. وتُسمّى أكثر أنواع الجسيمات النانوية استخدامًا في أدوية الأحماض النووية الجسيمات النانوية الدهنية (LNPs). وهي جزيئات شبيهة بالدهون يمكنها تكوين فقاعات دقيقة تحيط بالدواء، فتحميه من التلف وتساعده على الانزلاق إلى داخل الخلايا (انظر الشكل 2). ولتتخيّل حجم هذه الجسيمات الصغيرة: لو صغّرنا كوكب الأرض إلى حجم كرة قدم، ثم صغّرنا كرة القدم بالمقدار نفسه، فسيكون الناتج تقريبًا بحجم الجسيم النانوي الدهني الواحد! ويمكن تصميم الجسيمات النانوية بحيث تُطلِق محتواها في الوقت المناسب تمامًا فور دخولها إلى الخلايا. كما يمكن للعلماء تعديل الجسيمات النانوية ≫لتوجيهها≪ نحو أنسجة محددة، مثل الكبد أو العضلات.
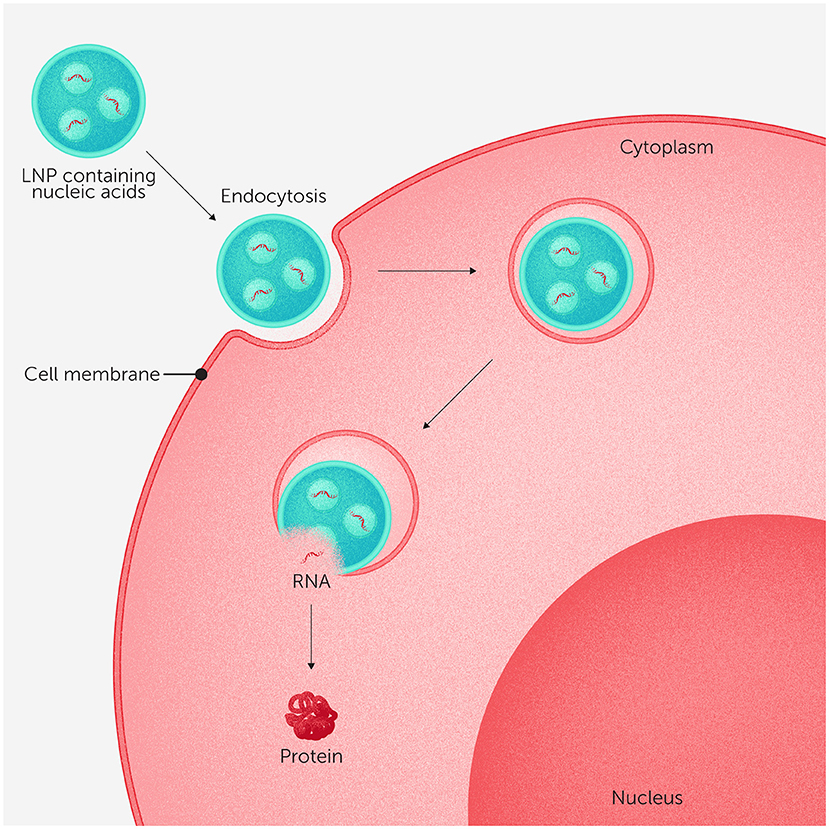
- شكل 2 - يمكن للجسيمات النانوية الدهنية أن تُشكّل فقاعات دقيقة تُحيط بالأدوية المكوّنة من الأحماض النووية، فتحمي هذه الأحماض الحساسة وتساعدها على الدخول إلى الخلايا.
- وتدخل الجسيمات النانوية الدهنية إلى الخلايا من خلال عملية تُعرف باسم ≫الالتقام الخلوي≪، حيث يلتف الغشاء الخلوي حول الجسيم النانوي الدهني ويسحبه إلى داخل الخلية. وبمجرد دخولها الخلية، تنفتح هذه الجسيمات –مثل فقاعة انفجرت– وتُفرِغ حمولتها من الأحماض النووية، التي يمكن للخلية أن تستخدمها بعد ذلك لإنتاج بروتينات مفيدة (للمزيد من التفاصيل حول كيفية تحويل الخلايا جزيئات الحمض النووي الريبوزي إلى بروتينات، يمكنك زيارة هذا الموقع).
لم تكن تقنية الجسيمات النانوية وليدة اليوم في عالم نانوسبريسو؛ فقد لعبت هذه التقنية في الواقع دورًا محوريًا في إنجازٍ طبي ربما تعرفه عن قُرب، هو لقاح كوفيد-19 القائم على الحمض النووي الريبوزي المرسال [5, 6]. يستخدم هذا اللقاح الجسيمات النانوية الدهنية لتوصيل التعليمات الوراثية بأمان لإخبار الخلايا بكيفية إنتاج بروتين غير ضار مأخوذ من الفيروس. وبمجرد دخول هذه التعليمات إلى الخلايا، تُفعّل جهاز المناعة في الجسم، ليكون مستعدًا لمهاجمة الفيروس الحقيقي إن واجهه لاحقًا. ويعمل العلماء اليوم على استخدام أنظمة توصيل مشابهة تعتمد على الجسيمات النانوية لعلاج أمراض أخرى، بحيث تصل الأدوية التي تحملها بأمان إلى الخلايا المريضة في جسم المريض. أما نانوسبريسو، فهي ترتقي بهذه الفكرة إلى مستوى جديد تمامًا، إذ تتيح إنتاج أدوية مخصّصة من الأحماض النووية لمرضى مُحدَّدين في اللحظة التي يحتاجون إليها فيها، سواء في المستشفيات أو العيادات.
تصنيع الأدوية المخصَّصة باستخدام تقنية نانوسبريسو
لتحضير دواء مخصّص باستخدام تقنية نانوسبريسو، تبدأ العملية بتحليل التركيب الجيني للمريض لتحديد الجينات أو البروتينات المعيبة المُسببة للمرض، والوقوف على قدرة العلاج القائم على الأحماض النووية على إصلاحها.
وبمجرد أن يعرف الأطباء دواء الحمض النووي الذي يحتاجه المريض، تُجهّز خرطوشة مخصَّصة له تحديدًا، تمامًا كما تستخدم آلة القهوة كبسولات محددة لتحضير أنواع مختلفة من القهوة حسب ذوق كل شخص، وتكون كل خرطوشة بحجم هاتف ذكي تقريبًا، وتتكوّن من حجرتين: إحداهما تحتوي على دواء المريض المكوّن من الأحماض النووية، والأخرى تضم خليط الدهون اللازم لتشكيل الجسيمات النانوية الواقية (انظر الشكل 3). وتتضمن الخرطوشة أيضًا قنوات رفيعة يختلط فيها المكونان معًا، وتُعرف هذه القنوات باسم نظام الخلط الدقيق للسوائل عبر قنوات مجهرية.
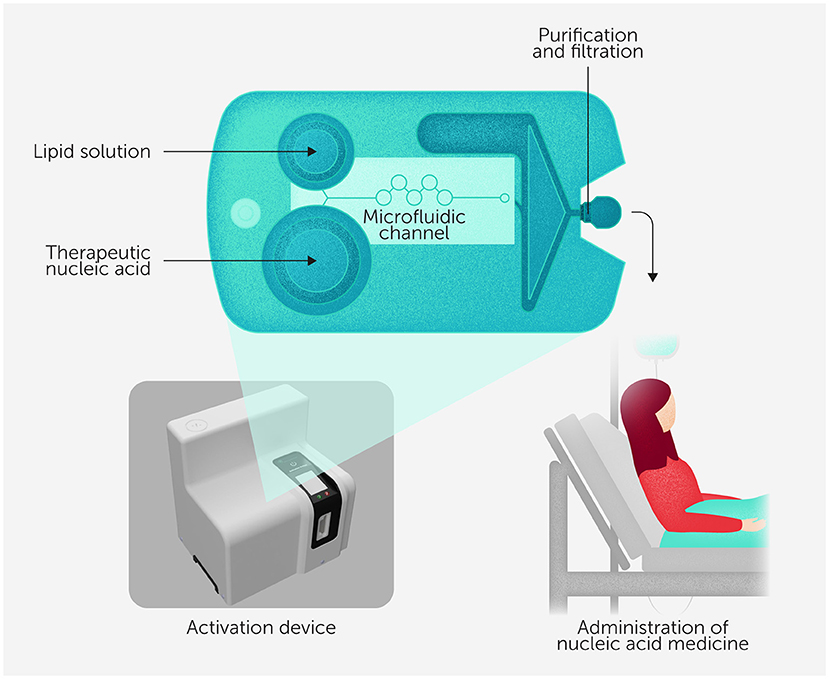
- شكل 3 - مثال على خرطوشة نانوسبريسو، وهي بحجم هاتف ذكي تقريبًا.
- يُحفظ خليط الدهون ودواء الأحماض النووية في الأصل داخل حجرتين منفصلتين. ثم تُدرج الخرطوشة في جهاز التفعيل، الذي يخلط المكوّنين عبر دفعهما من حجراتهما إلى القنوات الرفيعة (الخاصة بالخلط الدقيق للسوائل عبر قنوات مجهرية). ينتج عن هذا الخلط جسيمات نانوية مستقرة، تُنقّى أثناء مرورها عبر مرشّح عند خروجها من الخرطوشة. وفي النهاية، يُحقن الدواء المُنقَّى في المريض، وتستغرق هذه العملية بأكملها بضع دقائق فقط!
تُدرج الخرطوشة في جهاز التفعيل نانوسبريسو، الذي يُولّد مقدارًا مضبوطًا بعناية من الضغط لدفع قطرات سائلة دقيقة من الحجرتين إلى قنوات الخلط الدقيق للسوائل عبر قنوات مجهرية حيث تمتزج المكوّنات بدقة عالية. يجمع الخلط الدقيق للسوائل عبر قنوات مجهرية هذه المكوّنات بطريقة مثالية لتكوين جسيمات نانوية مستقرة. والنتيجة؟ دفعة طازجة من الدواء، تُحضَّر بسرعة وأمان داخل المستشفى، لتكون جاهزة لحقنها في جسم المريض مباشرةً.
يمكن لتقنية نانوسبريسو أن تُسهم في تطوير علاجات للعديد من الأمراض المختلفة، بما في ذلك الأمراض النادرة التي لا تتوفر لها حاليًا سوى خيارات علاجية قليلة أو معدومة. ومن الأمثلة على هذه الأمراض حُمَاضُ الميثيل مالونيك (Methylmalonic Acidemia)، وهو اضطراب يجعل الجسم غير قادر على تكسير بعض أنواع الأطعمة بشكل سليم، مما يؤدي إلى تراكم خطير للمواد السامة.
ومثال آخر هو متلازمة كريغلر–نجار (Crigler-Najjar Syndrome)، وهي مرض كبدي نادر يمنع الجسم من التخلص من الفضلات الموجودة في الدم، مما قد يؤدي إلى مضاعفات خطيرة. وتنتج كلتا الحالتين عن نقص أو خلل في بعض البروتينات، ويعني هذا أنه يمكن علاجهما باستخدام أدوية الأحماض النووية التي تُصدر التعليمات اللازمة للخلايا لإنتاج البروتينات الصحيحة.
وقد تكون قدرة تقنية نانوسبريسو على إنتاج دفعات صغيرة ومخصّصة من الأدوية مفيدة أيضًا في علاج السرطان؛ فبعض علاجات السرطان تعمل على مساعدة جهاز المناعة في التعرّف على الأورام ومهاجمتها. وتستطيع المستشفيات -باستخدام تقنية نانوسبريسو- أن تحضِّر هذه العلاجات المناعية عند الحاجة مباشرةً، بدلًا من انتظار تصنيعها في مصانع الأدوية الكبرى. كما يمكن لهذه التقنية أن تُساعد الأطباء في الاستجابة بسرعة للأمراض الطارئة. فعندما يظهر فيروس جديد -مثلًا- يمكن استخدام تقنية نانوسبريسو في المستشفيات لإنتاج دفعات صغيرة من اللقاحات في المكان الذي يُصيب فيه الفيروس أكبر عدد من الناس. وهذا يُسهم في مساعدة المجتمعات على مواجهة التفشّي بسرعة تفوق ما تسمح به طرق تصنيع اللقاحات التقليدية.
هل يمكن لتقنية نانوسبريسو توفير الأدوية المتخصَّصة للجميع؟
أحد أهم مزايا تقنية نانوسبريسو هو أنها لا تتطلب تصميم نظام علاجي جديد كليًا لكل مرض. إذ تتشابه الأحماض النووية جميعها في البنية الجزيئية الأساسية، لذا فإن أدوية الأحماض النووية تختلف فقط في تسلسلها وطولها. وهذا يعني أنه يمكن استخدام النوع نفسه من الخرطوشة ونظام الخلط لإنتاج العديد من الأدوية المختلفة، الأمر الذي يجعل تطوير العلاجات الجديدة أسهل وأكثر توفيرًا. كما أن التقنية مصممة لتكون بسيطة بما يكفي ليستخدمها طاقم المستشفى المدرّب، دون الحاجة إلى خبراء تصنيع على درجة عالية من التخصص. كما يمكن لتقنية نانوسبريسو -عمومًا- أن تسهّل حصول المرضى في كل مكان على العلاجات المخصَّصة التي يحتاجونها، بغض النظر عن أماكن إقامتهم أو ندرة أمراضهم. وفي أجزاء كثيرة من العالم، يظل الوصول إلى الأدوية المتقدمة محدودًا بسبب ارتفاع تكلفة شحنها واحتياجها إلى التبريد. لكن مع تقنية نانوسبريسو، يستطيع الأطباء إنتاج هذه الأدوية محليًا، بما يضمن وصول العلاجات الفعالة إلى المرضى في المناطق النائية أو المحرومة.
بيد أن تقنية نانوسبريسو لا تزال حاليًا قيد التطوير، وثمة تحديات يجب تجاوزها قبل أن تُستخدم على نطاق واسع. فالقوانين التي تضعها الحكومات لضمان سلامة الأدوية صُممت أساسًا للأدوية المصنّعة في المصانع، لذا يجب وضع قوانين جديدة لضمان سلامة الدُفعات الصغيرة من الأدوية المُنتجة في المستشفيات. وتتمثل عقبة أخرى في التكلفة، إذ إن أدوية الأحماض النووية حاليًا باهظة الثمن في إنتاجها، كما تحتاج المستشفيات إلى المعدات المناسبة وتدريب طواقمها على استخدام تقنية نانوسبريسو بكفاءة. ويعكف العلماء على إيجاد طرق لجعل هذه العملية أكثر توفيرًا وضمان سلامة كل جرعة وفعاليتها.
بمجرد التغلب على هذه التحديات المتبقية، قد تصبح تقنية نانوسبريسو متاحة يومًا ما لملايين المرضى حول العالم، لتقدّم علاجات ضرورية للأمراض النادرة، وعلاجًا مخصصًا لأنواع معينة من السرطان، وحتى لقاحات جديدة. وفي ظل نقل عملية إنتاج الأدوية من شركات الأدوية الكبرى إلى الأماكن التي يحتاج فيها المرضى إلى العلاج، تمثّل تقنية نانوسبريسو خطوة واعدة نحو مستقبل تتوفر فيه أدوية فعّالة ومخصَّصة عند الحاجة، لعدد أكبر من الناس أكثر من أي وقت مضى.
مسرد للمصطلحات
دوائيّ (Pharmaceutical): ↑ يُشير إلى كل ما يتعلّق بصناعة الأدوية أو استخدامها، خاصةً في المصانع أو الشركات التي تُنتج العقاقير للأطباء والمستشفيات والصيدليات لعلاج الأمراض.
العلاجات المخصَّصة (Personalized Treatments): ↑ هي أدوية أو علاجات تُصمَّم خصيصًا لشخص واحد، بناءً على جيناته الفريدة أو نوع مرضه أو طبيعة جسده، بدلًا من استخدام العلاج نفسه لجميع المرضى.
التركيب الدوائي (Compounding): ↑ هي عملية خلط مكوّنات مختلفة لصنع دواء مخصّص لمريض بعينه، ويقوم بها عادةً الصيدلي وليس المصنع.
الأمراض النادرة (Orphan Diseases): ↑ هي أمراض تصيب عددًا قليلًا من الأشخاص، وغالبًا لا يتوفر لها علاج لأن تصنيع أدويتها لا يُعَدّ مربحًا لشركات الأدوية.
الأحماض النووية (Nucleic Acids): ↑ هي جزيئات مثل الحمض النووي الريبوزي منقوص الأكسجين والحمض النووي الريبوزي، تحمل تعليمات تخبر الخلايا بما يجب أن تفعله، مثل كيفية إنتاج البروتينات التي تحافظ على أداء الجسم لوظائفه بشكل سليم.
البروتينات (Proteins): ↑ هي أشبه بآلات دقيقة أو لبنات أساسية داخل الجسم تؤدي وظائف أساسية، مثل مساعدة العضلات على الحركة، أو محاربة الجراثيم، أو نقل الإشارات بين الخلايا.
الجسيمات النانوية (Nanoparticles): ↑ هي جزيئات دقيقة للغاية يمكنها حمل الأدوية داخل الجسم ومساعدتها على الوصول إلى الخلايا الصحيحة، مثل شاحنات توصيل مجهرية تنقل الدواء.
الخلط الدقيق للسوائل عبر قنوات مجهرية (Microfluidic Mixing): ↑ هو طريقة لخلط كميات صغيرة جدًا من السوائل عبر قنوات دقيقة، مما يساعد العلماء على إنتاج مواد مثل الجسيمات النانوية بسرعة ودقة، وغالبًا ما تُنفذ هذه العملية داخل خرطوشة أو جهاز خاص.
إقرار تضارب المصالح
يعلن المؤلفون أن البحث قد أُجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
شُكر وتقدير
نتوجه بالشكر إلى المراجعين الصغار Aanya وAyushi وRayna وAnabelle وHarish على آرائهم القيّمة وتعاونهم المتحمّس خلال عملية المراجعة، فقد ساهمت أسئلتهم وأفكارهم مساهمة عظيمة في تحسين وضوح عملنا وتعزيز تأثيره. حررت المقال Susan Debad الحاصلة على درجة الدكتوراة وخريجة كلية مورنينغسايد للدراسات العليا في العلوم الطبية الحيوية بكلية الطب في جامعة ماساتشوستس تشان (الولايات المتحدة الأمريكية) وكاتبة/محررة علمية في شركة إس جي دي للاستشارات ذ.م.م. كما نتوجه بالشكر إلى كل من شارك في تأليف المقال الأصلي. وقد حصل مشروع نانوسبريسو–NL على تمويل من أجندة العلوم الهولندية–المنظمة الهولندية للبحث العلمي بموجب المنحة رقم .1389.20.096.NWA ولم تشارك الجهة الممولة في تصميم الدراسة أو جمع البيانات أو تحليلها أو تفسيرها أو كتابة هذا المقال أو اتخاذ قرار نشره.
إفصاح أدوات الذكاء الاصطناعي
تم إنشاء النص البديل (alt text) المرفق بالأشكال في هذه المقالة بواسطة "فرونتيرز" (Frontiers) وبدعم من الذكاء الاصطناعي، مع بذل جهود معقولة لضمان دقته، بما يشمل مراجعته من قبل المؤلفين حيثما كان ذلك ممكناً. في حال تحديدكم لأي خطأ، نرجو منكم التواصل معنا.
مقال المصدر الأصلي
↑ Estap, Ã., Senti, M., Ceccaldi, A., Luciani, M., Saber, N., Schurmann, P. J. L., et al. 2025. تقنية نانوإسبريسو: نحو عصر الأدوية النانوية المخصَّصة المعتمدة على الأحماض النووية والمصنّعة محليًا. Front. Sci. 3:1458636. doi: 10.3389/fsci.2025.1458636
المراجع
[1] ↑ The Lancet Global Health 2024. The landscape for rare diseases in 2024. Lancet Glob. Health 12:e341. doi: 10.1016/S2214-109X(24)00056-1
[2] ↑ Cavaller-Bellaubi, M., Hughes-Wilson, W., Kubinová, Š., Van de Casteele, M., Van Lente, E. J., Degortes, E., et al. 2023. Patients, payers and developers of Orphan Medicinal Products: lessons learned from 10 years’ multi-stakeholder dialogue on improving access in Europe via MoCA. Orphanet. J. Rare Dis. 18:144. doi: 10.1186/s13023-023-02774-7
[3] ↑ Akinc, A., Maier, M. A., Manoharan, M., Fitzgerald, K., Jayaraman, M., Barros, S., et al. 2019. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nat. Nanotechnol. 14:1084–7. doi: 10.1038/s41565-019-0591-y
[4] ↑ Jayaraman, M., Ansell, S. M., Mui, B. L., Tam, Y. K., Chen, J., Du, X., et al. 2012. Maximizing the potency of siRNA lipid nanoparticles for hepatic gene silencing in vivo. Angew. Chem. Int. Ed. 51:8529–33. doi: 10.1002/anie.201203263
[5] ↑ Schoenmaker, L., Witzigmann, D., Kulkarni, J. A., Verbeke, R., Kersten, G., Jiskoot, W., et al. 2021. mRNA-lipid nanoparticle COVID-19 vaccines: structure and stability. Int. J. Pharm. 601:120586. doi: 10.1016/j.ijpharm.2021.120586
[6] ↑ Suzuki, Y., and Ishihara, H. 2021. Difference in the lipid nanoparticle technology employed in three approved siRNA (Patisiran) and mRNA (COVID-19 vaccine) drugs. Drug Metab. Pharmacokinet. 41:100424. doi: 10.1016/j.dmpk.2021.100424
