תַקצִיר
בשנת 1928, סֶר אלכסנדר פלמינג הבחין בהשפעות הורגות החיידקים של פניצילין במעבדה שלו בלונדון. זה היה הצעד הראשון לקראת גילויו של אחד מעמודי התווך של הרפואה כיום: האנטיביוטיקה. לקח שנים רבות למצוא דרך להפיק פניצילין בכמויות גדולות, וייצור המוני התחיל רק ב-1945. אולם עד היום, פלמינג נחשב לאבי האנטיביוטיקה, וללא התגלית שלו לא יכולנו לטפל בהרבה מהזיהומים שנגרמים על-ידי חיידקים. משמעות הדבר היא שללא אנטיביוטיקה כל פצע מזוהם קטן יכל להפוך לקטלני. נוסף על כך ניתוחים הרבה יותר בטוחים עם אנטיביוטיקה, ואנשים עם מערכות חיסון חלשות (כמו ילדים או זקנים) יכולים להתאושש בקלות מזיהומים חיידקיים. אולם חיידקים נעשים עמידים לאנטיביוטיקה, מה שגם פלמינג חזה בשנת 1945 במהלך נאום קבלת פרס הנובל שלו.
אויבים וחברים זעירים
חיידקים חשובים מאוד עבורנו. הם חיים עלינו ובתוכנו, ואנו משתמשים בהם לקבל חומרים מסוימים ממזון, בין השאר (קראו עוד במאמר פרונטירז: איננו לבד אף פעם: לחיות עם הַמִּיקְרוֹבּיוֹטָה של האדם [1]). אולם חלק מהחיידקים, שנקראים פתוגנים, יכולים גם לגרום לזיהומים, וחלק מהפתוגנים יכולים להיות מסוכנים מאוד. חיידקים פתוגנים הם אחד הנושאים המרכזיים במיקרוביולוגיה [2], שהיא חֵקֶר מיקרואורגניזמים: צורות חיים זעירות שאי אפשר לראות בעין בלתי מזוינת. מיקרוביולוגים התמודדו עם אותן שאלות מאז שהחיידקים התגלו – כיצד חיידקים מזהמים בני אדם, והכי חשוב, האם יש משהו שאפשר לעשות כדי לעצור אותם?
חיידק בודד ניתן לראות רק באמצעות מיקרוסקופ. אולם מרבית החיידקים גדלים טוב בסביבה עם הרבה חומרי מזון, ותמיסות עשירות מאוד בחומרי מזון (שידועות גם כמדיום נוזלי) יכולות לשמש לגידול חיידקים [2]. אם משאירים צינורית עם תמיסה סטרילית ומספר קטן של חיידקים בתוכה בטמפרטורה מסוימת, הנוזל יהפוך למעונן בתוך כמה שעות, והוא עשוי אפילו לשנות צבע. אם מוסיפים חומר דמוי ג’לי לתמיסה והתערובת מחוממת עד להמסה של הג’לי, אפשר לשפוך את החומר הזה לתוך צלחות (שידועות גם בשם צלחות פֶּטְרִי) לקירור, ואז מקבלים ג’לי עשיר בחומרי מזון שידוע כמדיום מוצק. חיידקים יכולים לגדול בתרבית על פני השטח של מדיום מוצק. אם נוסיף מספיק חיידקים, הם יכסו את כל פני השטח של הג’לי העשיר בחומרי מזון. אם החיידקים נמהלים ומפוזרים מספיק על הצלחת, חיידק בודד יתחלק כל כך הרבה שבסופו של דבר הוא ייצר קבוצת חיידקים גדולה שאפשר לראות בעין בלתי מזוינת, שאנו קוראים לה מוֹשֶבֶת חיידקים. אם מקור החיידקים המקורי הכיל יותר מסוג חיידק אחד, המושבות של סוגי חיידקים שונים עשויות לגדול על המדיום המוצק. כשאנו נוגעים באחת מהמושבות האלה באמצעות אובייקט סטרילי, ומעבירים את החיידקים למדיום נוזל או מוצק סטרילי, אנו יכולים להפיק תרבית טהורה שאמורה להכיל רק סוג אחד של חיידקים [2]. באופן שגרתי, מיקרוביולוגים עובדים עם תרביות טהורות כדי להיות מסוגלים להגיע למסקנות ברורות מהניסויים שלהם עם סוג חיידק בודד. אולם אם העבודה שלהם לא נעשית בתנאים סטריליים, הצינוריות והצלחות עשויים להזדהם על-ידי חיידקים אחרים, או אפילו על-ידי פטריות מיקרוסקופיות שחיות בסביבה. אם זה קורה, מרבית המיקרוביולוגים זורקים את התרבית ומתחילים שוב מההתחלה. אולם פלמינג היה שונה מרוב המיקרוביולוגים.
תאונה שחיכתה לקרות...
בוקר אחד ביום שני, ה-3 בספטמבר 1928, פלמינג חזר מחופשה משפחתית [3]. לפני שהוא יצא לחופשה, פלמינג עבד עם פתוגן שכיח מאוד: Staphylococcus aureus. פלמינג השאיר כמה צלחות פטרי מזכוכית על שולחן המעבדה שלו, עם החיידקים האלה שגדלו על פני השטח של מדיום מוצק. בדרך כלל, הצלחות האלה נוקו על-ידי טכנאי מעבדה כדי שיוכלו לשמש שוב בניסויים אחרים. אולם פלמינג תמיד הסתכל על כל הניסויים שלו לפני השלכתם, אפילו אם הם נשמרו במשך שבועות על השולחן (איור 1A). הוא היה שולף דגימות באופן אקראי ממגרת הצלחות כדי לראות אם משהו מעניין קרה במהלך השבועות האחרונים. מאחר שהמעבדה שלו הייתה די פרימיטיבית, לפלמינג בדרך כלל היו זיהומים על הצלחות שלו, שלעיתים קרובות נגרמו על-ידי שמרים ועובש מהסביבה. אולם צלחת אחת נראתה שונה מאוד, וכשהוא הבחין בצלחת הוא אמר “זה מצחיק...”. הצלחת היתה מלאה בתרבית חיידקים צפופה, אולם היא גם הייתה מזוהמת בפטריות מיקרוסקופיות שיצרו מושבה גדולה בצד אחד של הצלחת. מה שהיה לא שגרתי הוא שהחיידקים לא היו מסוגלים לגדול באזור שקרוב למושבת הפטריות. היה אזור ברור שהקיף את הפטריות שהיה לגמרי נטול חיידקים; כיום, אנו קוראים לאזור הזה אזור האינהיביציה (איור 1B). לכן, פלמיג גילה שהפטריה (Penicillium notatum) יצרה משהו שהרג את החיידק Staphylococcus aureus, פתוגן מסוכן. פלמינג גילה את האנטיביוטיקה, ובראשית הדרך קרא לה “מיץ עובש” [3].
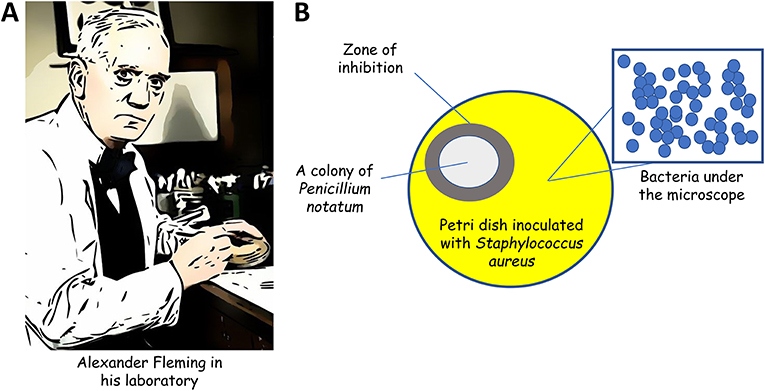
- איור 1 - (A) סר אלכסנדר פלמינג בשולחן המעבדה שלו בלונדון (1943) (B) פלמינג הבחין בכך שמושבת החיידקים (Penicillum notatum) זיהמה צלחת פטרי שהיתה מלאה ב-S. aureus, פתוגן חיידקי מסוכן.
- באופן מעניין, S. aureus לא היה מסוגל לגדול באזור שהקיף את המושבה של P. notatum. פלמינג הסיק שהפטריות יצרו משהו שהרג את S. aureus באזור האינהיביציה.
באותו הזמן, גם פלמינג וגם הקולגות שלו לא חשבו שהתגלית הזו תהיה חשובה, והחשיבות המעשית שלה הודגמה יותר מעשור מאוחר יותר. אולם פלמינג בדיוק גילה את המלחמה הביולוגית שמתרחשת בין מיקרואורגניזמים שונים, שנלחמים על מקום בסביבה עשירה בחומרי מזון [2]. פלמינג לא יצר את הפניצילין, הוא זיהה שמושבה של פטריות מיקרוסקופיות יצרה פניצילין, כדרך להתחרות עם חיידקים על חומרי מזון בצלחת שכמעט הושלכה. מאז, מיקרוביולוגים חיפשו בטבע אנטיביוטיקות חדשות כדי לבחון אם מיקרואורגניזמים אחרים יכולים לייצר אנטיביוטיקה, והגישה הזו הייתה מוצלחת מאוד. ברגע שחומר אנטי-מיקרובי חדש מזוהה, החומר הזה מטוהר ועשוי להיות משונה כימית כדי להקל על ההפקה של חומר אנטיביוטי חדש בייצור המוני, או ליצור גרסאות חדשות של החומר המקורי. אנו עדיין מחפשים אנטיביוטיקה חדשה, וכל אחד יכול להיות חלק מהחיפוש הזה דרך יוזמות כמו “Swab and Send” [4].
כיצד פניצילין עובדת?
האופן שבו פניצילין עובדת ומדכאת את גדילת החיידקים לא היה מובן עד 1980. כיום אנו יודעים שפניצילין מדכאת את הפעילות של אנזימים מסוימים בחיידקים שנקראים חלבונים קושרי-פניצילין (PBPs - penicillin-binding proteins), שהם הכרחיים למרבית החיידקים כדי ליצור דופן שמכסה את התאים שלהם. ללא הדופן הזו, תאי חיידקים הרבה יותר חשופים לסביבה, והם עשויים למות מאוד בקלות כשהסביבה משתנה. בנוכחות של פניצילין, חיידקים לא יכולים לייצר את דופן התא הזו כדי להגן על עצמם, והם מתים. פניצילין היא חלק ממשפחה של אנטיביוטיקות דומות שנקראות β-lactams, והרבה חיידקים נעשים עמידים ל-β-lactams על-ידי ייצור אנזימים שמפרקים את האנטיביוטיקות האלה, או על-ידי רכישת גרסאות שונות של חלבונים קושרי-פניצילין שכבר לא קושרות פניצילין [2].
ההתנגדות עולה...
מה שפלמינג חזה במהלך נאום קבלת הנובל שלו בשנת 1945 היה שחיידקים יוכלו להיעשות עמידים לאנטיביוטיקה. זה קורה כתוצאה מאבולוציה, מאחר שחיידקים יכולים להסתגל מהר מאוד ולהתגבר על כל מכשול שמגביל את הגדילה שלהם. השינויים שמסייעים לחיידקים להסתגל עשויים להיות מוּנעים על-ידי מוטציות אקראיות בדנ“א שלהם, והתהליך מהיר מאוד – אתם יכולים כמעט לראות אותו קורה בזמן אמת! [5]. נוסף על כך להרבה מהמיקרואורגניזמים שמייצרים אנטיביוטיקה גם יש גֶּנִים שהופכים אותם לעמידים לאנטיביוטיקות האלה. חיידקים טובים מאוד בקבלת דנ”א מאורגניזמים אחרים, כדי לקבל יכולות חדשות. זה נקרא העברה גנטית אופקית [2]. אם חיידקים פתוגנים מקבלים גנים שגורמים להם להיות עמידים לאנטיביוטיקה מסוימת, האנטיביוטיקה הזו נעשית חסרת תועלת מבחינה קלינית. כדי למנוע עמידוּת בפני אנטיביוטיקה, צריך להשתמש באנטיביוטיקות רק כשהן נדרשות (לדוגמה, אי אפשר להרוג וירוסים באמצעות אנטיביוטיקה, ולכן לא צריך לקחת אנטיביוטיקה במקרה של זיהום ויראלי); צריך להשתמש באנטיביוטיקה במינון הנכון (מאחר שכמות קטנה מדי עשויה ליצור צאצאים עמידים), ובמשך כל הזמן שמופיע במרשם, כדי לוודא שכל החיידקים שגורמים לזיהום נהרגו. אם לא נמלא אחר הצעדים האלה, אנו עשויים לסייע להפיץ עמידוּת לאנטיביוטיקה, וזו בעיה גדולה. למעשה, מרבית הפתוגנים החיידקים המסוכנים נעשים עמידים לאנטיביוטיקות רבות [2]. חברות ייצור תרופות מאבדות עניין בפיתוח אנטיביוטיקות חדשות, מאחר שהתרופות האלה עשויות שלא להיות רווחיות עם גדילת העמידות לאנטיביוטיקה. כתוצאה מכך, הקצב שבו אנטיביוטיקות חדשות מתגלות אינו מספיק מהיר כדי להתמודד עם ההופעה של פתוגנים עמידים לאנטיביוטיקה חדשים. אנו עלולים לחזור בקרוב לעידן שלפני האנטיביוטיקה, שבו אנשים שיש להם זיהום חיידקי לא מטופלים באופן יעיל.
מסקנות
תגלית הפניצילין התאפשרה רק במעבדה שבה זיהומים היו שכיחים. המזל בהחלט שיחק תפקיד בגילוי של האנטיביוטיקה הראשונה, אולם ההכשרה והרגלי המעבדה של פלמינג היו הכרחיים לזיהוי אחת התרופות החשובות ביותר בהיסטוריה האנושית. לרוע המזל, כתוצאה מעמידות לאנטיביוטיקה, מיקרוביולוגים נמצאים במרוץ עם פתוגנים חיידקים כדי למצוא דרכים חדשות לטפל בזיהומים. כיום יש לנו הבנה טובה יותר של האופן שבו פתוגנים מְתַקְשְׁרִים עם המארחים שלהם, כיצד חומרים אנטי-מיקרוביים פועלים, ומהם המנגנונים של עמידות לאנטיביוטיקה. אולם אפילו 90 שנה אחרים גילוי הפניצילין, עדיין יש הרבה עבודה שנדרשת במטרה להיאבק במשבר האנטיביוטיקה הנוכחי. אתם יכולים להיות חלק מהמאבק הזה על-ידי השתתפות ביוזמת Swab and Send!
מילון מונחים
פתוגן (Pathogen): ↑ מיקרואורגניזם שחודר לגוף וגורם לזיהום.
צלחת פטרי (Petri Dish): ↑ צלחת מזכוכית או מפלסטיק עם מכסה, שמשמשת לגידול תרביות של יצורים חיים.
מושבת חיידקים (Bacterial Colony): ↑ קבוצה של תאי חיידקים שגדלים יחד על פני השטח של מדיום מוצק, ואשר ניתן לראות בעין בלתי מזוינת.
אזור האינהיביציה (Zone of Inhibition): ↑ אזור שמקיף את מקור האנטיביוטיקה, שבו מושבות חיידקים לא גדלות.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Da Silva, G., and Domingues, S. 2017. We are never alone: living with the human microbiota. Front. Young Minds 5:35. doi: 10.3389/frym.2017.00035
[2] ↑ Madigan, T. M., Bender, K. S., Buckley, D. H., Sattley, W. M., and Stahl, D. A. 2018. Brock Biology of Microorganisms. 15th Edn. London: Pearson.
[3] ↑ Brown, K. 2017. Penicillin Man, Alexander Fleming and the Antibiotic Revolution. Cheltenham: The History Press.
[4] ↑ Swab and Send Initiative. Available online at: https://www.lstmed.ac.uk/public-engagement/swab-send
[5] ↑ Kishony, R. 2016. The Evolution of Bacteria on a “Mega-Plate” Petri Dish. Available online at: https://commons.wikimedia.org/wiki/File:Kishony_lab-The_Evolution_of_Bacteria_on_a_Mega-Plate.webm
