תַקצִיר
כל תאי בגופנו מכיל מנגנון “השמדה עצמית”. תהליך זה של מוות תָּאִי, הוא קריטי להתפתחות של הגוף ולתפקודו התקין, ומהווה מנגנון הגנה בפני מגוון מחלות, כולל סרטן. תאי סרטן עלולים להתפתח מתאים בריאים שבהם מנגנון המוות הַתָּאִי “נתקע” ואינו מופעל. כתוצאה מכך ירכשו תאים אלה תכונת “אלמוות”, ויתרבּו ללא בקרה. בתאים בריאים יֶשְׁנָהּ מערכת מאוזנת של חלבונים המפעילים את מנגנון המוות התאי, ואחרים המעכבים את התהליך. בדומה למערכת ההנעה (גז) ובלמים, במכונית. חוקרים מצאו שבתאים סרטניים חסר חלבון בשם ארטס (ARTS), שחיוני להפעלת מנגנון ההֶרֶג התאי. ללא ארטס, התאים הסרטניים מתחמקים ממוות, והופכים ל“אלמותיים”. גילו מולקולות קטנות דמויות ארטס החודרות לתאים סרטניים ומאלצות תאי סרטן מסוגים שונים “להתאבד”. מולקולות אלה נותנות תקווה לפיתוח תרופות אנטי-סרטניות חדישות.
כ-300 מיליון תאים מתים בגופנו בכל דקה. כ-50 מיליארד תאים מתים בגופנו בכל יום. הם מתים, ותאים חדשים באים במקומם. אפשר אפילו לומר שאנו ממש מתחדשים בכל יום. כמעט נולדים מחדש, ברמה התאית כמובן. רוב התאים מתים בתהליך שנקרא “אַפּוֹפְּטוֹזִיס”, שמשמעותו בלטינית שלכת. ואכן, התאים הישנים, הפגומים, שאינם מתפקדים כיאות, “נושרים” ומתים, ובמקומם באים תאים חדשים השומרים על גופנו ודואגים שיפעל בצורה הטובה ביותר. התהליך הזה כל כך חשוב ובסיסי, שהוא שמור לאורך האבולוציה ומופיע כמעט באותו האופן בתולעים מיקרוסקופיות זעירות, זבובים, עכברים וחולדות, עד וכולל באדם. האפופטוזיס נקרא גם “מוות תאי מתוכנת” וזאת בשל היותו תהליך מסודר, מדויק, הפועל כרצף ארועים שבו כל שלב דוחף לשלב הבא. בדיוק כמו סידורי קוביות הדומינו: מרגע שדחפנו את הקובייה הראשונה התהליך רץ בזה אחר זה, משלב לשלב, עד למותו של התא. זהו מוות “טבעי” המתרחש כחלק מתהליכי השמירה של הגוף על תפקודו התקין.
איך נראה מוות אַפּוֹפְּטוֹטִי של תאים? ראשית, הוא מופעל ברמת התא הבודד. בכל תא מתרחשת “הערכת מצב”, שבה נבדקים נתונים כמו רמת הנזק לתא, יכולת התא לתקן נזקים והיכולת לחזור לתפקוד תקין. כל זה מתרחש תוך כדי העברת איתותים תאיים. מהידיעה על פגיעה בתא (למשל פגיעה בדנ“א שלו) ועד להעברת איתותים על-ידי חלבונים שתפקידם לתקן נזקים בתא. משנכשלו חלבונים אלה במשימתם והתא ״מבין״ שאין עוד ביכולתו להילחם בנזק, מופעל מנגנון ההשמדה העצמית של האפופטוזיס.
כיצד פועל מנגנון האפופטוזיס?
בתוך כל תא ישנם חלבונים שתפקידם לחתוך חלבונים אחרים. חלבונים אלה נקראים קַסְפָּזוֺת (Caspases). חלבונים חותכים אלה עובדים כ-פּאקמנים, ממשחקי המחשב או הווידיאו של פעם. ברגע שהם מופעלים הם מתרבים ומתרבים עד שהם חותכים את כל תכולת התא ומעכלים אותה, שלב המביא למותו של התא. כדי לאזן את פעילותם של חלבונים הרסניים אלה, הדוחפים למותו של התא, ישנם חלבונים אחרים, החלבונים החותכים - קספזות (IAPs–Inhibitors of Apoptosis Proteins). תפקידם של המעכבים הוא למנוע את פעילות החותכים ולעצור אותה כדי שלא יגרמו למוות בלתי רצוי של תאים.
כשמועבר איתות בתוך התא הקובע שהתא מיועד להשמדה, תהיה עלייה במספר ובפעילות החלבונים החותכים שיחתכו, יפרקו ו”יארזו“ את כל תכולת התא בתוך הַמֶּמְבְּרָנָה העוטפת את התא. ממברנה זו תיצור ”בּוּעִיוֹת“ (איור 1) שלתוכן ייכנסו החלבונים המפורקים ושאר תוכן התא. בשלב הבא הבועיות נסגרות והופכות לגופיפים קטנים המכילים את תכולת התא המת. גופיפים אלה ייבלעו על ידי תאים בלעניים בסביבתם, ולא נודע כי בא אל קירבם. כך תאים מתים מוות אפופטוטי [1].
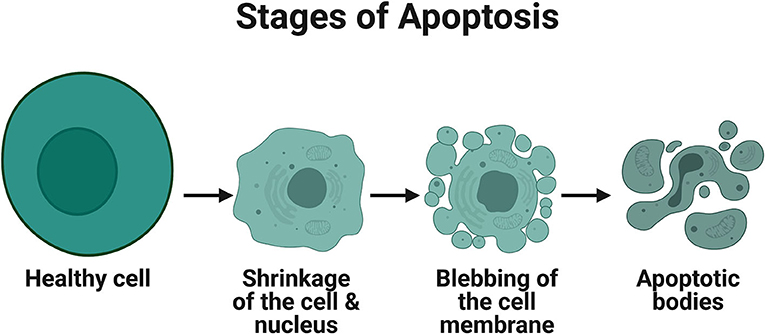
- איור 1 - תמונת מיקרוסקופ של תא בריא (משמאל) לעומת תא בתהליכי מוות – אפופטוזיס (מימין).
- בעוד שהתא הבריא שלם ועגול, בתא העומד למות יש היווצרות של ”בועיות“ בקרום התא. בועיות אלה ייסגרו, ויארזו בתוכן את כל חלבוני התא שנחתכו ופורקו בתהליכי המוות.
חשוב לציין כי ההחלטה של התא למות באפופטוזיס היא הדרך שלו לתמוך ביצור השלם. כאשר תא בודד, איננו מתפקד כיאות, הוא יכול לְסַכֵּן תאים אחרים או את האורגניזם כולו, לכן תאים פגועים יקריבו את עצמם לטובת הכלל כדי להציל את הגוף השלם. תחשבו על זה – למדנו מתורות האבולוציה של דארווין, על כך שהאורגניזם המתאים ביותר, הוא שישרוד. עכשיו אנו מבינים שהישרדותו של האורגניזם, הגוף השלם, תלויה לא פחות בתאים הבודדים שבוחרים להקריב את עצמם לטובת הכלל.
כשהאפופטוזיס משתבש
בשל חשיבותו העצומה של תהליך האפופטוזיס, שיבוש במנגנון זה יגרום למגוון רחב של מחלות. מצד אחד, עלולות להיווצר מחלות כתוצאה ממוות תאי עודף. במחלות כמו אלצהיימר או פרקינסון ישנוֹ מוות רב מידי של תאים במוח. מצד אחר ישנן מחלות שבהן יש חסימה של תהליכי המוות התאי. תהליך זה מאפיין את רוב רובן של מחלות הסרטן למיניהן. תאים בריאים המוצאים דרכים לעקוף את המוות התאי ולמנוע אותו, רוכשים את תכונת ה”אלמוות“ והופכים להיות תאים סרטניים המתרבים ללא בקרה. לכן, פענוח של המנגנון התאי המפעיל את מנגנון ההשמדה העצמית טומן בחובו אפשרויות למציאת תרופות חדשות למחלות מוח ניווניות כמו גם למחלות סרטן רבות [1].
”ארטס“: חלבון מדכא סרטן
במעבדתנו באוניברסיטת חיפה אנו חוקרים את המנגנונים התוך-תאיים המאפשרים מוות תאי, וכיצד שיבוש בתהליכים אלה גורם להפיכה של התאים הבריאים לסרטניים. אנו מתמקדים בחלבון שאותו גילינו וקראנו לו אַרְטְס (ARTS) [2]. ארטס פועל בתחילת רצף האירועים שפועלים בזה אחר זה ומובילים למותו של התא. הוא מאתחל את התהליך על-ידי כך שהוא קושר ומנטרל את החלבונים המעכבים את מוות התאים, וגורם לפירוקם ולהיעלמותם [3]. כלומר, ארטס פועל על-ידי שחרור הבלמים של התא. בכך הוא מאפשר ל”חותכים“ להשתחרר, לחתוך ולפרק את כל חלבוני התא, דבר שיוביל למות (איור 2).
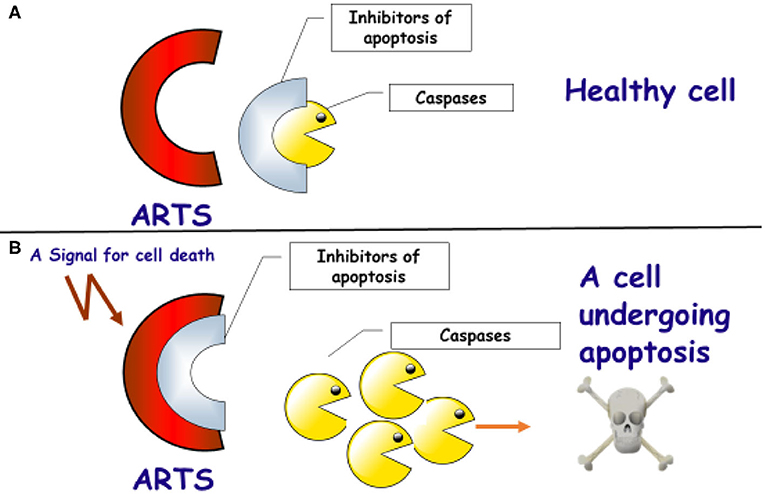
- איור 2 - תפקידו של החלבון ארטס (ARTS) בהפעלת מנגנון המוות בתאים.
- A: ארטס (באדום) נמצא בכל התאים הבריאים. החלבונים המעכבים (באפור) קושרים ומעכבים את פעילותם של החלבונים החותכים – הקספזות (בצהוב). קישור זה ימנע מוות בלתי רצוי של התא. B: במצב שבו התא ייפגע ולא יוכל לתפקד, יופעל איתות להפעלת מוות תאי (אפופטוזיס). כתוצאה מכך החלבון ארטס ייקשר לחלבונים המעכבים. קישור זה יגרום לשחרור החלבונים החותכים (הקספזות). הקספזות יחתכו ויפרקו את חלבוני התא, וזה יגרום למותו של התא באפופטוזיס.
אחת ההוכחות לחשיבותו וחיוניותו של החלבון ארטס להפעלת תהליך המוות התאי היא בכך שלתאים שאיבדו את ארטס יש יכולת נמוכה יותר לבצע אפופטוזיס, ועלולים להפוך לתאים סרטניים. אכן, עכברים שהונדסו להיוולד ללא כל ביטוי של ארטס פיתחו סוגים שונים של סרטן, בעיקר סרטני הדם – לימפוֹמה ולוֹקמיה [4]. נוסף על כך, במחקרים שנעשו בדגימות של חולים בסוגי סרטן שונים מצאנו כי החלבון ארטס חסר ברובן של הדגימות [5]. כלומר, החלבון ארטס פועל כ”חלבון מדכא סרטן“. נוכחותו בתאים מאפשרת הֶרג של תאים בלתי תקינים (איור 2), וחסרונו מאפשר הִתְרַבּוּת של תאים בלתי תקינים אלה והפיכתם לתאים סרטניים.
חלק גדול מהטיפולים האנטי-סרטניים הקיימים כיום (כימותרפיה, הקרנות) פועלים על-ידי הפעלה מכוונת של מנגנון ה”התאבדות“ התאי – גירוי התאים הסרטניים לעבור אפופטוזיס. אולם לטיפולים הקיימים ישנן בעיות קשות של תופעות לוואי כתוצאה מפגיעה בתאים בריאים, פיתוח עמידוּת לתרופות ועוד. אם כך, איך מגייסים את הידע על ארטס כדי לפתח תרופות אנטי-סרטניות חדשניות שיכפו על התאים הסרטניים ”להתאבד“?
מולקולות קטנות דמויות ארטס באות לעזרה!
סוגי סרטן רבים מתחמקים ממוות תאי על-ידי השתקת הביטוי של ארטס, והגברת הביטוי של החלבונים המעכבים מוות תאי. על פניו, הפתרון הפשוט יכול להיות להחזיר את ארטס לתוך התאים הסרטניים שאיבדו אותו. בכך, אפשר יהיה לפרק את החלבונים המעכבים ולאלץ את התאים הסרטניים ”להתאבד“. הבעיה היא שהחלבון ארטס הוא חלבון גדול יחסית, ואין אפשרות להחדיר אותו בשלמותו דרך קרום התא לתוך התאים. אבל מצאנו פתרון! זיהינו מולקולות קטנות מאוד אשר מחקות את הפעילות של ארטס וכן יכולות לחדור את קרום התא. למולקולות קטנות דמויות-ארטס אלה יש את היכולת לעכב את המעכבים בדיוק כפי שהחלבון ארטס עושה, ובכך לדחוף את התאים הסרטניים ”להתאבד“ [6].
ודאי תשאלו – ומה עם התאים הבריאים? הרי חיקויי ארטס יחדרו גם אליהם? התשובה היא שהמולקולות דמויות ארטס אכן ”מתבייתות“ על המעכבים בשני סוגי התאים, הבריאים והסרטניים. אולם, לתאים הסרטניים חסר ארטס, והם מבטאים רמות גבוהות של החלבונים המעכבים מוות תאי. התאים הסרטניים בעצם תלויים ברמות הגבוהות של המעכבים, כדי לחיות. אפשר לְדַמּוֹת זאת לעמידה על צוק גבוה – התאים הסרטניים נמצאים שם על קצה הצוק, אך מצבם מאוד לא יציב. כמות נמוכה יחסית של מולקולות המחקות את ארטס, שתוריד ולוּ במעט את רמת החלבונים המעכבים בהן, תדחוף את התאים הסרטניים לנפילה מהצוק, אל מותם. לעומתם, התאים הבריאים המכילים ארטס ורמות נמוכות יחסית של מעכבים, הם תאים עמידים – הם לא עומדים על הצוק ועל כן יידרשו כמויות גבוהות בהרבה של המולקולות כדי להורגם. הבדל זה בין תאים סרטניים ותאים בריאים מאפשר לנו לטפל בחולים באמצעות ריכוז מסוים של מלקולות קטנות דמויות-ארטס, שיהרוג תאי סרטן ולא יפגע בתאים הבריאים. אנו מקווים שמולקולות אלה דמויות ארטס שאנחנו מפתחים במעבדתנו בימים אלה, תהיינה לתרופות אנטי-סרטניות, שיגרמו למגוון תאים סרטניים לעבור אפופטוזיס, תוך צמצום מירבי של תופעות לוואי.
נסכם בקצרה
מוות תאי מתוכנת, אפופטוזיס, הוא תהליך ביולוגי חיוני שמסלק תאים פגומים ולא מתפקדים שעלולים לסכן את בריאות הגוף. לכן, אפופטוזיס משמש כהגנה מפני הופעתן של מגוון מחלות. תאים אשר מאבדים את יכולתם למות יכולים להפוך לתאים סרטניים. ארטס הוא חלבון הממלא תפקיד מרכזי בהפעלת מנגנון האפופטוזיס. תאים סרטניים יכולים להימלט מאפופטוזיס על-ידי אובדן של ארטס. מולקולות קטנות דמויות-ARTS יכולות לחדור לתאים סרטניים ולהחליף את חלבון ארטס וכך להפעיל מחדש את האפופטוזיס באופן בררני בתאים הסרטניים. מולקולות אלה יכולות להפוך לתרופות אנטי סרטניות חדשות ומבטיחות.
מימון
עבודה זו נתמכה על ידי קרנות מטעם ISF (קרן המדע הישראלית), מענק מס’ 1264/06 ו- 822/12 ומענק INCPM-ISF מס’ 2376/15, קרן הצדקה צ’רלס וולפסון, אנגליה, ובפרס נדיב מטעם קרן Hymen Milgrom.
מילון מונחים
אפופטוזיס (Apoptosis): ↑ אחד הסוגים העיקריים של מוות תאי מתוכנת. זהו תהליך תאי שבו תאים פגומים או שאינם פועלים כיאות ”מתאבדים“ ומוחלפים בתאים בריאים, ובכך מגן מפני מחלות רבות. היכולת להימלט מאפופטוזיס היא מאפיין שכיח ברוב סוגי הסרטן.
החלבונים החותכים – קספזות (CASPAES): ↑ חלבונים המסייעים בתהליך המוות התאי על ידי חיתוך ופירוק של חלבוני התא, מה שמוביל למותו של התא.
חלבונים מעכבי-מוות תאי (IAPs-Inhibitors of Apoptosis Proteins): ↑ חלבונים הקושרים את הקספזות ובכך מעכבים או מונעים מוות תאי בלתי רצוי.
אַרְטְס (ARTS): ↑ ארטס הוא חלבון החשוב להפעלת אפופטוזיס ולדיכוי סרטן. ארטס נמצא ברוב התאים, אך חסר בסוגים רבים של סרטן, שמתחמקים מאפופטוזיס. ארטס מפעיל אפופטוזיס על ידי שבירה ונטרול של חלבונים מעכבי-אפופטוזיס ושיחרור קספזות שחותכות את רוב חלבוני התא, מה שמוביל למותו של התא.
מולקולות קטנות דמויות ארטס (ARTS): ↑ יחידות קטנות מאוד של חומר לא ביולוגי המחקות את פעילותו של ארטס בתוך התאים. מולקולות אלה חודרות את ממבּרנת התא וקושרות את החלבונים המעכבים. קישור זה מאפשר שחרור של הקספזות החותכים אשר יחתכו ויפרקו את התא הסרטני, ויובילו למותו.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
תודות
אנו מודים לרוקאיה עבאס על עבודה מצוינת בהכנת האיור באיור 1.
מקורות
[1] ↑ Fuchs, Y., and Steller, H. 2011. Programmed cell death in animal development. Cell 147:742–58. doi: 10.1016/s0092-8674(00)81873-5
[2] ↑ Larisch, S., Yi, Y., Lotan, R., Kerner, H., Eimerl, S., Tony Parks, W., et al. 2000. A novel mitochondrial septin-like protein, ARTS, mediates apoptosis dependent on its P-loop motif. Nat. Cell Biol. 2:915–21. doi: 10.1038/35046566
[3] ↑ Edison, N., Curtz, Y., Paland, N., Mamriev, D., Chorubczyk, N., Haviv-Reingewertz, T., et al. 2017. Degradation of Bcl-2 by XIAP and ARTS promotes apoptosis. Cell Rep. 21:442–54. doi: 10.1016/j.celrep.2017.09.052
[4] ↑ Garcia-Fernandez, M., Kissel, H., Brown, S., Gorenc, T., Schile, A. J., Rafii, S., et al. 2010. Sept4/ARTS is required for stem cell apoptosis and tumor suppression. Genes Dev. 24:2282–93. doi: 10.1101/gad.1970110
[5] ↑ Elhasid, R., Sahar, D., Merling, A., Zivony, Y., Rotem, A., Ben-Arush, M., et al. 2004. The mitochondrial pro-apoptotic ARTS protein is lost in the majority of Acute Lymphoblastic Leukemia patients. Oncogene 23:5468–7. doi: 10.1038/sj.onc.1207725
[6] ↑ Mamriev, D., Abbas, R., Klinger, F. M., Kagan, J. K. N., Weidenfeld, K., Sheppard, D., et al. 2020. A small-molecule ARTS mimetic promotes apoptosis through degradation of both XIAP and Bcl-2. Cell Death Dis. 11:483. doi: 10.1038/s41419-020-2670-2

