תַקצִיר
מיקרובים הם יצורים זעירים שחיים בתוך גופנו ועליו. רבּים מהם, במיוחד אלה שבמעיים, מסייעים לשמור על בריאותנו. לעיתים, כשאנו אוכלים מזון מקולקל או נוטלים אנטיביוטיקה, אנו מחסלים רבּים מהמיקרובים הטובים האלה. בדרך כלל, המיקרובים הטובים שלנו מתאוששים מההפרעות האלה, אך לעיתים מיקרובים מזיקים יכולים לתפוס את מקומם ולגרום למחלה. קְלוֹסְטְרִידִיוֹם דִיפִיצִילֶה הוא מיקרוב מזיק שגורם לשלשולים קשים. בדרך כלל, אנטיביוטיקה יכולה להרוג אותו ולהשיב את המעיים למצב תקין, אך במקרים מסוימים המיקרוב יכול לחזור שוב ושוב. צורה זו של מיקרוב עמיד לאנטיביוטיקה, עלול אף לגרום למוות כתוצאה מזיהומים חוזרים שלו. לאחרונה, מדענים מצאו שזיהומי קלוסטרידיום דיפיצילה חוזרים יכולים להירפא על ידי השתלת צואה מאדם בריא לאדם חולה. התהליך הזה נקרא השתלת צואה, והוא מציל אלפי חיים בשנה בארצות הברית.
מיקרובים – חברים, לא אויבים!
ייתכן ששמעתם על מיקרובים, או שמעתם שקוראים להם ''חיידקים''. למרות המונחים המפחידים הללו, שמזכירים לנו מחלות, רבים מהאורגניזמים האלה טובים עבורנו וממלאים תפקיד חשוב בשמירה על בריאותנו. אף על פי שאיננו יכולים לראות את היצורים הזעירים האלה, הם נמצאים בכל מקום סביב – באוויר, על הקיר, באדמה, בתוך הגוף ועליו (איור 1). הרוב המוחלט של מיקרובים אינם מזיקים, ואפילו מועילים. הם מכילים חיידקים, ארכאונים, פטריות ווירוסים, שיחד נקראים מִיקְרוֹבִּיוֹטָה, אשר עולים במספרם על מספר התאים האנושיים בגוף, ושוקלים בין חמישית לחצי קילוגרם.
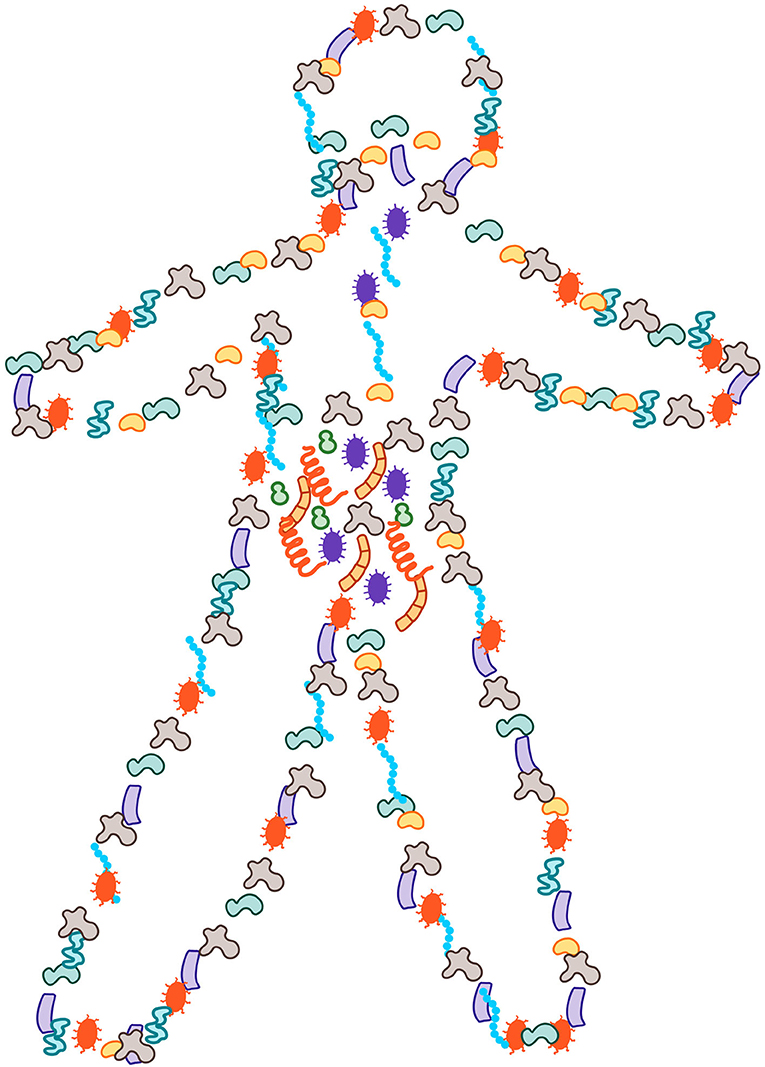
- איור 1 - המיקרובים בגופנו.
- יותר ממחצית התאים בתוך גופנו ועליו הם מיקרובים, אשר שוקלים בין חמישית לחצי קילוגרם. ניתן למצוא את המיקרובים האלה בכל רחבי המשטחים החשופים של גופנו, כשרובם נמצאים בתוך המעיים.
אנו פותחים את חיינו חסרי מיקרובים ברחם [1], ומתחילים לאסוף את המיקרוביוטה שלנו בעת הלידה [2]. בני אדם מקבלים את המיקרובים שלהם מאימהותיהם ומסביבותיהם לאחר הלידה. במהלך מחזור חיים, מאכלסים את גופנו מגוון מיקרובים שונים כתלות במזון שאנו אוכלים; במקום שבו אנו חיים; בכמות הפעילות הגופנית שאנו מבצעים ואפילו כתלות באם יש לנו חתול או כלב [2]. אם כן, גופנו הוא מערכת אקולוגית מורכבת. אנו מספקים בית למיקרוביוטה שלנו, ובתמורה היא מסייעת לנו לשמור על עצמנו בטוחים ובריאים.
המעיים הם המקום שבו חיה מרבית המיקרוביוטה שלנו, והָרְכִיב השכיח ביותר במיקרוביוטה של המעיים הוא חיידקים. חיידקי מעיים מסייעים לנו לעכל מזון; לספוג ויטמינים וחומרי מזון; להגן על הגוף מפני מיקרובים מזיקים שנקראים פָּתוֹגֶנִים ולאמן את מערכת החיסון שלנו במטרה למנוע אלרגיות, אסתמה וליקויים אחרים של מערכת החיסון. חיידקי מעיים יכולים אפילו לשלוח אותות למוחנו, ולשנות את מצבי הרוח שלנו ואת התנהגותנו [3]. כדי להישאר בריאים אנו זקוקים לאיזון נכון בין סוגים שונים של חיידקים במעיים שלנו.
מצב בריאותה של המיקרוביוטה
מהי מיקרוביוטת מעיים בריאה? לכל אדם יש מיקרוביוטה ייחודית, ואין הגדרה אחת שמתאימה לכולם עבור מהי מערכת אקולוגית של מיקרוביוטה בריאה [4]. אפילו אם איננו יודעים בדיוק כיצד נראית מיקרוביוטה בריאה, לעיתים קרובות אנו יכולים לזהות מיקרוביוטה לא בריאה, לדוגמה, אכילת מזון מקולקל עלולה להכניס פתוגנים למעיים שלנו, מה שמוביל לכאבי בטן ולשלשול. מרביתנו לקחנו אנטיביוטיקה בשלב מסוים בחיינו כדי להיפטר מחיידקים שגורמים לנו לחלות. אך אנטיביוטיקות לא יכולות להבחין בין מיקרובים ''טובים'' ו''רעים''. בכל פעם שאנו נוטלים אנטיביוטיקה, אפשר לְדַמּוֹת זאת להדלקת מדורה במעיים שלנו, תוך פגיעה באקולוגיה הפנימית שלנו. ממש כמו יער אחרי שְׂרֵפָה, המערכת האקולוגית של המעיים בדרך כלל מתאוששת מטיפול אנטיביוטי. אולם, לעיתים במקום להתאושש, מיקרובים דמויי-עשב יכולים להשתלט, ולגרום למחלה או למנוע את חזרתם של מיקרובים טובים (איור 2).
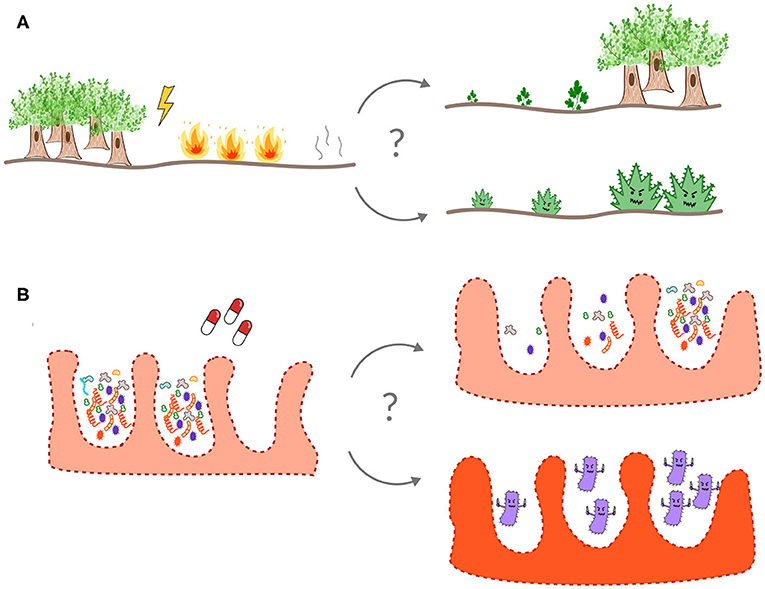
- איור 2 - המערכת האקולוגית של המעיים.
- המעיים הם מערכת אקולוגית, כמו יער או שונית אלמוגים. לעיתים קרובות, מערכת אקולוגית מופרעת, דוגמת יער אחרי שְׂרֵפָה (A) או מיקרוביוטת מעיים אחרי טיפול אנטיביוטי (B), מתאוששת חזרה למצב בריא. אך לעיתים מִינֵי עשביים (או חיידקים כמו קלוסטרידיום דיפיצילה במעיים) יכולים לפלוש ולהשתלט על האזור לאחר ההפרעה, מה שמוביל לקריסה של המערכת האקולוגית התקינה.
זיהומי קלוסטרידיום דיפיצילה קטלניים
קְלוֹסְטְרִידִיוֹם דִיפִיצִילֶה הוא מיקרוב שידוע בתור פתוגן תורפה (אופורטוניסטי). פתוגנים סתגלנים הם מיקרובים שבדרך כלל אינם גורמים לנזק, אך כשהמערכת האקולוגית של המעיים ניזוקה, חיידקים אלה עלולים לפלוש ולגרום לבעיה. לדוגמה, קלוסטרידיום דיפיצילה יכול לעיתים לחיות במעיים של אדם בריא בלי לחולל מחלה – מיקרוביוטת המעיים הָעֲמִידָה מוֹנעת ממנו לייצר רעלנים ולגרום לזיהום. אך כאשר האקולוגיה של המעיים ניזוקה, כמו אחרי נטילת אנטיביוטיקה, הפתוגן הזה יכול להשתלט ולגרום לשלשול חמור (איור 3A) [5]. לפי דו''ח של המרכז לשליטה במחלות (CDC) מ-2011, קלוסטרידיום דיפיצילה גורם לכ-500,000 זיהומים וגורם למוות של כ-15,000 אנשים בארצות הברית מִדֵּי שנה, מה שהופך אותו לאחת המחלות החשובות ביותר ברשימת המניעה של CDC-ה [5]. קלוסטרידיום דיפיצילה נוטה להדביק אנשים מבוגרים יותר עם מערכת חיסונית חלשה, או אנשים שהיו חולים לאחרונה ונטלו אנטיביוטיקה. בכ-70% מהזיהומים שנגרמים עקב מיקרוב זה ניתן לטפל כהלכה באמצעות האנטיביוטיקה וַנְקוֹמִיצִין (איור 3B). אולם, ב-20-35% מהמקרים, הזיהום חוזר אחרי הטיפול באנטיביוטיקה זו [6]. ההדבקות החוזרות בקלוסטרידיום דיפיצילה עמידוֹת מאוד לטיפול נוסף באנטיביוטיקה, מה שמוביל למחזורים בלתי נגמרים של טיפול אנטיביוטי וחזרה של הזיהום, שבסופו של דבר גורמים למוות של מטופלים (איור 3C) [7].
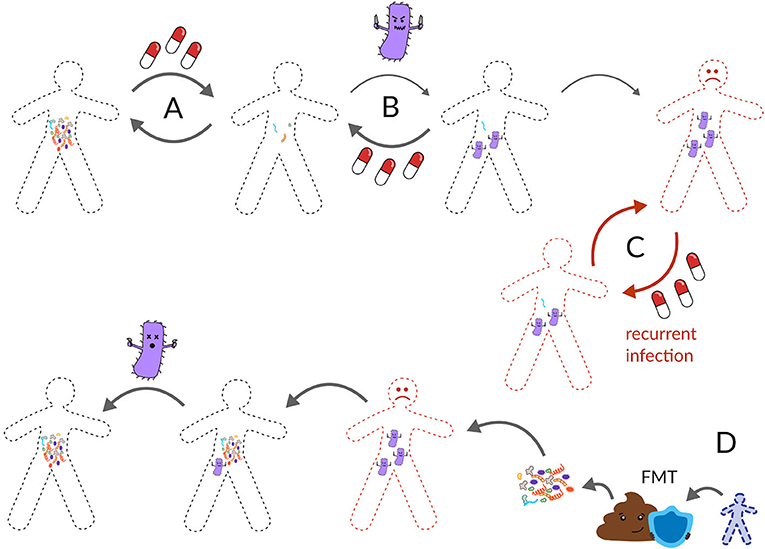
- איור 3 - טיפול בזיהומים חוזרים בקלוסטרידיום דיפיצילה.
- (A) בדרך כלל, מיקרוביוטת המעיים יכולה להתאושש לאחר שימוש באנטיביוטיקה. (B) אולם, לעיתים פתוגן כמו קלוסטרידיום דיפיצילה עלול לפלוש למערכת אקולוגית של מעיים שניזוקה. בדרך כלל, מנה נוספת של אנטיביוטיקה יכולה להחזיר את המעיים למצב בריא. (C) לעיתים, מיקרוב זה חוזר שוב ושוב אחרי אנטיביוטיקה, ונהפך לזיהום חוזר. קלוסטרידיום דיפיצילה חוזר גורם לאלפי מיתות בשנה בארצות הברית. (D) התרופה היעילה ביותר כנגדו היא השתלת צואה מתורם צואה בריא.
השתלת צואה
אם נחשוב שוב על דימוי היער שלנו, דמיינו מערכת אקולוגית שנשרפה, הופשטה מהצמחייה המקומית שלה, וכיום היא מכוסה על ידי עשבים. דרך אחת להחזיר את היער למצבו המקורי תהיה לחתוך את כל העשבים ולשתול פְלוֹרָה (צמחיה) ופָאוּנָה (בעלי חיים) מֵחֶלְקָה קרובה של יער שלא נשרפה. השתלות צואה פועלות באופן דומה. ראשית, מטופל מקבל מנת אנטיביוטיקה במטרה להפחית את שכיחותו של קלוסטרידיום דיפיצילה, ואז הוא מקבל מנה של צואה בריאה מתורם צואה בריא (איור 3D). באופן מסורתי, השתלות צואה בוצעו באמצעות חֹקֶן או דרך צינור שהוכנס מהאף, למטה דרך הגרון ואל המעיים, אולם כעת מטופלים יכולים לבלוע גלולות שמכילות צואה קפואה או צואה שעברה ייבוש בהקפאה. אומנם המנגנונים המדויקים עדיין לא מובנים לגמרי, אך נמצא כי מיקרוביוטה מושתלת ממעיים של אדם בריא משתלטת מחדש על המערכת האקולוגית של המעיים החולים, ודוחפת החוצה את המיקרוב קלוסטרידיום דיפיצילה. השתלות צואה יכולות להיות אוֹטוֹלוֹגיוֹת (צואה בריאה מאותו האדם, שנאספה לפני שהוא חלה), או הטרוֹלוגיוֹת (צואה בריאה מאדם אחר). השתלות צואה התגלו כיעילות ב-80-90% מהמקרים בפתירת זיהומים חוזרים של קלוסטרידיום דיפיצילה1, ושימשו לרפא עשרות אלפי מטופלים בארצות הברית. לכן, השתלת צואה היא אפשרות מצילת חיים עבור אנשים עם קלוסטרידיום דיפיצילה חוזר.
הבטיחות קודמת לכול
השתלות צואה יעילות מאוד, ומִנְהַל המזון והתרופות האמריקאי (FDA) אישר אותן באופן זמני כטיפול בזיהומי קלוסטרידיום דיפיצילה חוזרים. חשוב להיות זהירים במיוחד כאשר בוחרים תורמי צואה בריאה. כיום, חברות שמייצרות חומרי השתלות צואה צריכות לבדוק תורמי צואה ביחס למרבית הפתוגנים האנושיים המוכרים, וביחס לחיידקים עמידים לאנטיביוטיקה. תורמי צואה גם עוברים תהליך סינון מוקפד בהתבסס על אורח חייהם, טיולים שעשו וההיסטוריה הרפואית שלהם. רק הצואה האיכותית ביותר מתקבלת, ותורמים שאושרו יכולים להרוויח עד ל-40 דולר עבור תרומת צואה2. מרבית האנשים הבריאים נושאים פתוגנים סתגלנים במעיים שלהם, שאינם מזיקים כשהמערכת האקולוגית של המעיים בריאה, אך עלולים לגרום לבעיות אם הם מושתלים באדם חולה.
כמה אירועים שהתרחשו הראו עד כמה חשוב תהליך סינון התורמים. במהלך השנים האחרונות, שמונה מטופלים פיתחו זיהומים מפתוגנים שהועברו אליהם דרך השתלת צואה, ושלושה מהם נפטרו עקב כך3. חלק מהמטופלים האלה היו צריכים לעבור השתלות מח עצם, ומערכות החיסון שלהם היו חלשות מאוד, מה שהפך אותם רגישים במיוחד לפתוגנים סתגלנים. במקרה אחד, תורמי הצואה לא עברו סינון על פי הרגולציות העדכניות ביותר [8]. במקרה אחר, בוצע סינון ראוי, אך הוא לא הספיק כדי לאתר פתוגנים מסוימים שגרמו לבעיות אצל שישה מטופלים, מה שהוביל לעדכון של קריטריון הסינון4. אם כן, חיוני שחומרי השתלת צואה יוכנו במעבדה שנמצאת תחת פיקוח של מנהל המזון והתרופות האמריקאי, תוך ביצוע תהליכים מוקפדים. הסינון צריך להיות מעודכן באופן שוטף בתגובה לפתוגנים חדשים כמו סארס-קוֹב-2, המחולל את מחלת הקורונה, ותהליכי השתלת צואה צריכים להיות מבוצעים תמיד על ידי רופאים מוסמכים. לעולם אין לבצע השתלות צואה בבית! יתרה מזו, סיכונים ארוכי-טווח מהשתלות צואה אינם ידועים עדיין במלואם, מאחר שהתהליכים האלה לא היו בשימוש במשך זמן רב. חרף הסכנות הפוטנציאליות של השתלת צואה, חומרים של תורמים שסוננו כראוי מהווים כיום את הטיפול היעיל ביותר כנגד זיהומי קלוסטרידיום דיפיצילה, עם מעט מאוד השפעות שליליות לאחר עשרות אלפי טיפולים ברחבי ארצות הברית.
השתלת צואה: האפשרות המיטבית כיום לטיפול בקלוסטרידיום דיפיצילה חוזר
חרף ההצלחה של השתלות צואה, טיפול זה נותר שנוי במחלוקת. צואה משתנה מאוד בין תורמים, ולא ניתן להסדיר אותה תחת סטנדרטים מוקפדים של רגולציה כמו שמנהל המזון והתרופות האמריקאי מחיל על תרופות אחרות. כדי לפתור את הבעיה הזו, חברות ביוטכנולוגיה רבות נמצאות במרוץ להרכבת חברות מיקרוביות מלאכותיות שיוכלו להיות מיוצרות תחת תנאים מוקפדים, ואשר מחקות את ההשפעות של צואה אנושית טבעית בטיפול בזיהומי קלוסטרידיום דיפיצילה חוזרים. עד כה, אף אחת מחלופות השתלות הצואה הסינתטיות האלה לא הוכחה כיעילה יותר מהשתלת צואה. הקושי העיקרי בפיתוח חלופות להשתלת צואה הוא חוסר בהבנה מפורטת שלנו לגבי האופן שבו השתלות צואה פועלות בדיוק. בעוד שישנהּ תקווה שטיפול פשוט יותר יהיה זמין בקרוב, בינתיים, השתלות צואה הן עדיין האפשרות הטובה ביותר לטיפול בפגיעות של זיהומי קלוסטרידיום דיפיצילה חוזרים.
תודות
SP, SMG ו-CD נתמכו על ידי פרס מטעם קרן וושינגטון למחקר ייחודי, ועל ידי קרנות סטרט אפ מהמכון לביולוגיה של מערכות. BH ו-SS היו חלק מתוכנית שגרירי STEAM לעולם בריא יותר, שנוסדה על ידי תרומות מטעם ,Dee Dickinson, Douglas Howe קרן Dean Witter, ונתמכה על ידי המכון לביולוגיה של מערכות.
מילון מונחים
מיקרוב (Microbe): ↑ אורגניזם מיקרוסקופי.
מִיקְרוֹבִּיוֹטָה (Microbiota): ↑ כל המיקרובים שחיים בתוך גופנו ועליו.
אנטיביוטיקה (Antibiotics): ↑ תרופה שהורגת חיידקים או עוצרת את גדילתם.
קלוסטרידיום דיפיצילה (Clostridioides Difficile): ↑ פתוגן חיידקי סתגלני שגורם מִדֵּי שנה בארצות הברית לשלשול חמור בקרב כמעט 500,000 אנשים, וליותר מ-10,000 מיתות.
פתוגן תורפה (Opportunistic Pathogen): ↑ מיקרוב שבדרך כלל אינו מזיק, אך יכול לגרום למחלה כאשר מערכת החיסון נחלשת, או כשהאקולוגיה התקינה של המיקרוביוטה נפגמת.
השתלת צואה (FMT - Fecal Microbiota Transplant): ↑ תהליך שבו צואה מתורם בריא מושתלת בתוך המעי של מטופל חולה.
אוטולוגי (Autologous): ↑ שמתקבל מאותו הפרט.
הטרולוגי (Heterologous): ↑ שמתקבל מפרט אחר.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
הערת שוליים
1. ↑ https://www.openbiome.org/about-fmt
2. ↑ https://openbiome.org/?s=STOOL+DONATION
3. ↑ http://www.fda.gov/news-events/fda-brief/fda-brief-fda-warns-about-potential-risk-serious-infections-caused-multi-drug-resistant-organisms
4. ↑ /https://openbiome.org/feature/openbiome-announces-enhanced-donor-screening-protocols-following-fda-alert
מקורות
[1] ↑ Goffau, M. C. de, Lager, S., Sovio, U., Gaccioli, F., Cook, E., Peacock, S. J., et al. 2019. Human placenta has no microbiome but can contain potential pathogens. Nature 572:329–34. doi: 10.1038/s41586-019-1451-5
[2] ↑ Rodríguez, J. M., Murphy, K., Stanton, C., Ross, R. P., Kober, O. I., Juge, N., et al. 2015. The composition of the gut microbiota throughout life, with an emphasis on early life. Microb. Ecol. Health Dis. 26:26050. doi: 10.3402/mehd.v26.26050
[3] ↑ Johnson, K. V. A., and Foster, K. R. 2018. Why does the microbiome affect behaviour? Nat. Rev. Microbiol. 16:647–55. doi: 10.1038/s41579-018-0014-3
[4] ↑ McBurney, M. I., Davis, C., Fraser, C. M., Schneeman, B. O., Huttenhower, C., Verbeke, K., et al. Establishing what constitutes a healthy human gut microbiome: state of the science, regulatory considerations, and future directions. J. Nutr. 149:1882–95. doi: 10.1093/jn/nxz154
[5] ↑ CDC. 2016. CDC Press Releases. Available online at: https://www.cdc.gov/media/releases/2015/p0225-clostridium-difficile.html (accessed October 31, 2019).
[6] ↑ Hopkins, R. J., and Wilson, R. B. 2018. Treatment of recurrent Clostridium difficile colitis: a narrative review. Gastroenterol. Rep. 6:21–8. doi: 10.1093/gastro/gox041
[7] ↑ Ofosu, A. 2016. Clostridium difficile infection: a review of current and emerging therapies. Ann. Gastroenterol. Q. Publ. Hell. Soc. Gastroenterol. 29:147–54. doi: 10.20524/aog.2016.0006
[8] ↑ DeFilipp, Z., Bloom, P. P., Torres Soto, M., Mansour, M. K., Sater, M. R. A., Huntley, M. H., et al. 2019. Drug-resistant E. coli bacteremia transmitted by fecal microbiota transplant. N. Engl. J. Med. 381:2043–50. doi: 10.1056/NEJMoa1910437

