תַקצִיר
חלק מהאנשים אומרים שזו גלולת קסם. אחרים מתייחסים אליה כאל נס. אִימָטִינִיבּ היא תרופה שמשמשת לטיפול בסוג מסוים של סרטן הדם. כיום, מטופלים שנוטלים אימטיניב שורדים 30 שנים בממוצע. משמעות הדבר היא שמרביתם יכולים לחיות כמו כל אדם אחר. זה מדהים! בשנות ה-1980, מטופלי סרטן יכלו לצפות לתוחלת חיים של 5-3 שנים בלבד לאחר האבחון. דמיינו עד כמה זה היה קשה למטופלים ולמשפחותיהם! אולם, כיצד אימטיניב פותחה? מדוע אימטיניב נחשבת גלולת קסם? ומדוע הסיפור שמאחורי התרופה מיוחד כל כך? כדי לענות על השאלות האלה, אנו צריכים לטייל אחורה לעבר. המאמר הזה מתאר את התגלית המדהימה של אימטיניב, גלולת הקסם לטיפול בסרטן הדם, את המאמצים של מדענים שהובילו לתגלית הזו ומה למדנו מפיתוח התרופה.
הקדמה
מאז גילוי הדנ“א, הקוד הגנטי שמווסת את החיים והמוות של כל תא, הרפואה התקדמה ופרחה. כמדענים, אנו מבינים מחלות טוב יותר, ולכן אנו יכולים לפתח טיפולים טובים יותר. סרטן הוא מחלה חמורה מאוד. במשך עשורים, רופאים השתמשו בתרופות בעייתיות כדי לטפל בסרטן. חלק מהתרופות לטיפול בסרטן בעייתיות מאחר שהן לא מבחינות בין תאים סרטניים לבין תאים בריאים, ולכן הן הורגות את שניהם. משמעות הדבר היא שמטופלים יכולים לחלות במהלך הטיפול. אימטיניב היא התרופה הַזְּמִינָה הראשונה עבור מטופלים שיש להם סוג נדיר של סרטן, שמשפיע על תאי דם. במאמר הזה, נספר לכם על ההצלחה המדהימה של אימטיניב.
בואו נדבר על סרטן הדם. מהי לוֹקמיה מיאלוֹאידית כרונית?
כשאתם הולכים לרופא, אתם מספרים לו מה התסמינים שלכם, ומצפים שהרופא יאבחן את מצבכם וישלח אתכם לטיפול כך שתוכלו להחלים. בשנת 1845, שני רופאים, דוקטור ג’ון בנט באדינבורו ודוקטור רודולף וירכו בברלין, קיבלו מטופלים שדמם היה חולה. הם לא ידעו מה הייתה המחלה – היא לא הופיעה בספרים שלהם. הם היו הראשונים שתיארו את התסמינים של המחלה החדשה הזו. זה היה סרטן דם שידוע כיום כלוֹקֶמְיָה מיאלוֹאידית כרונית (CML) .[2, 1]
בדם, ישנם שלושה סוגי תאים: תאי דם אדומים (אריתרוֹציטים), שנושאים חמצן לעבר הרקמות וחומרי פסולת כמו למשל פחמן דו-חמצני, לעבר הריאות; תאי דם לבנים (לוֹיקוציטים), שמסייעים להגן עלינו מפני זיהומים; וטַסִּיּוֹת דם (תרוֹמבוציטים), שבונות את הפלסטר הטבעי אשר סוגר פצעים. אצל מטופלי CML, הדם מלא בתאים סרטניים שמאכלסים את החלל שבדרך כלל מאוכלס על ידי סוגים מועילים של תאי דם (איור 1). זה פחות או יותר כל מה שהיה ידוע לגבי המחלה הזו עד 1956.
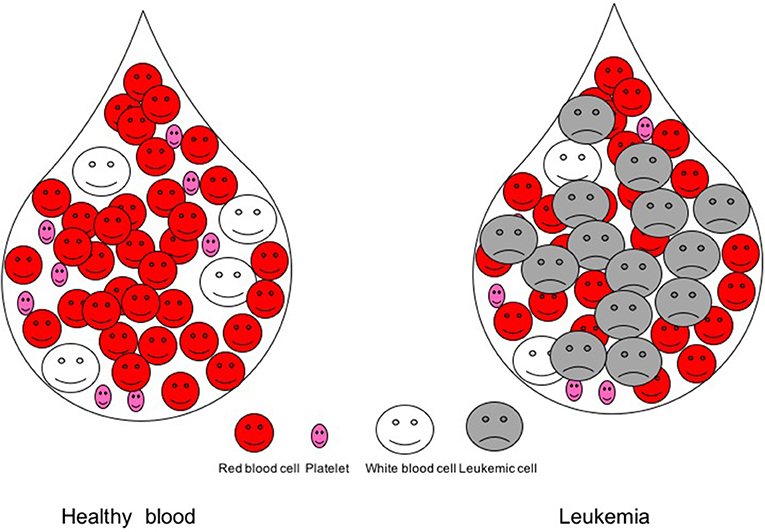
- איור 1 - טיפת דם של אדם בריא ושל חולה לוקמיה.
- בטיפת דם של אדם בריא, ישנם מיליוני תאי דם אדומים, מאות אלפי טסיות דם ואלפי תאי דם לבנים. בדם של חולה לוקמיה, תאי סרטן, שנקראים תאים לוקמיים, מופיעים ועולים במספרם על תאי הדם האחרים.
מה גורם לתאי דם להשתבש? כרומוזום משונה
היה זה רק בשנות ה-1950 המאוחרות כאשר מדענים התחילו להבין מה הפך תאי דם לתאי CML סרטניים. בשנת 1953, הדוקטורים רוזלין פרנקלין, ג’יימס ווטסון ופרנסיס קריק גילו את הדנ”א, הקוד הגנטי שבו נמצא כל המידע על חייו של התא [3]. גילוי הדנ“א הוביל להתפתחות של תחומים ושיטות מחקר חדשים, שבסופו של דבר סייעו למדענים להבין כיצד דנ”א ארוז בתוך התאים שלנו, וכיצד הוא אומר לתאים מה לעשות. אחרי הכול, אם התאים הופכים לתאים סרטניים, משהו צריך לקרות בתוך התא שגורם לתופעה הזו!
בשנת 1956, הדוקטורים ג’ו טג’ו ואלברט לֶבָן גילו שדנ“א אנושי ארוז ב-46 כרומוזומים (איור 2). מדענים התחילו להשתמש בשיטות חדשות כדי להתבונן על כרומוזומים, לנתח אותם ולהשוות בין הכרומוזומים מִתָּאִים של אנשים בריאים, לכרומוזומים של מטופלים שהושפעו על ידי מחלות שונות. באופן הזה, מדענים גילו שישנם קשרים בין כרומוזומים אבנורמלים לבין מגוון מחלות אנושיות. לדוגמה, הם גילו שלילדים שאובחנו עם תסמונת דאון יש עותק נוסף של כרומוזום 21. שני מדענים, הדוקטורים פיטר נואל ודייויד האנגרפורד, זיהו קשר בין אבנורמליות של כרומוזומים לבין CML. הם הבחינו בכרומוזום קטן בעל מראה משונה בתאים סרטניים אצל שני מטופלים עם המחלה הזו. האם היה זה רק צירוף מקרים? כדי לענות על השאלה הזו, הם ניתחו חמישה מטופלים נוספים עם אותה המחלה, ומצאו את אותו כרומוזום קטן גם אצל המטופלים הללו. זמן קצר לאחר מכן, הכרומוזום הקטן הזה נקרא כרומוזום פילדלפיה, על שם העיר שבה הוא התגלה (איור 3).
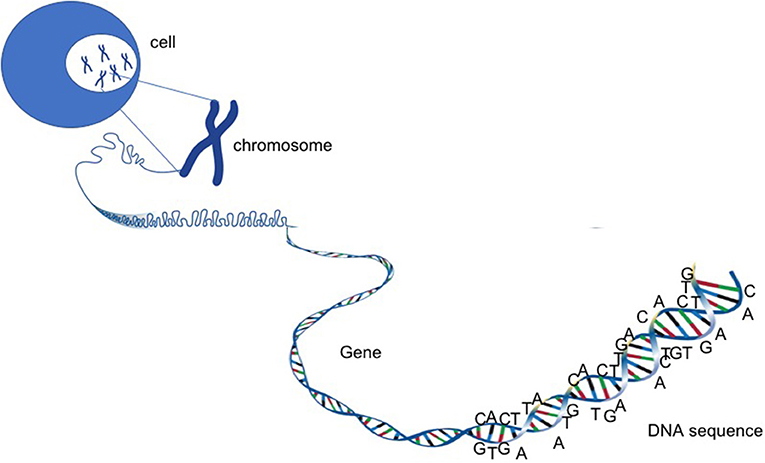
- איור 2 - כרומוזומים, גֶּנִים ודנ”א.
- דנ“א הוא חומר ארוך מאוד ומפותל, שדומה לכדור צמר. הדנ”א מכיל את כל המידע שדרוש לחיים ולמוות של תא. בתוך תאים אנושיים, הדנ“א מאורגן ב-46 כרומוזומים. כל חלק מהמידע נישא באזור שונה של הכרומוזומים. החלקים האלה נקראים גֶּנִים. כל גן הוא יחידה שמקוֹדדת לחלבון בעל תפקוד מסוים.
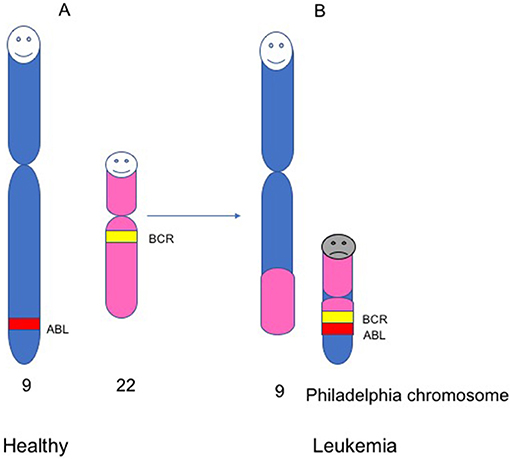
- איור 3 - כרומוזום פילדלפיה.
- אנשים בריאים נושאים 23 זוגות של כרומוזומים 46 (כרומוזומים בסך הכול). (A) כרומוזומים מספר 9 ו-22 אצל אנשים בריאים, ושני גנים בתוך הכרומוזומים האלה, ABL ו-BCR. (B) אצל חולי לוקמיה, ישנו שינוי במבנה של כרומוזומים 9 ו-22. במהלך השינוי הזה, חתיכה מכרומוזום 22 מתחברת לחתיכה מכרומוזום 9. זה יוצר כרומוזום קטן שנקרא כרומוזום פילדלפיה, שבתוכו הגנים BCR ו-ABL מתחברים ליצירת גן חדש, שידוע בשם BCR-ABL.
בואו נתבונן מקרוב יותר על כרומוזום פילדלפיה
בעשורים שלאחר גילוי כרומוזום פילדלפיה, מדענים נהיו מסוגלים לחקור את הארגון של כרומוזומים והמבנה שלהם באמצעות מיקרוסקופ. זה אִפשר למדענים להבין אלו חתיכות בדנ”א היו מחוברות יחד בכרומוזום פילדלפיה. עבור דוקטור ג’נט רואולי, ביולוגית באוניברסיטת שיקגו, זה היה כמו לחבּר פאזל. רואולי ניתחה תאים מתשעה מטופלי CML וגילתה שכרומוזום פילדלפיה היה מורכב מחתיכה של כרומוזום 9 שהודבקה לכרומוזום 22 (איור 3) [4]. מאחר שכל כרומוזום מורכב ממאות גֶּנִים, היה סביר להניח שהחיבור בין כרומוזומים 9 ו-22 חיבר שני גנים יחדיו. אולם אלו גנים? לקח למדענים 10 שנים נוספות לענות על השאלה הזו. המסקנה מכל המחקרים האלה הייתה שלמטופלי CML היה גן שנקרא BCR-ABL, אשר נוצר מהחיבור בין גן BCR מכרומוזום 22 וגן ABL מכרומוזום 9 (איור 3).
גנים רעים יוצרים חלבונים רעים
מדוע BCR-ABL רע? בשנת 1990, מדענים מאוניברסיטת קליפורניה גילו את התפקוד של הגן המחובר BCR-ABL. גנים מכילים את המידע שדרוש לתא ליצור חלבונים. בתאים, חלבונים מבצעים הרבה דברים ויכולים לקחת חלק בגדילה ובמוות של תא. גדילה ומוות הם חשובים מאוד, ולכן החלבונים שממלאים תפקיד בשליטה על גדילה ומוות תאי צריכים להיות מְוֻסָּתִים באופן צמוד. גדילה נורמלית של תאים מווסתת על ידי חלבונים שפועלים כמו רמזורים. כאשר האור ירוק, התאים יודעים שהם יכולים לגדול. כאשר האור אדום, התאים מבינים שהם צריכים להפסיק לגדול. הגן BCR-ABL מייצר חלבון שמחזיק את האור הירוק דולק ואומר לתאים לגדול במטופלי CML, תאי הדם מאבדים שליטה על הגדילה שלהם, וגדלים מהר מדי. זה לא טוב למטופלים מאחר שתאי הסרטן משתלטים על תאי הדם הבריאים והמתפקדים (איור 1).
אם כן, עד שנת 1990 מדענים ידעו שהגנים BCR ו-ABL מחוברים יחד בכרומוזום פילדלפיה ויוצרים חלבון אבנורמלי שאחראי לגדילה מהירה של תאי דם, מה שמוביל ל-CML. העובדה ש-CML נוצרת מחלבון בלתי תקין אחד אומרת שמפתחי התרופה יכלו לחפש מטרה אחת בודדת כדי לרפא CML: הם היו צריכים לכבות את חלבון BCR-ABL ולשנות את אורות הרמזורים מירוק לאדום.
ממדע בסיסי לגילוי תרופה
לרוע המזל, בשנות ה-1990, כיבוי חלבון כמו BCR-ABL לא היה פשוט. ישנם מאות חלבונים שדומים ל- BCR-ABL בתאים שלנו. כיצד אנו יכולים למצוא את הדרך לכבות את BCR-ABL בלי לכבות את כל החלבונים האחרים, מה שעלול להרוג מטופלים?
כאשר מדענים למדו עוד על המבנה של BCR-ABL וחלבונים דומים, הם הבינו שהחלבונים האלה היו מעט שונים זה מזה ומ- BCR-ABL. הפרטים האלה היו הכרחיים לעיצוב תרופה כנגד BCR-ABL.
רופא אמריקאי, דוקטור בריאן דרוקר, ערך ניסויים במעבדה כדי לבחון תרופות אפשריות לטיפול ב-CML. הוא מצא תרופה אחת שנראתה מבטיחה מאוד. כאשר הוא הוסיף את התרופה לתאי CML, הם הפסיקו לגדול. חשוב יותר מכך, כאשר הוא הוסיף את התרופה לתאים בריאים, דבר לא קרה. משמעות הדבר היא שהתרופה הייתה בטוחה לשימוש, ולא הזיקה לתאים בריאים. זה היה בדיוק מה שדוקטור דרוקר חיפש! באמצעות עזרתו של רופא בריטי, דוקטור ג’ון גולדמן, דרוקר עודד חברות תרופות לייצר את התרופה הזו, אשר יכולה לכבות את BCR-ABL.
אימטיניב מגיעה למטופלי CML
שנתיים לאחר מכן, בשנת 2001, חלק ממטופלי CML נטלו את התרופה במסגרת ניסוי קליני. מדענים משתמשים בניסויים קליניים במטרה לבחון תרופות חדשות על מספר קטן של מטופלים. המטופלים מנוטרים באופן צמוד, מבוצעות בדיקות דם, ואם ישנה סיבה להאמין שהתרופה רעילה או שאינה פועלת, הרופאים יכולים להפסיק את הטיפול במהרה. דוקטור דרוקר וקולגות נוספות מצאו שהתרופה הרגה תאי דם סרטניים כמעט אצל כל מטופלי ה-CML [5]. התגובה הזו הייתה מדהימה. זו הייתה הפעם הראשונה שרופאים הבחינו בתגובה כזו על ידי מתן תרופה אנטי-סרטנית אחת, במקום הרבה תרופות בעייתיות! הצוות של דוקטור דרוקר המשיך לעקוב אחר המטופלים במשך כמה שנים. חמש שנים מאוחר יותר, למטופלים עדיין לא היו תאים סרטניים בדם (איור 4). התוצאות האלה היו מרשימות!
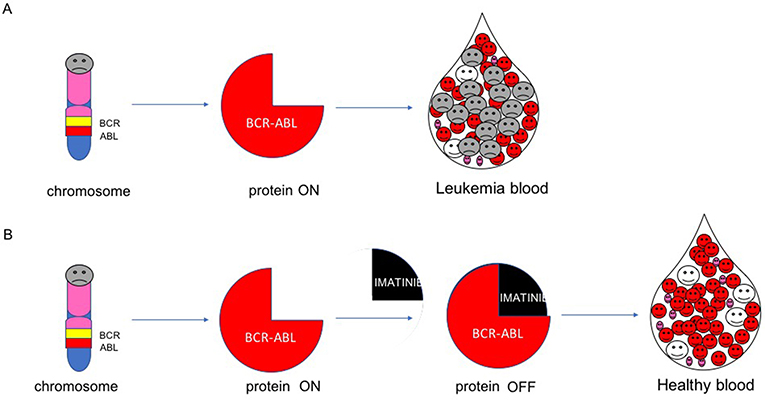
- איור 4 - מנגנון האימטיניב.
- (A) גן ה-BCR-ABL מקוֹדד את החלבון BCR-ABL. כאשר BCR-ABL דולק, הוא גורם לתאים לוקמיים לגדול. (B) אימטיניב מכבה את BCR-ABL והורגת תאים לוקמיים.
מסקנות
אימטיניב הייתה תגלית פורצת דרך, לא רק בשל התוצאות שהיא השיגה ובכך שהצילה את חייהם של אלפי מטופלים, אלא גם בשל האופן שבו התרופה פותחה ומה שמדענים למדו מהפיתוח שלה. אימטיניב לימדה מדענים שעל ידי הבנת הביולוגיה של מחלה – מה קורה כאשר התא “משתבש” באופן כלשהו – אפשר ללמוד איך לטפל במחלה ולרפא אותה. הגישה הזו שימשה מאז לפיתוח תרופות עבור סרטנים אחרים, כמו למשל חלק מסוגי סרטן השחלות, סרטן העור וסרטן הריאות. 41 שנים עברו מגילוי ה-BCR-ABL ועד לפיתוח של אימטיניב. ההתקדמות המדעית מאיצה את קצב פיתוח התרופות. כמדענים, אנו מקווים שההתקדמות הזו תוביל במהירות רבה יותר לסיפורים מוצלחים, כמו סיפורה של האימטיניב. המשיכו לעקוב!
מילון מונחים
דנ“א (DNA): ↑ חומר ארוך מאוד ומפותל שדומה לכדור צמר. זהו חומר שנושא את כל המידע שנדרש עבור החיים והמוות של תא.
אימטיניב (Imatinib): ↑ תרופה מדכאת של חלבון BCR-ABL. היא נקשרת ל-BCR-ABL ומכבה אותו.
לוקמיה מיאלואידית כרונית (Chronic Myeloid Leukemia – CML): ↑ סרטן הדם. אצל מטופלי CML, הדם מלא בתאי סרטן שמאכלסים את כל החלל שבאופן רגיל מאוכלס בתאי דם מתפקדים.
כרומוזומים (Chromosomes): ↑ מבנים שמורכבים מדנ”א. בתוך תאים אנושיים, הדנ“א מאורגן ב-46 כרומוזומים. כל כרומוזום מכיל מאות גנים.
כרומוזום פילדלפיה (Philadelphia Chromosome): ↑ כרומוזום אבנורמלי קטן שבו חתיכה מכרומוזום 22 מתחברת לחתיכה מכרומוזום 9.
גנים (Genes): ↑ יחידת הדנ”א הבסיסית. כל גן מקודד לחלבון בעל תפקיד מסוים.
חלבונים (Proteins): ↑ אבני הבניין שבונות את שאר המרכיבים בגוף.
הצהרת ניגוד אינטרסים
המחברים מצהירים כי המחקר נערך בהעדר כל קשר מסחרי או פיננסי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
מקורות
[1] ↑ Pray, L. 2008. Gleevec: the breakthrough in cancer treatment. Nat. Educ. 1:37.
[2] ↑ Mughal, T. I., Radich, J. P., Deininger, M. W., Apperley, J. F., Hughes, T. P., Harrison, C. J., et al. 2016. Chronic myeloid leukemia: reminiscences and dreams. Haematologica 101:541–58. doi: 10.3324/haematol.2015.139337
[3] ↑ Watson, J., and Crick, F. 1953. A structure for deoxyribose nucleic acid. Nature 171:737–8. doi: 10.1038/171737a0
[4] ↑ Rowley, J. D. 1973. A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature 243:290–3. doi: 10.1038/243290a0
[5] ↑ Druker, B. J, Talpaz, M., Resta, D. J., Peng, B., Buchdunger, E., Ford, J. M., et al. 2001. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N. Engl. J. Med. 344:1031–7. doi: 10.1056/NEJM200104053441401

